

Journal für Kulturpflanzen, 74 (05-06). S. 97–108, 2022 | DOI: 10.5073/JfK.2022.05-06.01 | Baltaci und Borchmann
Anwendung von Phosphorwasserstoff gegen Arthropoden im Vorratsschutz unter besonderer Berücksichtigung der Resistenzproblematik weltweit und für Deutschland – Ein Übersichtsartikel
Phosphine against arthropods in stored product protection with special consideration of the resistance problem worldwide and in Germany: A review article
 | Der Autor/Die Autorin 2022 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 1. Dezember 2021/10. Mai 2022 |
Die Begasung mit Phosphorwasserstoff (PH3) ist eine der wirksamsten Methoden zur Bekämpfung von schädlichen Insekten und Milben im Vorratsschutz. Die übermäßige und fehlerhafte Anwendung dieses Wirkstoffes hat jedoch zur Resistenzentwicklung bei vorratsschädlichen Insekten in vielen Ländern geführt, was die Bekämpfung eines Befalls deutlich erschwert und im ungünstigsten Fall zum Totalverlust der Vorratsgüter pflanzlicher Herkunft führen kann. Falls die Begasungsmaßnahme nicht hinreichend wirkt, wird normalerweise weiter bekämpft, ehe die Ware aufgegeben wird. Die Strategien zur Vermeidung von Resistenzentwicklung gegen PH3 und das Management vorhandener PH3-Resistenzen sind in vielen Ländern bereits ein Teil der guten Praxisanwendung bei Begasungstätigkeiten. In Deutschland sind derzeit keine resistenten vorratsschädlichen Insekten gegen PH3 bekannt. Damit das Risiko der Resistenzentwicklung und Ausbreitung bei den vorratsschädlichen Insekten in Deutschland weiterhin gering bleibt, müssen die Anwendungsregeln und -vorschriften bei der Begasung und Lagerung pflanzlicher Vorratsgüter eingehalten werden. Im vorliegenden Übersichtsartikel werden die weltweite aktuelle Situation und die möglichen Faktoren für eine Resistenzentwicklung gegen PH3 und deren Vermeidung in Deutschland diskutiert.
Resistenz, Vorratsschutz, Phosphorwasserstoff, Resistenzvermeidung
Fumigation with phosphine (PH3) is one of the most effective ways of control insect and mite pests in stored agricultural products. However, the excessive and incorrect use of this active ingredient has led to the development of resistant insects towards phosphine fumigation, which makes it much more difficult to control an infestation and, in the worst case, can lead to the total loss of the stored products. In case of an insufficiency of the fumigation, the treatment usually continues until the controlling of entire insect pests in the stored commodities. The strategies to avoid development of resistance to phosphine are already part of the good practice in fumigation activities in many countries. In Germany, no insects are currently known that are resistant to phosphine in stored products. To ensure that the risk of development and spread of resistance among insects remains low in Germany, the application rules and regulations for fumigation and storage of agricultural products must be fulfilled. In this review article, the current world-wide situation and the possible factors for a development of resistance to phosphine and its prevention in Germany are discussed.
resistance, stored product protection, phosphine, resistance prevention
Phosphorwasserstoff (auch Monophosphan bzw. veraltet Phosphin, PH3) ist weltweit das primäre Begasungsmittel, das in Lager- und Vorratsräumen, Silozellen, Transportmitteln (z. B. Eisenbahnwaggons und Küstenmotorschiffe) und unter gasdichten Planen zur Bekämpfung von Vorratsschädlingen in Getreide, Expellern, Extraktionsschroten sowie auch anderen Produkten, wie Kakaobohnen, Kaffee, Gewürzen, Mandeln usw., eingesetzt wird (BVL, 2016). PH3 ist ein farbloses Gas, das beim Abkühlen zu einer Flüssigkeit kondensiert (Siedepunkt -87,4°C), mit einer relativen Gasdichte von 1,18 nur wenig schwerer als Luft ist und sich deshalb schnell und gleichmäßig im Begasungsraum verteilt. Es ist leicht entzündlich und kann mit Luft bei sehr hohen Gehalten von mehr als 17 Volumenprozent explosive Gemische bilden. Die Löslichkeit dieses Gases ist in Wasser sehr gering, in einigen organischen Lösungsmitteln wie Pyridin, ätherischen Ölen und Fetten jedoch erheblich größer. Der Wirkstoff entwickelt sich bei Einsatz zur Schädlingsbekämpfung aus Metallphosphiden wie Aluminium- (AlP), Magnesium- (Mg3P2) oder Zinkphosphid (Zn3P2) durch hydrolytische Zersetzung zu reinem PH3-Präparat. Metallphosphide werden in gepresster Form mit Zusatzstoffen als Pellets, Tabletten, Plates oder in pulverisierter Form mit Zusatzstoffen in Beuteln eingesetzt (Reichmuth, 1988; Detia-Degesch, 2015). Die PH3-Begasung für Getreide wird üblicherweise bei einem Kornwassergehalt zwischen 9 % und 14 % durchgeführt. Abgesehen von trockenen Klimagebieten, reicht die natürliche relative Luftfeuchtigkeit für die Entwicklung des Wirkstoffes PH3 aus.
Obwohl PH3, besonders bei vielen Larven und Puppen, eher langsam (>5 Tage) wirkt (Ren et al., 2011), wird es wegen seinen geringen Kosten sowie guter Praxistauglichkeit und von den meisten Anwendern als nahezu rückstandsfreies Begasungsmittel bevorzugt, besonders seit dem Wegfall von Brommethan (Methylbromid). Seit 1934 (DELICIA-Kornkäferbegasung, Deutsches Reichspatent 698721 vom 07.11.1934) (Rohrlich & Meuser, 1969) wird PH3 zur Bekämpfung von Schädlingen im Vorratsschutz eingesetzt (Reichmuth et al., 1981; Agrafioti & Athanassiou, 2018). Nach dem Inkrafttreten des ersten Deutschen Pflanzenschutzgesetzes und dem damit verbundenen obligatorischen Zulassungsverfahren am 10. Mai 1968 wurde PH3 in Formen von Aluminium- bzw. Zinkphosphid seit 1971 und als Magnesiumphosphid seit 1975 als Begasungsmittel in Deutschland zugelassen (BVL, 2022). Zinkphosphid wird gegen Nagetiere auf dem Feld eingesetzt.
In Deutschland ist über die letzten zwei Dekaden die Anzahl zugelassener Pflanzenschutzmittel für den Vorratsschutz zurückgegangen. Aktuell sind 10 Wirkstoffe im Pflanzenschutzmittelverzeichnis als Insektizid registriert, darunter vier PH3-Analoga (Tab. 1). Eine zu geringe Anzahl unterschiedlicher Mittel und Wirkstoffe kann aber ein erhöhtes Resistenzrisiko bedeuten, da ein gebotener Wirkstoffwechsel und damit meist auch ein Wechsel des Wirkungsmechanismus deutlich schwieriger ist und je nach Anwendungsgebiet schnell an seine Grenzen gerät. Darüber hinaus kann auch Stickstoff mit geringen Restmengen an Sauerstoff zur Schädlingsbekämpfung im Vorratsschutz eingesetzt werden (Sakka et al., 2020). Nach Pflanzenschutzgesetzt bedarf es dafür keiner Zulassung.
Tab. 1: In Deutschland zugelassene Wirkstoffe für den Vorratsschutz (aus: BVL online Datenbank https://apps2.bvl.bund.de/psm/jsp/index.jsp, Stand: März 2022)
Wirkstoff | Wirkungsbereich | Anzahl der zugelassenen Mittel | Zugelassen seit | Zulassung bis | MoA Gruppe |
Aluminiumphosphid | Insektizid | 11 | 1971 | 2027 | 24A |
Magnesiumphosphid | Insektizid | 4 | 1975 | 2025 | |
Zinkphosphid | Rodentizid | 2 | 1971 | 2025 | |
Phosphorwasserstoff (PH3) | Insektizid | 1 | 1998 | 2026 | |
Pyrethrine | Insektizid | 10 | 1971 | 2023 | 3A |
Deltamethrin | Insektizid | 8 | 1978 | 2023 | |
Cypermethrin | Insektizid | 2 | 1978 | 2023 | |
Sulfurylfluorid | Insektizid | 1 | 2004 | 2024 | 8C |
Kieselgur | Insektizid, Akarizid | 2 | 1997 | 2022 | UNM |
Kohlendioxid | Insektizid, Akarizid | 2 | 1988 | 2023 | n. k. |
Die Aufwandmenge von PH3 kann je nach Anwendungsform und Produktart variieren. Da der Wirkstoff meistens als Feststoff, z. B. Aluminium- und Magnesiumphosphid vermarktet wird, orientiert sich der Aufwand an der Applikation der Darreichungsformen, die in gepresster Form mit Zusatzstoffen als Pellets, als Tabletten, als Plates oder in pulverisierter Form mit Zusatzstoffen in Beuteln oder als Gas (Phosphan) verwendet werden (Tab. 2).
Tab. 2: Die zugelassenen Aufwandmengen für PH3 in gasdichten Räumen und Silozellen (aus: BVL online Datenbank https://apps2.bvl.bund.de/psm/jsp/index.jsp, Stand: März 2022)
Anwendungstechnik | Freisetzung PH3 | Gelagertes Produkt | Temp. (°C) | Aufwandmenge | Einwirkzeit |
Pellets je 0,6 g | 0.2 g | Getreide | > 10 | 50 Stk./m3 | 5 – 14 Tage |
Tabletten je 3 g | 1.0 g | Getreide | k. A. | 15 Stk./t | 4 Tage |
Getreideerzeugnisse (Mehle), Hülsenfrüchte Trockenobst | k. A. | 5 Stk./m3 | 10 Tage | ||
Beutel je 34 g | 11.3 g | Getreide | > 10 | 34 g/t | 120 Std. |
Getreideerzeugnisse (Mehle), Tee, Kakao, Hülsenfrüchte, Gewürze, Kaffee, Expeller, Trockengemüse | > 10 | 30 g/t | 120 Std. | ||
Leere Räume bzw. Silozellen | k. A. | 15 g/t | 120 Std. | ||
Plates je 117 g | 33 g | Getreide | > 10 | 117 g/6 m3 | 2.5 – 5 Tage |
Phosphorwasserstoff als Gas | 1.7 % | Getreide | > 25 – 15 | 3,7 g/m3 | 7 – 10 Tage |
Fetthaltige Samen, Kaffee, Kakao, | > 20 | 3,7 g/m3 | 48 – 96 Std. |
Temperatur und Einwirkzeit sowie Gasdichtigkeit des Lagerobjekts spielen für die Wirksamkeit der Begasung mit PH3 eine entscheidende Rolle. Die Wirksamkeit der PH3-Konzentration variiert je nach Dichtigkeit des begasten Objektes und Geschwindigkeit der Luft- bzw. Windströmung am Begasungsort (Reichmuth, 1993). Die letale Wirkung von PH3 ist bei Temperaturen über 20°C für vorratsschädliche Insekten höher als bei den kühleren Temperaturen. Bei Temperaturen unter 15°C soll eine längere Einwirkzeit sichergestellt werden, damit die vollständige Abtötung erreicht wird (Hole et al., 1976). Auch geringer Sauerstoffgehalt im begasten Objekt und dadurch erhöhte Respiration der Insekten kann die Toxizität des PH3 erhöhen (Bond et al., 1967; Bond et al., 1969; Mueller, 1994). Studien mit verschiedenen Insektenarten zeigen, dass PH3 bei präimaginalen Entwicklungsstadien langsamer als bei den adulten Käfern wirkt (Vincent & Lindgren, 1972; Bell, 1977; Bell et al., 1984; Kaur et al., 2012; Gourgouta et al., 2021). Besonders bei den PH3-toleranten Insektenstämmen von Sitophilus granarius sind die Unterschiede der Mortalität zwischen den Entwicklungsstadien hoch (Howe, 1973). Bei einer Studie von Kashi (1981) überlebten einige Stämme von Sitophilus oryzae und S. granarius bei einer PH3-Konzentration von bis zu 80 mg/l über 24 Stunden, während die Toleranzgrenze bei Stämmen von Tribolium castaneum, T. confusum und Rhyzopertha dominica nicht mehr als 0,2 mg/l PH3 über 12 Stunden betrug. Die Ergebnisse einiger Studien mit verschiedenen Insektenarten zeigen, dass die Toleranz- oder Resistenzgrade je nach gewählten Begasungsmethode und Umweltfaktoren stark variieren können (Bell, 2014). Die Toleranz-/Resistenzmechanismen unterscheiden sich bei hohen und niedrigeren Konzentrationen und die Wirksamkeit kann sich bei Einsatz sehr hoher Konzentrationen gegenüber moderaten Konzentrationen vermindern (Winks & Hyne, 1994).
Die Bildung von resistenten Stämme gegen einen oder mehrere insektizide Wirkstoffe basiert auf der natürlich vorkommenden, vererbbaren Fähigkeit von Insekten, eine Behandlung mit Pflanzenschutzmitteln (PSM) zu überleben, die normalerweise tödlich wirkt (EPPO, 2015). In Erweiterung dazu kann es durch wiederholte subletale Behandlung von Insekten über mehrere Generationen zur Selektion von vererbbarer Resistenz kommen, also zu einer nicht natürlich auftretenden Eigenschaft. Nach dieser Definition stellen Unterschiede in der Empfindlichkeit des Zielorganismus, die in Laboruntersuchungen erkennbar sind, möglicherweise nicht unbedingt auch eine Resistenz dar, wenn der Unterschied nicht zu einer geringeren Wirksamkeit des Insektizids führt (EPPO, 2015). Das Resistenzrisiko eines Pflanzenschutzmittels wird in der EU während der Wirksamkeitsbewertung im Rahmen der Zulassung nach der Verordnung 1107/2009 beurteilt (Anonym, 2009). Strategien zur Resistenzvermeidung werden bei gegebener Erfordernis (und wenn möglich) bereits in den zugelassenen Anwendungen berücksichtigt, so dass die Resistenzgefahr vor dem Inverkehrbringen des Wirkstoffes erkannt und mit geeigneten Maßnahmen reduziert werden kann (Anonym, 2009). Diesbezüglich sind den Antragsunterlagen jeweils Informationen über bekannte Resistenzen bzw. das Resistenzrisiko vorzulegen.
Gegenüber der Resistenz beinhaltet die Toleranz eine nicht vererbbare, sondern vielmehr eine umweltabhängige Widerstandskraft der Insekten ohne Selektionsdruck gegenüber äußeren Einflüssen, wie eben der Wirkung von Pflanzenschutzmitteln. Die stadienabhängige Wirkung von PH3 könnte der Toleranz zugeschrieben werden.
Der Wirkstoffwechsel stellt eine der wichtigsten Maßnahmen für die Resistenzvermeidung dar. Nicht immer stehen aufgrund der geringen Wirkstoffpalette die von der European and Mediterranean Plant Protection Organization (EPPO) und dem Nationalen Aktionsplan zur nachhaltigen Anwendung von Pflanzenschutzmitteln (NAP) empfohlenen mindestens drei unterschiedlichen Wirkungsklassen zur Verfügung. Diese Wirkstoffklassen können wiederum in fünf unterschiedliche Gruppen nach deren Wirksamkeitsmechanismen der Klassifizierung des Insecticide Resistance Action Committee (IRAC) eingeteilt werden (Tab. 1). Eines der wichtigsten Instrumente des IRAC ist das MoA-Klassifizierungsschema (Mode of Action). Dieses Schema bietet Pflanzenschutzmittelanwendern Anhaltspunkte und Richtlinien für die Auswahl von Insektiziden, damit diese in einem Resistenzmanagementprogramm (IRM) erfolgreich eingesetzt werden können. Eine kompakte Auflistung der MoA-Gruppen für vorratsschutzrelevante Mittel ist in der Tab. 1 dargestellt. Eine umfassendere Auflistung der Resistenzklassen ist auf der Internetseite https://irac-online.org/ verfügbar (IRAC, 2020).
Resistenzen entstehen durch einseitigen Selektionsdruck auf die Schadorganismen und die häufige Verwendung derselben Wirkungsklassen von Pflanzenschutzmitteln. Damit wird die Selektion von Individuen mit Resistenzgenen provoziert. Aber auch der fehlerhafte Einsatz von Begasungstechniken kann dazu führen, dass sich Resistenzen bei Insekten entwickeln, weil man die erforderliche Aufwandmenge und Letaldosis unter den gegebenen Praxisanwendungen nicht erreicht oder nicht lang genug aufrechterhalten kann (Abb. 1). Bei den meisten Insekten sind die Ei- und Puppenstadien viel toleranter als die aktiven Larven- oder Erwachsenenstadien (Gautam et al., 2020) und können sich sogar während der Exposition weiterentwickeln. Daher werden für die Schädlingsbekämpfung mit PH3 die empfohlenen Expositionen für die Behandlung so eingestellt, dass sie die Dauer der toleranten Stadien bei jeder Temperatur überschreiten. Wenn keine angemessene Expositionsdauer eingestellt wird, kann dies dazu führen, dass selbst sehr hohe Wirkstoffkonzentrationen nicht die vollständige Tilgung aller Stadien erreicht. Die häufige Nutzung von PH3 zur Bekämpfung von Insekten im Vorratsschutz bei zu kurzer Exposition und/oder in schlecht abgedichteten Lagern hat in vielen Ländern zur Entwicklung resistenter Stämme geführt (Taylor & Halliday, 1986; Bell, 2000). Jagadeesan et al. (2021) berichten, dass auch die Anwesenheit bestimmter Genvarianten wie z. B. rph1 und rph2 bei C. ferrugineus die Resistenz gegen PH3 begünstigen. Die Gene für kutikulares Protein und Mitochondrien sollen ebenfalls eine wichtige Rolle spielen (Chen et al., 2020).
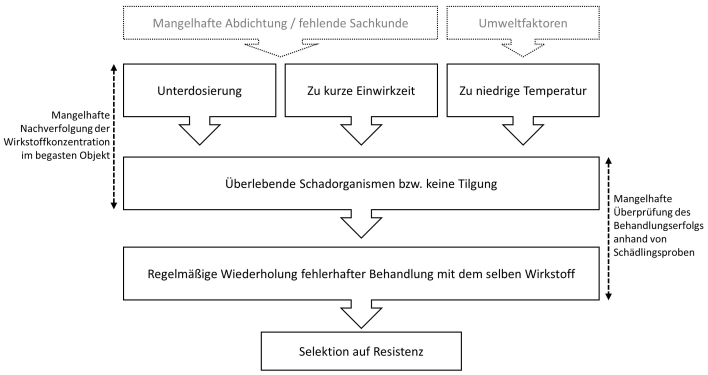
Abb. 1. Entstehung einer Resistenz im Vorratslager gegen Begasungsmittel und die Hauptfaktoren, die eine Resistenzentwicklung begünstigen.
Die Untersuchungen von Collins et al. (2001) und Nayak et al. (2015) zeigten in diesem Zusammenhang eine signifikante Korrelation zwischen einer schnellen Etablierung einer Resistenz und dem lokalen Selektionsdruck sowie der Ausbreitung der resistenten Insekten. Die Studien legen nahe, dass Resistenzen gegen PH3 durch "aktive Exklusion" oder PH3-Sättigung in den trachealen Wänden anstelle niedrigerer Respirationsraten in den Schadorganismen hervorgerufen werden (Price, 1984; Chaudhry & Price, 1992). Die Entgiftung erfolgt also bei den Insekten durch die Exklusion des Gases über die Atemwege. Resistente Insekten können offenbar hohe Konzentrationen über kurze Expositionszeiten überleben, werden jedoch bei längerer Einwirkzeit abgetötet (Chaudhry, 1997). Bei Experimenten im australischen Vorratsschutzinstitut CSIRO (Stored Grain Research Laboratory, Canberra, Australia) wurde die unterschiedlich große Aufnahme von PH3 mit Hilfe von eigens aus radioaktiv markierter Phosphorsäure hergestelltem PH3 durch diverse Imagines verschiedener resistenter Arten nachgewiesen (Reichmuth, 1990). Es konnte während dieser Untersuchungen auch gezeigt werden, dass durch Verlängerung der Einwirkzeit oder auch der Anfangsdosierung selbst hochgradig resistente Tiere abgetötet werden konnten.
In den 1980er und 1990er Jahren gab es in Australien ein massives Problem mit der Resistenz gegen PH3 in den gelagerten Vorräten, die auf 'nicht korrekte' Anwendungsbedingungen wie z. B. undichte Silos, Teil- oder Open-Top-Begasungen zurückzuführen waren (Banks & Annis, 1984; Collins, 1998; Collins et al., 2001). In den 1990er Jahren sind verschiedene technische Lösungen wegen dieser Schwierigkeiten bei der PH3-Begasung entwickelt und in die Praxis eingeführt worden. Probleme bei der Gasverteilung in Silos oder Schiffsladeräumen wurden unter Verwendung der US-Amerikanischen J-Systems™ bzw. CLF-Systeme (Closed Loop Fumigation, dt. Kreislaufbegasung) gelöst. Die Verteilung von PH3 in großen Lagern ist nicht immer gleichmäßig, so dass die elektronisch gemessenen Konzentrationen zeitlich und räumlich stark variieren, wie eine aktuelle Studie aus Griechenland bestätigte (Agrafioti et al., 2020). Eine relativ kostengünstige Methode zur Überwachung der Gaskonzentration mit den Messröhrchen, die in Deutschland besser als Dräger-Röhrchen bekannt sind, für die korrekte Messung der PH3-Konzentration wurde von Brabec et al. (2021) beschrieben.
Von einer Resistenzproblematik im Vorratsschutz wurde zum ersten Mal von Monro (1961) für die Insektenstämme des Kornkäfers (Sitophilus granarius) aus Großbritannien und Kanada berichtet. Resistenzen gegen PH3 zeigten sich beim Rotbraunen Reismehlkäfer (Tribolium castaneum) in Nigeria (Bond et al., 1969; Winks, 1969) und in Australien (Champ & Campbell-Brown, 1970; Dyte, 1974). Die Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO) hat im Jahr 1975 eine weltweite Umfrage über resistente Schadorganismen im Vorratsschutz durchgeführt und über Resistenzfälle gegenüber Malathion, Lindan, Methylbromid und PH3 berichtet, wobei in 33 der 82 untersuchten Ländern Resistenzen festgestellt worden sind (Champ & Dyte, 1977).
Die Studie von Agrafioti et al. (2019) liefert einen umfangreichen Datensatz zur Bewertung der PH3-Resistenz in Griechenland, indem sich 43 von 53 gesammelten Insektenstämme von Rhyzopertha dominica, Sitophilus oryzae, S. granarius, Cryptolestes ferrugineus, Tribolium confusum, T. castaneum und Oryzaephilus surinamensis als resistent erwiesen haben. Von den getesteten Arten wurden R. dominica-Stämme (Getreidekapuziner) im Vergleich zu anderen Arten häufiger als resistent diagnostiziert. Einen guten Überblick kann man in Boyer et al. (2012) finden, indem alle Veröffentlichungen über 139 resistente Insektenstämmen aus 26 Ländern von 1995 bis 2010 zusammengefasst worden sind. In ihrer Publikation haben Boyer et al. (2012) acht PH3-resistente Insektenarten (C. ferrugineus, O. surinamensis, Lasioderma serricorne, R. dominica, S. oryzae, S. zeamais, T. castaneum und Trogoderma granarium) beschrieben, wovon allerdings keine für Deutschland gelistet ist (Boyer et al., 2012). In Australien, wo im Siroflo-Verfahren (Winks) nur Spitzengehalte von 50–100 ppm in Luft eingesetzt wurden, traten massive Resistenzen bei Staubläusen und anderen Insekten auf. Eine aktuelle Studie berichtet von PH3-resistenten Staub- bzw. Bücherläuse (Liposcelis bostrychophila) auf den Philippinen (Mangoba & de Guzman Alvindia, 2021).
Durch den Klimawandel und den globalen Handel mit landwirtschaftlichen Produkten werden Schädlinge weltweit verbreitet, inkl. derer aus Australien, China und Teilen der USA, wo bereits Resistenzen gegenüber PH3 vorkommen (Boyer et al., 2012). Anders als in wärmeren Ländern erfordert das mitteleuropäische Klima meist nur eine einmalige Anwendung pro Partie und Jahr, was insgesamt günstige Rahmenbedingungen mit einem geringen Selektionsdruck für PH3-Resistenzen schafft. Dennoch können der Klimawandel den Selektionsdruck, besonders für die Schadorganismen tropischer Herkunft, erhöhen, da diese Faktoren die Anzahl der Generationen und die Überwinterung und somit das Überleben der Schadinsekten begünstigt. Nach Holloway et al. (2016) kann die Erwärmung aufgrund der höheren Vermehrungsraten einen hohen Selektionsdruck auslösen, da sich eine Mutation für ein Resistenzgen schneller durchsetzen kann. Nach Jackson et al. (2011) sollen die Strategien zur Schädlingsbekämpfung aufgrund der erhöhten Evolutionsrate genetisch unterschiedlicher Stämme und die damit einhergehende mögliche Entwicklung von Resistenzen gegenüber Pflanzenschutzmitteln unter warmen Bedingungen angepasst werden.
Ein signifikanter Unterschied zu den Resistenzgraden gegen PH3 beim Bohnenkäfer wurde auch in verschiedenen Gebieten bzw. klimatischen Regionen eines Landes nachgewiesen (Arora & Srivastava, 2021; Arora et al., 2021).
In den USA und Australien gibt es die meisten Erfahrungen zur Resistenzvermeidung und zum Resistenzmanagement von PH3 im Vorratsschutz. Durch systematisch zu niedrig gewählten Anfangs-Dosierungen von weniger als 1-2 g/m3 (oft auch mit viel zu kurzen Öffnungszeiten) wurden in den USA und Australien schwerwiegende Resistenz aufgebaut. Auch werden Probleme mit der notwendigen Luftfeuchtigkeit für die PH3-Entwicklung aus Metallphosphiden häufig als Ursache für resistenzfördernde PH3-Konzentrationen genannt. Daher wurden die automatisierten Dosiersysteme Siroflo® und CSL unter Verwendung von aus Zylindern dosiertem PH3 (2 %) und CO2 (98 %) verfeinert und bieten eine erhebliche Verbesserung gegenüber anderen Dosierungsmethoden (Winks & Ryan, 1991; Winks & Russell, 1997). Durch die gewählte Technik bei Einsatz relativ geringer Gehalte von PH3 in Luft und dem kontinuierlichen Spülen eines oben offenen Getreidesilos (Open Top Silo, üblich in Australien und den USA) wurde insbesondere in der oberen Getreideschicht durch Rückvermischung mit der umgebenden Luft subletale Begasungsbedingungen bzw. -konzentrationen erzeugt. Die Selektion resistenter Schadinsekten war vorprogrammiert und kann dort bis heute beobachtet werden. Das führte zur Abdichtung dieser Silos im oberen Bereich und der Einführung der Kreislaufbegasung, in Australien SIROCIRC® genannt, mit etwas höheren Gehalten von PH3 (Newman et al., 2000). Herkömmliche Dosiertechniken unter Verwendung von Metallphosphiden wie Aluminium- und Magnesiumphosphid, die nur einige Tage lang PH3 freisetzen, können bei fehlerhaften Anwendungen (mangelhafte Abdichtung, zu niedrige Temperatur etc.) einige Insektenstadien überleben lassen und im ungünstigen Fall das Risiko für eine Resistenzentwicklung erhöhen (Bell, 2000; 2014). Die Kreislaufbegasung wurde bereits Anfang der 1990er Jahre in den USA verbreitet eingesetzt und besonders aufgrund des niedrigen Gaseinsatzes als wirtschaftlich und umweltfreundlich gesehen (Noyes & Kenkel, 1994; Noyes et al., 1999). Allerdings bietet der Einsatz von Kreislaufbegasung bei gasundichten Silos und Lagerräumen optimale Bedingungen für die Resistenzentwicklung der vorratsschädlichen Insekten, wenn die niedrige Dosierung von PH3 für die vollständige Abtötung der Insekten nicht ausreicht.
In Australien wurden strenge Anwendungsregeln wie Drucktests für Begasungen durchgesetzt (Emery et al., 2011). Australien verfügt über ein wirksames Programm zur Überwachung der PH3-Resistenz, mit dem die landwirtschaftlichen Betriebe und Getreideläger im ganzen Land regelmäßig überwacht werden. Seit seiner Einführung in den 1990er Jahren hat dieses Programm maßgeblich dazu beigetragen, neue Resistenzfälle und deren landesweite Ausbreitung zu erkennen (Nayak et al., 2017). Dies hat es ermöglicht, sowohl entomologische als auch molekulardiagnostische Methoden zu etablieren, um Resistenzgrade („schwach“ bis „stark“) in allen wichtigen vorratsschädlichen Schadorganismen festzustellen (Emery et al., 2011) und neue Anwendungsprotokolle für die Begasung resistenter Insekten zu entwickeln (Nayak et al., 2017). In den 1980er Jahren hat die australische Getreidehandelsgenossenschaft (CBH Group) ein Programm zur Siloabdichtung gestartet. Um den Resistenzen aufgrund von undichten Silos vorzubeugen, haben die westaustralischen Silobauer beschlossen, nur gasdichte Silos zu bauen (Emery et al., 2011). Nach australischem Standard für die Getreidelagerung (AS 2628) müssen an allen neu erbauten als gasdicht geltenden Silos im Leerzustand eine Druckhalbwertzeit von mindestens fünf Minuten erreichen werden (Anonym, 2010).
Dieses Verfahren zur Siloabdichtung wurde erstmalig in Europa durch das vom JKI koordinierte Netzwerk Vorratsschutz (https://www.netzwerk-vorratsschutz.de/) mit Mitteln des BMEL in einem Lager erfolgreich getestet (Abb. 2).
Um das Auftreten PH3-resistenter und -toleranter Stämme erkennen zu können, ist von der FAO ein Resistenztest entwickelt worden (Anonym, 1975). Bei diesem Test können die resistenten Käfer durch Exposition mit PH3 nach einigen Tagen bestimmt werden. Grundsätzlich handelt es sich bei der FAO-Methode um einen Mortalitätstest, bei dem normalempfindliche und resistente Insekten unterschieden werden, indem die adulten Käfer 20 Stunden lang einer Konzentration von etwa 30 bis 50 ppm (je nach Art) PH3 ausgesetzt sind. Aufgrund der niedrigen Dosierung ist eine mögliche Resistenz erst 14 Tage nach der Begasung feststellbar.
Der Resistenztest wurde im Jahr 1992 überarbeitet und als Schnelltest bzw. Knock-Down-Test (KDT) etabliert (Reichmuth, 1992). Hierbei können resistente Käfer bereits nach 20 Minuten erkannt werden (Reichmuth, 1992; Chaudhry, 2000). Damit kann man durch Beobachtung von Tieren aus dem Freiland (z. B. bei Tierproben aus befallener Importware im Hamburger Hafen), die man in einer großen durchsichtigen Plastikspritze von 100 ml einer Gaskonzentration von etwa 100 ppm PH3 in Luft aussetzt und auf anteiligen Eintritt der Tiere in Narkose beobachtet, erstens feststellen, ob diese Tiere resistent sind (wenn sie sich nach 30 Minuten immer noch bewegen) und darüber hinaus zweitens aus der Länge der zeitlichen Verzögerung bis zur Narkose bzw. Immobilität ermitteln, wie hoch etwa der Resistenzgrad dieser Tiere im Verhältnis zu normalempfindlichen Labor-Tieren ist. Die eingeschränkte bzw. verlangsamte Mobilität der Insekten (T. castaneum und R. dominica), die einer PH3-Begasung von 3000 ppm ausgesetzt waren, konnten per automatisierte Video-Tracking-Software nachgewiesen werden (Agrafioti et al., 2021). Auf der Basis des Schnelltestes hat die Firma Detia-Degesch GmbH (Laudenbach, Deutschland) ein Testkit zur Feststellung der Phosphinresistenz entwickelt (Handelsname: Posphine Tolerance Test). Auf Grundlage von Bioassay kann eine Resistenz bei einer Insektenpopulation in weniger als 30 Minuten diagnostiziert werden. Das Prinzip des Tests beruht auf der Mortalitätsrate von 20 adulten Insekten bei einer PH3-Konzentration von 3.000 ppm. Die Parameter des Resistenztests sind zuletzt im Jahr 2018 überarbeitet und aktualisiert worden (Goetze et al., 2018; Athanassiou et al., 2018). In einer ähnlichen Studie konnte man bei 25°C und 50 % rF. nach 1,5 Stunden mit 5 mg/l PH3 (3.600 ppm) einen 99,9 %igen Knockdown (KT99,9) bei resistenten Stämmen von S. oryzae erzielen (Nayak et al., 2019). Ein Vergleich aller Testmethoden zeigt, dass sowohl die Schnelltests als auch der FAO-Test ähnliche Ergebnisse zeigen, was darauf hindeutet, dass die Verwendung eines Schnelltests für einen kurzen Zeitraum von weniger als einer Stunde zum Nachweis der PH3-Resistenz realistische Ergebnisse liefern kann (Agrafioti et al., 2019). In einer aktuelleren Studie konnten die resistenten Insekten sogar nach 18 Minuten mittels eines etablierten Knockdown-Schnelltestes (KT100) festgestellt werden (Afful et al., 2021).
In Deutschland ist der erste Resistenzfall beim Amerikanischen Reismehlkäfer T. confusum gegen PH3 bereits 1977 festgestellt worden (Champ und Dyte, 1977). Mit der weltweiten Ausbreitung der Resistenzproblematik in den 1960er und 1970er Jahren (Monro et al., 1972; Bell, 1976; Bell et al., 1977) wurden in der Bundesrepublik Deutschland am früheren Institut für Vorratsschutz der ehemaligen Biologischen Bundesanstalt für Land- und Forstwirtschaft (BBA, heutiges JKI) von 1975 bis 1984 insgesamt 41 Schädlingsstämme aus dem Inland und 21 Stämme ausländischer Herkunft auf Resistenz gegenüber Malathion, Lindan und Pirimiphos-methyl getestet (Rassmann, 1978). Ergebnisse haben gezeigt, dass nur bei Sitophilus-Arten Resistenzen gegen Lindan und Malathion auftraten (Rassmann, 1988). Im Jahr 2003 ist ein weiterer einzelner Resistenzfall in Deutschland bekannt geworden, bei dem der Kornkäfer S. granarius mit einer PH3-Resistenz im Zusammenhang stand. Die Insekten wurden aus einem niedersächsischen Lagerhaus entnommen und durch die BBA als PH3-resistent getestet.
Adler (1997) und Reichmuth (1992; 1997; 1999; 2004; 2013) haben mehrfach über die Strategien der Resistenzvermeidung, wie z. B. der Dichtigkeit der Lagerräume und fachgerechte Durchführung der Bekämpfungsmaßnahmen gegen vorratsschädliche Insekten in Deutschland, berichtet.
Die Leitlinie für den integrierten Pflanzenschutz im Sektor Vorratsschutz wurde 2019 in den Anhang 1 des Nationalen Aktionsplans zur nachhaltigen Anwendung von Pflanzenschutzmitteln aufgenommen (BAnz AT 23.05.2019 B3). Diese sektorspezifische Leitlinie berücksichtigt Strategien und Maßnahmen zur Vermeidung von Insektizidresistenzen im Vorratsschutz (Flingelli & Kroos, 2014). Im Vorratsschutz sollen zunächst vorbeugende Maßnahmen berücksichtigt werden (Grundsatz 1), wie die Verwendung geeigneter Läger, die Lagerhygiene, die Nutzung der Möglichkeiten für Reinigung, Kühlung und Trocknung. Kommt es dennoch zu notwendigen Bekämpfungsmaßnahmen, dann stehen die nichtchemischen Maßnahmen (Grundsatz 4) ganz oben, wie die Umlagerung und Reinigung von befallenem Lagergut oder die Anwendung biologischer Verfahren. Erst wenn diese, einer Resistenz entgegenwirkenden Maßnahmen nicht greifen, ist die Anwendung der chemischen Vorratsschutzmittel gerechtfertigt (Grundsätze 5 und 6). Bei der Anwendung der chemischen Mittel sind verfügbare Resistenzvermeidungsstrategien anzuwenden (Grundsatz 7), um die Wirksamkeit der Produkte zu erhalten, sofern ein Risiko der Resistenz gegen Pflanzenschutzmaßnahmen bekannt ist und der Umfang des Befalls mit Schadorganismen wiederholte Pflanzenschutzmittelanwendungen erforderlich macht. Dafür zählt neben der fachgerechten und vorschriftsmäßigen Anwendung nach Möglichkeit die Verwendung verschiedener Pflanzenschutzmittel mit unterschiedlichen Wirkungsweisen als wichtigste Maßnahme. Dafür steht allerdings in Deutschland keine ausreichende Anzahl Wirkstoffe für den Vorratsschutz zur Verfügung.
Um die ausreichende Verfügbarkeit von PSM mit unterschiedlichen Wirkmechanismen (MoA) für effiziente Resistenzstrategien zu sichern, sollen Forschungen über alternative Wirkstoffgruppen verstärkt werden (BMEL, 2019).
Im Jahr 2016 wurde am Institut für ökologische Chemie, Pflanzenanalytik und Vorratsschutz des JKI ein Workshop zum Thema "Resistenzstrategien im Vorratsschutz" durchgeführt. Als Ergebnis konnte festgehalten werden, dass derzeit kein akutes PH3-Resistenzproblem in der Bundesrepublik Deutschland bekannt ist. Der Workshop hat die Empfehlung ausgesprochen, dass die Akteure aus Wissenschaft, Zulassung und Praxis für resistenzvermeidende Maßnahmen sensibilisiert werden, um auch im Ernstfall auf Resistenzen schnell und zielführend reagieren zu können. Als resistenzmindernde Maßnahmen gelten:
Vermeidung der Resistenz ist besser als Bekämpfung!
Resistenzmanagement ist höchst effektiv, wenn es entwickelt wird, bevor ein Kontrollprogramm startet!
Korrekte Anwendung des PSM (Konzentration, Zeit, Technik, Abdichtung) ist essenziell!
Schulung und Begaserlehrgänge nach TRGS 512.
Resistenz-Monitoring von Verdachtsfällen.
Rotation von Verfahren zu unterschiedlichen Wirkstoffgruppen („mode of action“)!
PSM-Anwendungen und Resistenzvermeidungsstrategien sollten Teil eines weit verbreiteten integrierten Pflanzenschutz-Programmes sein!
Bei Auftreten von Resistenzen oder resistenzverdächtigen Stämmen sofortiges Handeln (Reduktion des Selektionsdruckes)!
Zur Meldung von Verdachtsfällen auf Resistenz ist auf der Internetseite des Wissensportals Vorratsschutz des Julius Kühn‑Institutes ein Kontaktformular (https://vorratsschutz.julius-kuehn.de/kontakt.php) in Deutschland hinterlegt.
Das mitteleuropäische Klima, die konsequente Umsetzung der guten fachlichen Praxis im Vorratsschutz in Deutschland und die Einhaltung der Grundsätze des integrierten Pflanzenschutzes begünstigen die aktuell noch nachhaltige Wirksamkeit von PH3 und der weiteren verfügbaren chemischen Pflanzenschutzmittel im Vorratsschutz. Häufig sind nur einmalige Anwendungen pro Kultur und Jahr zugelassen oder notwendig: ein vorausschauendes Handeln, das den Selektionsdruck vermindert. Die kleine Wirkstoffpalette kann zudem bereits in einigen Anwendungen durch nicht-chemische Verfahren erweitert werden.
Für die Minderung des Resistenzrisikos ist ein effektives Resistenzmanagement erforderlich. Das Resistenzmanagement kann die Entstehung von Resistenzen nicht verhindern, aber es kann das Auftreten von Resistenzen in der Praxis erheblich senken und somit die Wirksamkeit von PSM-Behandlungen bewahren (FAO, 2012). Die Ursachen einer Resistenzentwicklung sind so früh wie möglich zu erkennen und zu berücksichtigen, damit der bestehende Selektionsdruck wieder gemindert werden kann. Allerdings sollten die Risikominderungsmaßnahmen nicht erst beginnen, wenn die Resistenz bereits vorhanden ist. Gemäß Artikel 56 (4) der VO (EG) Nr. 1107/2009 erstattet der Inhaber einer Zulassung für ein Pflanzenschutzmittel den zuständigen Behörden der Mitgliedsstaaten, die sein Pflanzenschutzmittel zugelassen haben, jährlich Bericht, wenn ihm Informationen über eine unerwartet schwache Wirksamkeit, die Bildung einer Resistenz oder unerwartete Auswirkungen auf Pflanzen, Pflanzenerzeugnisse oder die Umwelt vorliegen (Anonym, 2009). Vorgesehen ist eine kontinuierliche Beobachtung, um im Bedarfsfall die Akteure in Zulassung, Offizialberatung, Wissenschaft und insbesondere Praxis für resistenzmindernde Maßnahmen zu sensibilisieren und im Ernstfall auf Resistenzen schnell und zielführend reagieren zu können. In Deutschland hat das Julius Kühn‑Institut gem. § 57 des Pflanzenschutzgesetzes die Aufgabe, Verfahren des Pflanzenschutzes einschließlich des Resistenzmanagements für Pflanzenschutzmittel zu prüfen und zu entwickeln. Das JKI-Fachinstitut für ökologische Chemie, Pflanzenanalytik und Vorratsschutz verfügt über langjährige Erfahrung und technische Ausstattung, um eine solche Erhebung bundesweit durchzuführen.
Hieraus und aufgrund der bisher noch immer nicht vollständig aufgeklärten Mechanismen der Resistenzbildung gegenüber PH3 ergeben sich die folgenden, mittelfristigen Forschungsfragen für das JKI:
Wie groß ist die Stabilität der Resistenz bei fehlendem Selektionsdruck?
Wie etablieren und breiten sich resistente Vorratsschädlinge in Deutschland aus, die eventuell durch den Import eingeschleppt wurden?
Wie gelingt mittels Digitalisierung im Vorratsschutz und Real-Time-Monitoring bei der Begasung eine effektive Verteilung des Begasungsmittels im Vorratslager?
Die breite Anwendung und Weiterentwicklung der Leitlinie für den integrierten Pflanzenschutz im Sektor Vorratsschutz trägt dazu bei, dass die Resistenzproblematik im Vorratsschutz hinreichend Beachtung findet und die wenigen vorhanden PSM bei Bedarf effizient angewandt werden können. Hierzu ist der enge Kontakt und Austausch von Wissenschaft und Praxis unabdingbar und wird im Rahmen des Netzwerk Vorratsschutz (VSnet) ausgebaut https://www.netzwerk-vorratsschutz.de/vsnet/de/home.
Auch wenn derzeit in Deutschland kein akutes Resistenzproblem im Vorratsschutz besteht, ist das Beobachten von Sensitivitätsänderungen bei Vorratsschädlingen durch alle Beteiligten anzustreben. Nach deutschem Recht wird im Pflanzenschutz auf der Grundlage der vom Anmelder auch für die Behandlung möglicherweise resistenter Tiere vorgelegten Versuchsergebnisse eine Obergrenze für die Dosierung festgelegt, die gerade auch für den Fall des Auftretens resistenter Stämme, den Praktikern erlaubt, mit höherer Dosierung – aber im Rahmen der Zulassung – eine vollständige Bekämpfung aller vorratsschädlichen Insekten sicher zu stellen. Es obliegt dem für die Begasung zuständigen Sachkundeinhaber, je nach Lage die Dosierung festzulegen. Im Normalfall wird diese Dosierung – auch wegen des allgemein gültigen Minderungsgebots – dann unterhalb der Obergrenze liegen. Wegen der möglichen Selektion resistenter Stämme werden in Deutschland vergleichsweise hohen Dosierungen eingesetzt, gerade um die Resistenzentwicklung zu unterbinden.
Verdachtsfälle sollten unmittelbar dem Zulassungsinhaber, der Zulassungsbehörde BVL und dem JKI zwecks weiterer Untersuchungen gemeldet werden. Ein entsprechendes Formular steht im Wissensportal Vorratsschutz online unter https://vorratsschutz.julius-kuehn.de/kontakt.php zur Verfügung.
Wir danken Herrn Dr. Cornel Adler und den gesamten Fachbereich Vorratsschutz sowie Frau Dr. Andrea Krähmer und Herrn Dr. Bernd Hommel für ihre Anregungen und den wissenschaftlichen Austausch.
Der Autor und die Autorin erklären, dass keine Interessenskonflikte vorliegen.
Adler, C., 1997: Resistance – A threat to the use of controlled atmospheres for stored product protection. Proceedings of 4th International Conference Controlled Atmosphere and Fumigation in Stored Products, 21-26 April 1996, 455-466, Printco Ltd., Nicosia, Cyprus.
Afful, E., A. Cato, M.K. Nayak und T.W. Phillips, 2021: A rapid assay for the detection of resistance to phosphine in the lesser grain borer, Rhyzopertha dominica (F.)(Coleoptera: Bostrichidae). Journal of Stored Products Research 91, 101776, DOI: 10.1016/j.jspr.2021.101776.
Agrafioti, P., C.G. Athanassiou, 2018: Insecticidal effect of contact insecticides against stored product beetle populations with different susceptibility to phosphine. Journal of Stored Products Research 79, 9-15, DOI: 10.1016/j.jspr.2018.06.002.
Agrafioti, P., C.G. Athanassiou, M.K. Nayak, 2019: Detection of phosphine resistance in major stored-product insects in Greece and evaluation of a field resistance test kit. Journal of Stored Products Research 82, 40-47, DOI: 10.1016/j.jspr.2019.02.004.
Agrafioti, P., D.L. Brabec, W.R. Morrison III, J.F. Campbell, C.G. Athanassiou, 2021: Scaling recovery of susceptible and resistant stored product insects after short exposures to phosphine by using automated video-tracking software. Pest management science 77 (3), 1245-1255, DOI: 10.1002/ps.6135.
Agrafioti, P., V. Sotiroudas, E. Kaloudis, S. Bantas und C.G. Athanassiou, 2020: Real time monitoring of phosphine and insect mortality in different storage facilities. Journal of Stored Products Research 89, 101726, DOI: 10.1016/j.jspr.2020.101726.
Anonym, 1975: Recommended methods for the detection and measurement of resistance of agricultural pests to pesticides. Tentative method for adults of some major pest species of stored cereals, with methyl bromide and phophine. FAO Method No. 16. Plant Prot. Bull. FAO 23, 12-25.
Anonym, 2009: Verordnung (EG) Nr. 1107/2009 des Europäischen Parlaments und des Rates vom 21. Oktober 2009 über das Inverkehrbringen von Pflanzenschutzmitteln und zur Aufhebung der Richtlinien 79/117/EWG und 91/414. EU, Amtsblatt der Europäischen Union.
Anonym, 2010: Sealed grain-storage silos—Sealing requirements for insect control. Australian Standard AS 2628—2010. Sydney, AU.
Arora, S., C. Srivastava, 2021: Locational dynamics of concentration and efficacy of phosphine against pulse beetle, Callosobruchus maculatus (Fab). Crop Protection 143, 105475, DOI: 10.1016/j.cropro.2020.105475.
Arora, S., J. Stanley, C. Srivastava, 2021: Temporal dynamics of phosphine fumigation against insect pests in wheat storage. Crop Protection 144, 105602, DOI: 10.1016/j.cropro.2021.105602.
Athanassiou, C.G., N.G. Kavallieratos, D.L. Brabec, B. Oppert, R.N.C. Guedes, J.F. Campbell, 2018: From narcosis to recovery: development of a rapid diagnostic test for phosphine resistance. Julius Kühn-Archiv 463, 1006-1008, DOI: 10.5073/jka.2018.463.219.
Banks, H.J., P.C. Annis, 1984: On Criteria for Success of Phosphine Fumigations Based on Observation of Gas Distribution Patterns. In: Developments in Agricultural Engineering. Ed. Ripp, B.E., Elsevier, Vol. 5, S. 327-341.
Bell, C.H., 1976: The tolerance of developmental stages of four stored product moths to phosphine. Journal of Stored Products Research 12 (2), 77-86, DOI: 10.1016/0022-474X(76)90027-8.
Bell, C.H., 1977: Toxicity of phosphine to the diapausing stages of Ephestia elutella, Plodia interpunctella and other Lepidoptera. Journal of Stored Products Research 13 (4), 149-158, DOI: 10.1016/0022-474X(77)90024-8.
Bell, C.H., 2000: Fumigation in the 21st century. Crop Protection 19 (8), 563-569, DOI: 10.1016/S0261-2194(00)00073-9.
Bell, C.H., 2014: A review of insect responses to variations encountered in the managed storage environment. Journal of Stored Products Research 59, 260-274, DOI: 10.1016/j.jspr.2014.06.004.
Bell, C.H., B.D. Hole, P.H. Evans, 1977: The occurrence of resistance to phosphine in adult and egg stages of strains of Rhyzopertha dominica (F.)(Coleoptera: Bostrichidae). Journal of Stored Products Research 13 (2), 91-94, DOI: 10.1016/0022-474X(77)90066-2.
Bell, C.H., S.M. Wilson, H.J. Banks, 1984: Studies on the toxicity of phosphine to tolerant stages of Trogoderma granarium EVERTS (Coleoptera, Dermestidae). Journal of Stored Products Research 20 (2), 111-117, DOI: 10.1016/0022-474X(84)90017-1.
BMEL, 2019: Aktionsplan zur Verbesserung der Situation im Vorratsschutz – Nationaler Aktionsplan zur nachhaltigen Anwendung von Pflanzenschutzmitteln. Bundesministerium für Ernährung und Landwirtschaft (BMEL), Referat 713, Bonn (https://www.nap-pflanzenschutz.de/uploads/tx_bleinhaltselemente/nap_aktionsplan_vorratsschutz_01_2019_low.pdf).
Bond, E.J., H.A.U. Monro, C.T. Buckland, 1967: The influence of oxygen on the toxicity of fumigants to Sitophilus granarius (L). Journal of Stored Products Research 3 (4), 289-294, DOI: 10.1016/0022-474X(67)90032-X.
Bond, E.J., J.R. Robinson, C.T. Buckland, 1969: The toxic action of phosphine absorption and symptoms of poisoning in insects. Journal of Stored Products Research 5 (4), 289-298, DOI: 10.1016/0022-474X(69)90002-2.
Boyer, S., H. Zhang, G. Lempérière, 2012: A review of control methods and resistance mechanisms in stored-product insects. Bulletin of Entomological Research 102 (2), 213-229, DOI: 10.1017/S0007485311000654.
Brabec, D., W. Morrison, J. Campbell, F. Arthur, A. Bruce, K. Yeater, 2021: Evaluation of dosimeter tubes for monitoring phosphine fumigations. Journal of Stored Products Research 91, 101762, DOI: 10.1016/j.jspr.2021.101762.
BVL, 2016: PSM-Zulassungsbericht Frisin. Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, 38104 Braunschweig.
BVL, 2022: Liste der zugelassenen Pflanzenschutzmittel in Deutschland mit Informationen über beendete Zulassungen. Braunschweig, Bundesamt für Verbraucherschutz und Lebensmittelsicherheit.
Champ, B.R., M.J. Campbell-Brown, 1970: Insecticide resistance in Australian Tribolium castaneum (Herbst)(Coleoptera, Tenebrionidae)—II: Malathion resistance in eastern Australia. Journal of Stored Products Research 6 (2), 111-131, DOI: 10.1016/0022-474X(70)90001-9.
Champ, B.R., C.E. Dyte, 1977: FAO global survey of pesticide susceptibility of stored grain pests. Fao Plant Protection Bulletin 25 (2), 49-67.
Chaudhry, M.Q., 1997: Review A Review of the Mechanisms Involved in the Action of Phosphine as an Insecticide and Phosphine Resistance in Stored-Product Insects. Pesticide Science 49 (3), 213-228, DOI: 10.1002/(SICI)1096-9063(199703)49:3<213::AID-PS516>3.0.CO;2-%23.
Chaudhry, M.Q., 2000: Phosphine resistance. Pesticide Outlook 11 (3), 88-91, DOI: 10.1039/B006348G.
Chaudhry, M.Q., N.R. Price, 1992: Comparison of the oxidant damage induced by phosphine and the uptake and tracheal exchange of 32P-radiolabelled phosphine in the susceptible and resistant strains of Rhyzopertha dominica (F.) (Coleoptera: Bostrychidae). Pesticide Biochemistry and Physiology 42 (2), 167-179, DOI: 10.1016/0048-3575(92)90063-6.
Chen, E.-H., J.-Y. Duan, W. Song, D.-X. Wang, P.-A. Tang, 2020: RNA-seq Analysis Reveals Mitochondrial and Cuticular Protein Genes Are Associated with Phosphine Resistance in the Rusty Grain Beetle (Coleoptera:Laemophloeidae). Journal of Economic Entomology 114 (1), 440-453, DOI: 10.1093/jee/toaa273.
Collins, P.J., 1998: Resistance to grain protectants and fumigants in insect pests of stored products in Australia. Proceedings of the Australian Postharvest Technical Conference, CSIRO, Canberra, Australia.
Collins, P.J., G.J. Daglish, M.K. Nayak, P.R. Ebert, D. Schlipalius, W. Chen, H. Pavic, T.M. Lambkin, R. Kopittke, B.W. Bridgeman, 2001: Combating resistance to phosphine in Australia. In: Donahaye, E.J., S. Navarro, J.G. Leesch (Hrsg.) International conference on controlled atmoshphere and fumigation in stored products, Fresno, CA. 29 Oct. – 3 Nov. 2000, Executive Printing Services, Clovis, CA, U.S.A. pp. 593-607.
Detia-Degesch, 2015: Phosphine fumigation standard. Detia Degesch Group, Laudenbach, Germany.
Dyte, C.E., 1974: Problems Arising from Insecticide Resistance in Storage Pests 1. EPPO Bulletin 4 (3), 275-286, DOI: 10.1111/j.1365-2338.1974.tb02361.x.
Emery, R.N., M.K. Nayak, J.C. Holloway, 2011: Lessons learned from phosphine resistance monitoring in Australia. Stewart Postharvest Rev 7 (3), DOI: 10.2212/spr.2011.3.8.
EPPO, 2015: Resistance risk analysis. Standards for efficacy evaluation of plant protection products (http://pp1.eppo.org/getnorme.php?n=213). OEPP/EPPO Bulletin 45 (3), 371-387.
FAO, 2012: Guidelines on prevention and management of pesticide resistance. International code of conduct on the distribution and use of pesticides. Food and Agriculture Organization of the United Nations (FAO), Rome, Italy. E-ISBN 978-92-5-107348-3.
Flingelli, G., G.M. Kroos, 2014: Ausgangslage im Vorratsschutz für die Erstellung der Leitlinien des integrierten Pflanzenschutzes und des Aktionsplanes zur Verbesserung der Situation im Vorratsschutz. Journal für Kulturpflanzen 66 (9), 300–306, DOI: 10.5073/JfK.2014.09.02.
Gautam, S.G., G.P. Opit, C. Konemann, K. Shakya, E. Hosoda, 2020: Phosphine resistance in saw-toothed grain beetle, Oryzaephilus surinamensis in the United States. Journal of Stored Products Research 89, 101690, DOI: 10.1016/j.jspr.2020.101690.
Goetze, M.C., R. Steuerwald, P. Agrafioti, M.K. Sakka, G. Jakob, C.G. Athanassiou, 2018: Technical improvement of the Detia Degesch Phosphine Tolerance Test Kit. Julius-Kühn-Archiv (463), 1002-1006, DOI: 10.5073/jka.2018.463.218.
Gourgouta, M., P. Agrafioti, C.G. Athanassiou, 2021: Insecticidal effect of phosphine for the control of different life stages of the khapra beetle, Trogoderma granarium (Coleoptera: Dermestidae). Crop Protection 140, 105409, DOI: 10.1016/j.cropro.2020.105409.
Hole, B.D., C.H. Bell, K.A. Mills, G. Goodship, 1976: The toxicity of phosphine to all developmental stages of thirteen species of stored product beetles. Journal of Stored Products Research 12 (4), 235-244, DOI: 10.1016/0022-474X(76)90039-4.
Holloway, J.C., M.G. Falk, R.N. Emery, P.J. Collins, M.K. Nayak, 2016: Resistance to phosphine in Sitophilus oryzae in Australia: A national analysis of trends and frequencies over time and geographical spread. Journal of Stored Products Research 69, 129-137, DOI: 10.1016/j.jspr.2016.07.004.
Howe, R.W., 1973: The susceptibility of the immature and adult stages of Sitophilus granarius to phosphine. Journal of Stored Products Research 8 (4), 241-262, DOI: 10.1016/0022-474X(73)90041-6.
IRAC, 2020: IRAC Mode of Action Classification Scheme. February 2020.
Jackson, L.E., S.M. Wheeler, A. Hollander, A. O’Geen, B. Orlove, J. Six, D.A. Sumner, F. Santos-Martin, J. Kramer, W.R. Horwath, 2011: Case study on potential agricultural responses to climate change in a California landscape. Climatic Change 109 (1), 407-427, DOI: 10.1007/s10584-011-0306-3.
Jagadeesan, R., D.I. Schlipalius, V.T. Singarayan, N.S. Nath, M.K. Nayak, P.R. Ebert, 2021: Unique genetic variants in dihydrolipoamide dehydrogenase (dld) gene confer strong resistance to phosphine in the rusty grain beetle, Cryptolestes ferrugineus (Stephens). Pesticide Biochemistry and Physiology 171, 104717, DOI: 10.1016/j.pestbp.2020.104717.
Kashi, K.P., 1981: Toxicity of phosphine to five species of stored‐product insects in atmospheres of air and nitrogen. Pesticide Science 12 (2), 116-122, DOI: 10.1002/ps.2780120203.
Kaur, R., D.I. Schlipalius, P.J. Collins, A.J. Swain, P.R. Ebert, 2012: Inheritance and relative dominance, expressed as toxicity response and delayed development, of phosphine resistance in immature stages of Rhyzopertha dominica (F.) (Coleoptera: Bostrichidae). Journal of Stored Products Research 51, 74-80, DOI: 10.1016/j.jspr.2012.08.002.
Mangoba, M.A.A., D. de Guzman Alvindia, 2021: Phosphine Resistance in Psocid, Liposcelis bostrychophila (Psocoptera) in the Philippines. International Journal of Tropical Insect Science 41 (1), 439-445, DOI: 10.1007/s42690-020-00223-7.
Monro, H.A.U., 1961: Manual of Fumigation for Insect Control. FAO. Manual of Fumigation for Insect Control. FAO.
Monro, H.A.U., E. Upitis, E.J. Bond, 1972: Resistance of a laboratory strain of Sitophilus granarius (L)(Coleoptera, Curculionidae) to phosphine. Journal of Stored Products Research 8 (3), 199-207, DOI: 10.1016/0022-474X(72)90040-9.
Mueller, D.K., 1994: A new method of using low levels of phosphine in combination with heat and carbon dioxide. Fumigants and pheromones 33, 14.
Nayak, M.K., G.J. Daglish, T.W. Phillips, 2015: Managing resistance to chemical treatments in stored products pests. Stewart Postharvest Review 11 (1), 3-article 3, DOI: 10.2212/spr.2015.1.3.
Nayak, M.K., M.G. Falk, R.N. Emery, P.J. Collins, J.C. Holloway, 2017: An analysis of trends, frequencies and factors influencing the development of resistance to phosphine in the red flour beetle Tribolium castaneum (Herbst) in Australia. Journal of Stored Products Research 72, 35-48, DOI: 10.1016/j.jspr.2017.03.004.
Nayak, M.K., R. Kaur, R. Jagadeesan, H. Pavic, T.W. Phillips, G.J. Daglish, 2019: Development of a Quick Knockdown Test for Diagnosing Resistance to Phosphine in Sitophilus oryzae (Coleoptera: Curculionidae), a Major Pest of Stored Products. Journal of Economic Entomology 112 (4), 1975-1982, DOI: 10.1093/jee/toz085.
Newman, C., G. Russell, W. Shore, D. Gock, R. Ryan, 2000: Australian sirocirc recirculatory phosphine fumigation systems at xizui grain terminal and inland depots in china. In: Donahaye, E.J., S. Navarro, J.G. Leesch (Hrsg.). Proceeding of the International Conference on Controlled Atmospheres Fumigation in stored Products, Fresno, CA. 29 Oct. – 3 Nov. 2000, Executive Printing Services, Clovis, CA, U.S.A., pp. 297-306.
Noyes, R.T., P. Kenkel, 1994: Closed loop fumigation systems in the south-western United States. In: Highley, E., E.J. Wright, H.J. Banks, B.R. Champ (Hrsg.). Proceedings of the 6th International Working Conference on Stored-Product Protection, 17-23 April 1994, Canberra, Australia, CAB International, pp. 335-341.
Noyes, R.T., T. Phillips, G.W. Cuperus, E.L. Bonjour, Z. Jin, Q. Liang, Y. Liang, X. Tan, L. Guan, 1999: Advances in recirculation fumigation technology USA. Proceedings of the 7th lnternational Working Conference on Stored-product Protection, pp. 454-461.
Price, N.R., 1984: Active exclusion of phosphine as a mechanism of resistance in Rhyzopertha dominica (F.)(Coleoptera: Bostrychidae). Journal of Stored Products Research 20 (3), 163-168, DOI: 10.1016/0022-474X(84)90025-0.
Rassmann, W., 1978: Untersuchungen über Resistenz gegen Malathion und Lindan bei vorratsschädlichen Käferarten in der Bundesrepublik Deutschland. Anzeiger für Schädlingskunde, Pflanzenschutz, Umweltschutz 51 (2), 17-20.
Rassmann, W., 1988: Insektizidresistenz bei Vorratsschädlingen. Gesunde Pflanzen 40 (1), 39-42.
Reichmuth, C., 1988: Phosphine and selected metal phosphides. International programme on chemical safety envronmental health criteria. Geneva, World Health Organization. International Programme on Chemical Safety. W. H. O. Task Group on Phosphine. Selected Metal Phosphides, 73.
Reichmuth, C., 1990: Toxic gas treatment responses of insect pests of stored products and impact on the environment. Fumigation and controlled atmosphere storage of grain. Cingapura: ACIAR, 56-69.
Reichmuth, C., 1992: Schnelltest zur Resistenzbestimmung gegenuber Phosphorwasserstoff bei vorratsschadlichen Insekten. Mitteilungen der Deutschen Gesellschaft für allgemeine und angewandte Entomologie 8, 245-247.
Reichmuth, C., 1993: Drucktest zur Bestimmung der Begasungsfähigkeit von Gebäuden, Kammern oder abgeplanten Gütern bei der Schädlingsbekämpfung: mit Bemerkungen zur Begasungstechnik. Biologische Bundesanst. für Land-und Forstwirtschaft.
Reichmuth, C., 1997: There is no resistance of stored-product moths against treatment with carbon dioxide under high pressure. Proceedings of 4th International Conference Controlled Atmosphere and Fumigation in Stored Products, 21-26 April 1996, pp. 519-525, Printco Ltd., Nicosia, Cyprus.
Reichmuth, C., 1999: Gefahr von Resistenzen bei Käfern gegen Phosphorwasserstoff. Agrarzeitung Ernährungsdienst 58, 9.
Reichmuth, C., 2004: Resistenz vorratsschädlicher Insekten in Deutschland – was sollte getan werden? Mitteilungen der Deutschen Phytomedizinischen Gesellschaft e. V. 34 (2), 30-31.
Reichmuth, C., 2013: Aussichten für Vorratsschädlinge. Journal für Kulturpflanzen 65 (3), 85-93, DOI: 10.5073/JFK.2013.03.02.
Reichmuth, C., S. Noack, A. Wrede, 1981: Zur Emission von Phosphorwasserstoff im Vorratsschutz. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 33 (9), 132-136.
Ren, Y., B. Lee, B. Padovan, 2011: Penetration of methyl bromide, sulfuryl fluoride, ethanedinitrile and phosphine into timber blocks and the sorption rate of the fumigants. Journal of Stored Products Research 47 (2), 63-68., DOI: 10.1016/j.jspr.2010.04.006.
Rohrlich, M., F. Meuser, 1969: Untersuchungen an mit Phosphorwasserstoff begastem. Sonderdruck aus Getreide und Mehl 19 (2), 9-14.
Sakka, M.K., F. Gatzali, V.T. Karathanos, C.G. Athanassiou, 2020: Effect of Nitrogen on Phosphine-Susceptible and -Resistant Populations of Stored Product Insects. Insects 11 (12), 885, DOI: 10.3390/insects11120885.
Taylor, R., D. Halliday, 1986: The geographical spread of resistance to phosphine by coleopterous pests of stored products. 1986 British Crop Protection Conference. Pests and diseases. Volume 2. Proceedings of a conference held at Brighton Metropole, England, November 17-20, 1986., British Crop Protection Council.
Vincent, L.E., D.L. Lindgren, 1972: Toxicity of Phosphine to the Life Stages of Four Species of Dermestids. Journal of Economic Entomology 65 (5), 1429-1431, DOI: 10.1093/jee/65.5.1429.
Winks, R.G., 1969: Resistance to the fumigant phosphine in a strain of Tribolium castaneum (Herbst). Insect Toxicology Information Service 12, 178.
Winks, R.G., E.A. Hyne, 1994: Measurement of resistance to grain fumigants with particular reference to phosphine. In: Highley, E., E.J. Wright, H.J. Banks, B.R. Champ (Hrsg.). Stored Products Protection–Proceedings of 6th International Working Conference on Stored-product Protection, 17–23 April 1994, Canberra, Australia, pp. 244-250.
Winks, R.G., G.F. Russell, 1997: Active Fumigation Systems: Better ways to fumigate Grain, In: Donahaye, E.J., S. Navarro, A. Varnava (Hrsg.). International Conference on Controlled Atmosphere and Fumigation in Stored Products; 1996, April 21-26; Nicosia, Cyprus. Nicosia, Cyprus: Printco Ltd; 1997, pp. 293-303.
Winks, R.G., R. Ryan, 1991: Recent developments in the fumigation of grain with phosphine, In: Fleurat Lessard, F., P. Ducom (Hrsg.). Proceedings of the Fifth International Working Conference Stored-Products Protection, Bordeaux, September 1990, Vol. 2. pp. 935-943.