

Pheromone im Vorrats- und Materialschutz – Erfahrungen aus 35 Jahren praktischem Einsatz
Pheromones in Stored-Product and Material Protection – 35 Years of practical experiences
Journal für Kulturpflanzen, 65 (5). S. 173–179, 2013, ISSN 1867-0911, DOI: 10.5073/JfK.2013.05.01, Verlag Eugen Ulmer KG, Stuttgart
Seit mehreren Jahrzehnten ist der Einsatz von Lockstoffen gegen Insekten zur Schadensabwehr an Lagergütern und Materialien etabliert. Die Hauptkomponenten der Pheromone aller wirtschaftlich relevanten vorrats- und materialschädlichen Insekten sind bekannt. Zur Früherkennung und zur Populationsdichteüberwachung von Schädlingen nehmen Pheromonfallen eine zentrale Position im Konzept der ökonomischen Schadensschwelle und damit im integrierten Vorrats- und Materialschutz ein. Dies gilt vor allem für Sexuallockstoff-Fallen gegen paarungsbereite Männchen von vorratsschädlichen Motten aus den Gruppen der Zünsler (Pyralidae) mit Dörrobst-, Mehl- und Speichermotte und gegen Kleinschmetterlinge (Tineiden) mit Kleider- und Pelzmotte sowie gegen einige Nagekäfer mit Brot-, Tabak- und Gemeiner Nagekäfer. Durch das sogenannte „Monitoring“ können Bekämpfungsstrategien zunächst zeitlich und räumlich optimiert und anschließend auf Erfolg bewertet werden. Neben Sexualpheromonen sind bei einigen Käfern wie beispielsweise den Korn- und Reismehlkäfern auch Aggregationspheromone, die attraktiv auf beide Geschlechter wirken, verbreitet. Ihr Einsatz zur Bekämpfung, d.h. zum Massenfang von Individuen, wie dies im forstwirtschaftlichen Bereich gegen Borkenkäfer nutzbringend durchgeführt wird, hat sich aufgrund mangelnden Erfolgs im Nachernteschutz jedoch nicht etabliert.
Neben einem wirtschaftlich orientierten Einsatz von Pheromonfallen kann deren Anwendung auch wertvolle allgemeinbiologische Informationen über Schadinsekten liefern. Wird das „Monitoring“ z.B. im Freiland abseits von Lagerstätten für faunistische Erhebungen durchgeführt, können natürliche Vorkommen von Schädlingsarten ermittelt werden. Dies erlaubt Rückschlüsse auf ihre ursprünglichen Lebensräume und auf mögliche adaptative Szenarien beim Übergang zu einer synanthropen und damit für den Menschen schädlichen Lebensweise. Zusätzlich werden auf diese Weise natürliche Habitate, die als Reservoire für Schadpopulationen fungieren könnten, aufgespürt und, wenn notwendig, in ein Bekämpfungsprogramm integriert.
Stichwörter: Pheromon-Etymologie, Monitoring, Faunistik, Ökologie, Kleidermotte, Tineola bisselliella
The application of pheromone baited traps to control pest insects in stored food or materials of use is well established since the past decades. The main pheromone components of all major stored-product and material pests have been identified. Pest monitoring with pheromone traps is a key factor in integrated pest management to estimate population density build-ups and to define economic threshold levels. Especially male attracting sex pheromones, e.g. for the stored-product pyralids, the clothes moths, and some anobiid beetles, function well in this aspect. Optimal control strategies in space and time are guided by pest population monitoring including efficacy evaluation of the undertaken control measures. Comparatively less successful is the application of aggregation pheromones, which are found in grain and flour beetles and which attract both sexes. Well functioning control of bark beetles through mass-trapping with aggregation pheromones in the forest environment could for various reasons not be implemented for stored-product protection, respectively.
Besides an economically driven adoption of pheromone traps, trapping results may also deliver useful information of a pest´s general ecology. The distribution of a pest species outside the synanthropic environment, its occurrence in hidden infestations out-doors can be estimated when monitoring tools are used out-doors, away from any storage facilities. The resulting autecological data can be helpful to detect natural reservoirs of a pest and to possibly reconstruct adaptation scenarios to the men-made environment.
Key words: Pheromone etymology, monitoring, faunistics, ecology, webbing clothes moth, Tineola bisselliella
Der Einsatz von Pheromonen im Vorrats- und Materialschutz hat sich über einen Zeitraum der letzten 35 bis 40 Jahre etabliert. Seit der erfolgreichen Identifizierung des paarungsinitiierenden Lockstoffes von Attagenus unicolor im Jahre 1967 durch Silverstein et al. wurden die chemischen Strukturen der Sexual- und Aggregationspheromone aller relevanten Vorrats- und Materialschädlinge aufgeklärt (Phillips, 1997; Plarre, 1998) (Tab. 1). Unterschieden wird dabei zwischen Sexualpheromonen, die von einem Geschlecht, meistens den Weibchen, abgegeben werden, um den Geschlechtspartner anzulocken und Aggregationspheromonen, die überwiegend von den Männchen produziert werden und attraktiv auf beide Geschlechter wirken (Tab. 1). Sexualpheromone finden sich bei Arten, deren adulte Lebenserwartung in der Regel kürzer als einen Monat ist, wie bei allen vorratsschädlichen Motten und einigen Käfern der Familien Anobiidae, Bruchidae und Dermestidae (Burkholder, 1982). Aggregationspheromone stehen in einem größeren biologischen Zusammenhang als für die alleinige Zusammenführung der Geschlechter (Plarre und Vanderwel, 1999; Wertheim et al., 2005). Sie treten bei Arten auf, deren erwachsene Individuen in der Regel länger als einen Monat leben, wie z.B. bei Curculioniden, Cucujiden und Bostrichiden (Burkholder, 1982). Aggregationspheromone werden in ihrer Lockwirkung oft durch Substratgerüche gesteigert.
Tab. 1. Auflistung ausgewählter Vorrats- und Materialschädlinge mit den Trivialnamen ihrer Pheromone in chronologischer Folge ihrer publizierten Identifizierung einschließlich der Beschreibung des Pheromontypes (wS weiblich produziertes Sexualpheromon, mS männlich produziertes Sexualpheromon, mA männlich produziertes Aggregationspheromon)
Jahr | Schädlingsart | Pheromon Hauptkomponente Trivialname | Pheromontyp | Literaturquelle |
1967 | Attagenus unicolor | Megatomoische Säure | wS | |
1970 | Acanthoscelides obtectus | Trienoat | mS | |
1971 | Plodia interpunctella | ZETA (TDA) | wS | |
Ephestia elutella | ||||
Ephestia cautella | ||||
Ephestia kuehniella | ||||
1972 | Ephestia figuliella | |||
1974 | Sitotroga cerealella | ZEHA (HDA) | wS | |
Anthrenus flavipes | Decenoische Säure | wS | ||
1976 | Trogoderma spec. | Trogodermal | wS | |
1977 | Attagenus brunneus | Megatomoische Säure | wS | |
1978 | Stegobium paniceum | Stegobione | wS | |
1979 | Lasioderma serricorne | Serricornin | wS | |
Dermestes maculatus | Decenoate | wS | ||
1980 | Tribolium spec. | Tribolure | mA | |
1981 | Callosobruchus chinensis | Callosobruchische Säuren | wS | |
Rhizopertha dominica | Dominicalure 1 + 2 | mA | ||
1983 | Cryptolestes spec. | Ferrulactone | mA | |
1984 | Sitophilus oryzae | (Sitophilure) Sitophinone | mA | |
Prostephanus truncatus | Truncall 1 + 2 | mA | ||
Oryzaephilus spec. | diverse makrolide Lactone | mA | ||
1985 | Anthrenus verbasci | Undecenoische Säure | wS | |
Tineola bisselliella | Koiganal | wS | ||
1987 | Corcyra cephalonica | Farnesal | mS | |
Sitophilus granarius | Sitophilate | mA | ||
Anobium punctatum | Stegobione | wS | ||
1988 | Cathartus quadricollis | Quadrilure | mA | |
1991 | Ahasverus advena | Octenol | mA | |
1993 | Anthrenus sarnicus | Decanol | wS | |
1994 | Hylotrupes bajulus | Hydroxyhexanone | mS | |
1996 | Callosobruchus maculatus | Heptenoische Säuren | wS |
Die Trivialnamen identifizierter Pheromone enthalten oftmals einen Hinweis auf die lockstoffproduzierende Art, wie z.B. „Stegobione“ für Stegobium paniceum (Brotkäfer) und „Serricornin“ für Lasioderma serricorne (Tabakkäfer). In den wissenschaftlichen Anfängen der Analyse und Synthese sollte die Etymologie der erfundenen Trivialnamen von Insektenpheromonen darüber hinaus durch geeignete Appendices die verhaltensauslösenden Eigenschaften widerspiegeln, so z.B. „-lure“ bei „Tribolure“ und „Sitophilure“ für die anlockende Wirkung in Tribolium spec. (mehrere Reismehlkäferarten) bzw. Sitophilus spec. (Kornkäfer und Verwandte). Da die verhaltensbeeinflussenden Eigenschaften von Pheromonen jedoch oftmals konzentrationsabhängig sind und bei hohen Mengen von anlockend auf abschreckend wechseln können (Plarre, 1994), wurden einige Bezeichnungen nachträglich geändert, sodass die Trivialnamen aktuell ausschließlich die chemische Großgruppenzugehörigkeit reflektieren (Cardé und Minks, 1997). So wurde z.B. „Sitophilure“ bei Sitophilus oryzae und Sitophilus zeamais in „Sitophinone“ umbenannt, um den ketonischen Chemismus der Substanz zu verdeutlichen (Walgenbach und Burkholder, 1986). Gleiches gilt für „Sitophilate“, einer Esterverbindung als Aggregationspheromon von Sitophilus granarius (Abb. 1).
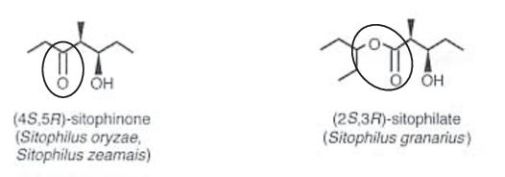
Abb. 1. Strukturformel der Aggregationspheromone bei Sitophilus spp., eingekreiste Strukturelemente sind appendixbestimmend bei der Vergabe der Trivialnamen (Keton für -one und Ester für -ate).
Pheromone können aus einer oder aus mehreren Komponenten bestehen. Anwendungstechnisch werden gegebenenfalls bei mehrkomponentigen Pheromonen Haupt- von Nebenkomponente unterschieden, wenn erstgenannte eine befriedigende biologische Wirkung zeigen. Wirtschaftlich ist es dann oftmals sinnvoll, nur Hauptkomponenten einzusetzen, besonders dann, wenn identische Hauptkomponenten bei unterschiedlichen Arten vorliegen und so ein größeres Spektrum an Schädlingen in Pheromonfallen gefangen werden kann. Dies trifft exemplarisch für die vorratsschädlichen Pyraliden zu. Als Faktoren der reproduktiven Isolation haben die Lockstoffnebenkomponenten aber eine entscheidende biologische Funktion. Sie können als konspezifische Synergisten oder als interartlichere Antagonisten wirken. Nur in seltenen Fällen nutzen verschiedene Arten nach dem derzeitigen Wissensstand vollständig identische Lockstoffe. Dann sind die entsprechenden Arten aber entweder asynchron (tageszeitlich oder saisonal) eingenischt oder dislokal in verschiedenen Habitaten verbreitet bzw. geografisch separiert. Ein Beispiel hierfür liegt beim Brotkäfer (S. paniceum) und beim gemeinen Nagekäfer (Anobium punctatum) vor (White und Birch, 1987).
Die praktische Verwendung von Pheromonen in der Schädlingsprävention bzw. – der Schädlingsbekämpfung lässt sich in die drei Bereiche „Früherkennung“, „Verwirrung“ und „Massenfang“ einteilen (Trematerra, 1997):
Die Früherkennung eines Schädlings und die Überwachung von Populationsdynamiken mittels pheromonbeköderten Fallen, das sogenannte „Monitoring“, macht sich die Sensibilität der Insekten gegenüber Lockstoffen zu Nutze. Das Vorkommen eines Schädlings wird frühzeitig erkannt und geeignete Bekämpfungsmaßnahmen werden zeitlich und räumlich optimiert.
Bei der Verwirrtechnik wird ein zu schützender Bereich mit Sexuallockstoffen derart überladen, dass die intraartliche pheromonale Kommunikation des Schädlings dauerhaft gestört wird und eine erfolgreiche Paarung und Vermehrung nicht mehr möglich ist.
Der Massenfang hat zum Ziel, möglichst viele Individuen einer Schädlingspopulation mittels beköderten Fallen zu entziehen und abzutöten. Der Sonderfall, gefangene Insekten durch geeignetes Fallendesign mit Pathogenen zu kontaminieren und anschließend wieder zu entlassen, damit sie die Population infizieren, verfolgt prinzipiell das gleiche Ziel.
Aufgrund der hohen Sensibilität von Pheromonfallen werden sie auch abseits des synanthropen Lebensraumes und der anthropogenen Vorratshaltung zu faunistischen Untersuchungen eingesetzt. Freilandfänge lassen Aussagen zur geografischen Verbreitung eines Schädlings, zu dessen Vorkommen in natürlichen Habitaten und über die Möglichkeit eines Neubefalls aus diesen Reservoiren heraus zu. Daraus können sich auch Hinweise zu evolutionsökologischen und kulturhistorischen Ereignissen von eingeschleppten, faunenfremden Schädlingen ableiten lassen.
Beispielhaft hierfür waren die Erhebungen von Wohlgemuth et al. (1987) über das Freilandvorkommen der wichtigsten Schadpyraliden Plodia interpunctella, Ephestia kühniella, Ephestia elutella und Ephestia cautella im westlichen Stadtgebiet Berlins und im Umland von Braunschweig. Die Untersuchungen zeigten, dass vorratsschädliche Motten auch außerhalb von Lägern und Lebensmittelindustrien anzutreffen sind. Während in der Stadt Berlin sicherlich private Haushalte ein nicht zu unterschätzendes Schädlingsreservoir angeboten hatten, müssten im ländlichen Raum um Braunschweig auch natürliche Habitate als Refugien der vorratsschädlichen Motten gedient haben. Auffällig bei den Ergebnissen war, dass die in Europa faunenfremde tropische Speichermotte (E. cautella) nicht außerhalb urbaner Gebiete vorkam, während die mitteleuropäisch ubiquitäre Speichermotte (E. elutella) ebenso häufig außerhalb wie innerhalb von Ortschaften gefangen wurde. Dies deutet darauf hin, dass es verschleppten Arten in ihrem neuen Umfeld schwer fallen könnte, sich in natürlichen Habitaten zu etablieren und dort den angestammten Arten erfolgreich zu konkurrieren. Im direkten Umfeld des Menschen aber finden sie Faktoren vor, die ihnen ein Fortkommen ermöglichen oder die sie sogar gegenüber einheimischen Arten begünstigen.
In Anlehnung an diese Freilanderhebung vorratsschädlicher Motten wurde in den Jahren 2008/2009 ein ähnliches Versuchsdesign für die Kleidermotte Tineola bisselliella entworfen und durchgeführt (Plarre und Krueger-Carstensen, 2011). An zahlreichen Standorten innerhalb und außerhalb der Stadtgrenzen von Berlin wurden Pheromonfallen abseits von Gebäuden in wettergeschützten Bereichen ausgebracht. Der Versuch lief von August bis Juli über ein Jahr. Handelsübliche Klebefallen, bezogen von der Firma BIp Biologische Beratung bei Insektenproblemen Ltd., wurden mit einem kommerziell erhältlichen Sexualpheromondispenser der Firma Insects Limited Inc. bestückt. Die Fallenauswertung und der Köderwechsel erfolgten in 14-tägigem Rhythmus.
Abb. 2 zeigt das Fangergebnis von T. bisselliella an 14 verschiedenen Standorten, die von zentralstädtisch nach ländlich geordnet sind. Je ländlicher der Fallenstandort war, desto weniger Kleidermottenmännchen wurden gefangen bis hin zur völligen Abwesenheit dieser Art. Unter den Beifängen zeigte sich, dass eine andere Art, Niditinea fuscipunctella, in so hohen Mengen gefangen wurde, dass ein Zufall auszuschließen war. Die Häufigkeitsverteilung von N. fuscipunctella an den Fallenstadtorten war reziprok zu der der Kleidermotte (Abb. 2). Es ist sehr wahrscheinlich, dass die Männchen dieser Art auf ethanolische Trägerlösungsmittel von Pheromonködern positiv reagierten (Hwang et al., 1978). Als Beifang in Lockstofffallen ist sie keine unbekannte Art (Trematerra und Fiorilli, 1999). Niditinea fuscipunctella ist ein faunistisch gut belegtes Insekt, das in Vogel- und Nagetiernestern brütet, und somit ein typischer Vertreter der Nidicolenfauna Deutschlands ist (Mey persönliche Mitteilung). So verwundert es nicht, dass sie verstärkt in ruralen Gegenden auftritt. Ihr deutscher Trivialname „Nestermotte“ spiegelt dies wider. Die auffällige Abwesenheit der Kleidermotte in diesen ländlichen Gebieten allerdings ist Indiz für ein eusynanthropes und damit urbanes Vorkommen dieses Schädlings.
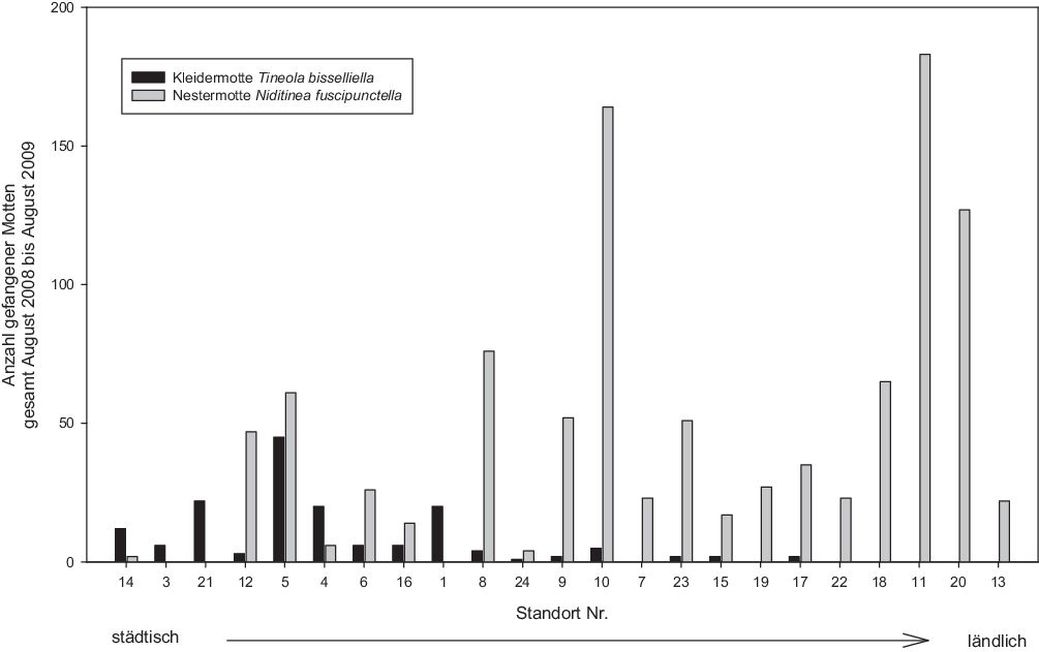
Abb. 2. Fallenfänge an Kleider- und Nestermotten an verschieden Standorten in und um Berlin von städtisch nach ländlich geordnet. Aufgetragen sind absolute Fangzahlen kumulativ für 1 Jahr.
Über faunistische Erhebungen der Kleidermotte in natürlichen Habitaten liegen sehr verwirrende Literaturangaben vor. Hicks (1959) listet in einer Zusammenstellung von Bibliographien zu Insekten als Vogelnidikole 15 Mitteilungen über Kleidermotten in Vogelnestern auf. In der Sekundär- und Tertiärliteratur wird sie daher als häufige Art in Vogelnestern angegeben (Niethammer, 1937; Uhlmann, 1937/1938; Hinton, 1956; Petersen, 1969; Hannemann, 1977; Klausnitzer, 1988; Pinniger, 2001; Cox und Pinniger, 2007). Eine Überprüfung der gelisteten originären Mitteilungen erlaubt diesen allgemeinen Rückschluss jedoch nicht. Zunächst fallen Doppelnennungen von Zitaten und verallgemeinerte faunistische Meldungen aus Sekundärliteratur ohne Nennung von Daten auf. Die Anzahl an Originalarbeiten, in denen die Kleidermotte gesichert in Vogelnestern gefunden wurde, reduziert sich auf sechs Mitteilungen. Des Weiteren sind die darin aufgeführten Abundanzen verschwindend gering. So enthielten nach Kemper (1938) zwar 63% der untersuchten 64 Nester von u.a. Haus- und Feldsperlingen, Kohl- und Blaumeisen, Rauch- und Mehlschwalben sowie „Stadttauben“ Mottenlarven oder Falter, aber nur ca. 10% davon enthielten T. bisselliella mit insgesamt 24 Individuen. Der größte Anteil (95%) beherbergten andere Mottenarten (sogenannte „sacktragende Motten“ – s.u.) mit über 2000 Individuen. Auch Büttiker (1944) berichtet nach einer mehrjährigen Studie an zahlreichen Mauerseglernestern lediglich von einem Falter und einer Puppe, und nach Boyd (1936) kommen zwar Kleider-, Pelz- und weitere Motten regelmäßig in Schwalbennestern vor, es wird jedoch zwischen den Arten nicht weiter differenziert, sodass der tatsächliche Anteil, der auf T. bisselliella zurückgeht, unklar bleibt. Woodroffe und Southgate (1951/1952) und Woodroffe (1953) stellten in nur 3% ihrer untersuchten Nester mehrerer verschiedener Vogelarten eine sehr geringe Anzahl von Kleidermottenlarven und zwar ausschließlich in Haussperlingsnestern fest. Herfs (1936) nennt ebenfalls keine absoluten Daten, berichtet aber von einer sehr geringen Anzahl an Kleidermotten verglichen mit der hohen Zahl an Pelzmotten (Tinea pellionella). Ergänzend zur Auflistung von Hicks (1959) fand Weidner (1961) eine Kleidermottenlarve in einem von sechs Taubennestern. Die Larven der Pelz- und der Samenmotte (Hofmanophila pseudospretella), aber auch der Taubenmotte (Tinea columbariella), alles „sacktragende“ Mottenlarven, waren deutlich häufiger vertreten.
In diesem Zusammenhang sind auch Negativmeldungen interessant. So fand Nordberg (1936) in insgesamt 422 Nestern von 56 verschiedenen Vogelarten keine Kleidermotte, wohl aber Pelz-, Samen- und Nestermotte in hoher Anzahl, und Hinton (1956) hat die Kleidermotte nie in Vogelnestern gefunden. Ebenso wird sie nicht in den faunistischen Erhebungen von Green (1980) und Krall (1981) aufgeführt.
Zusammenfassend muss T. bisselliella also als Ausnahme und selten bis sehr selten anzutreffende Art in Vogelnesterbiozönosen angesehen werden. Das äußerst schlechte Flugvermögen der Weibchen (Hinton, 1956), aber besonders die Konkurrenzstärke anderer Arten in den natürlichen Habitaten dürften dafür die Ursachen sein. Andere Tineiden, vor allem die Pelz- und die Taubenmotte, aber auch die Oecophoride Samenmotte und einige Anthrenus- und Attagenus-Speckkäferarten sind die häufigsten keratinophagen Vogelnidikolen in den gemäßigten Klimazonen (Hicks, 1959).
Laufende Untersuchungen zur Konkurrenzfähigkeit der Kleidermotte gegen andere keratinophage Organismen, weiterführende autökologische Betrachtungen und der Versuch auch weibliche Kleidermotten mittels des Ausbringens von künstlichen Nestern im Freiland nachzuweisen, sollen die Ergebnisse der Pheromonfallenfänge unterstützen. Genetische Untersuchungen an den gefangenen Motten der verschiedenen Standorte könnten populationsspezifische Merkmale erkennen lassen und Aufschlüsse über die eigenständige Mobilität der Art geben (Krueger-Carstensen und Plarre, 2011).
Das seltene Vorkommen der Kleidermotte als Nidikole in Vogelnestern ist wahrscheinlich auf Sekundärbefall aus Wohnungen oder Geschäften im urbanen Raum zurückzuführen, denn bei allen oben genannten Positivmeldungen fällt auf, dass die wenigen Nester, in denen Kleidermotten gefunden wurden, einen direkten Kontakt zu bewohnten Häusern hatten. Der umgekehrte Weg, vom Nest in die menschliche Behausung, ist eher unwahrscheinlich – ein wirtschaftlich relevanter Neubefall mit Kleidermotten erfolgt im Regelfall nicht aus natürlichen Habitaten, sondern durch Verschleppung und Erhalt befallener Materialien (Kemper, 1935). Geeignete Inspektionen von Waren und konsequente Quarantäne z.B. bei musealen Einrichtungen sind bei der Schadprävention gegen Kleidermotten daher von hoher Bedeutung.
Erfahrungen haben gezeigt, dass Pheromonfallen wertvolle ergänzende Informationen über Schädlinge und deren Populationsdynamiken sowie deren Verbreitungsgebiete liefen können. Ihr Einsatz ist nahezu mit allen Bekämpfungsstrategien kombinierbar. Sie werden auch in Zukunft eine entscheidende Rolle in modernen Konzepten der Schadprävention und der angewandten Wissenschaft haben.
Der gleichlautende Vortrag, der beim Vorratsschutzsymposium der Deutschen Pflanzenschutztagung in Berlin 2010 gehalten wurde, war Prof. Dr. Christoph Reichmuth gewidmet, dem langjährigen Leiter des Institutes für Vorratsschutz der Biologischen Bundesanstalt für Land- und Forstwirtschaft jetzt Institut für ökologische Chemie, Pflanzenanalytik und Vorratsschutz, Julius Kühn-Institut. Die Firma Insect Limited stellte kostenfrei die Pheromonköder für die Untersuchungen an der Kleidermotte zur Verfügung. Herr Dr. Wolfram Mey vom Museum für Naturkunde Berlin hatte freundlicherweise die Bestimmung von Niditinea fuscipunctella bestätigt.
Boyd, A.W., 1936: Report on the swallow enquiry, 1935. British Birds 30, 98-116.
Brady, U.E., R.C. Daley, 1972: Identification of a sex pheromone from female raisin moth, Cadra figulilella. Ann. Entomol. Soc. Am. 65, 1356-1358.
Brady, U.E., D.A. Nordlund, 1971: Cis-9, trans-12 Tetradecadien-1-yl acetat in the female tobacco moth Ephestia elutella (Hübner) and evidence for an additional component of the sex pheromone. Life Science 10, 797-801.
Büttiker, W., 1944: Die Parasiten und Nestgäste des Mauerseglers (Micropus apus L.). Der Ornithologische Beobachter 41, 25-35.
Burkholder, W.E., 1982: Reproductive biology and communication among grain storage and warehouse beetles. J. Ga. Entomol. Soc. 17, 1-10.
Chuman, T., K. Kato, M. Nogushi, 1979: Synthesis of ( ±) Serricornin, 4,6,-dimethyl-7-hydroxy-nonan-3-one, a sex pheromone of the cigarette beetle (Lasioderma serricorne F.). Agric. Biol. Chem. 43, 2005.
Cardé, R.T., A.K. Minks, 1997: Insect Pheromone Research New Directions. New York, Chapman and Hall.
Cox, P.D., D.B. Pinniger, 2007: Biology, behaviour and environmental sustainable control of Tineola bisselliella (Hummel) (Lepidoptera: Tineidae). Journal of Stored Products Research 43, 2-32.
Cross, H.J., R.C. Byler, R.S. Cassidy, R.M. Silverstein, R.E. Greenblatt, W.E. Burkholder, A.R. Levinson, H.Z. Levinson, 1976: Porapak-Q collection of pheromone components and isolation of (Z)- and (E)-14-methyl-8-hexadecenal, sex pheromone components, from the females of four species of Trogoderma (Coleoptera: Dermestidae). Journal of Chemical Ecology 2, 457-468.
Finnegan, D.E., J. Chambers, 1993: Identification of the sex pheromone of the guernsey carpet beetle, Anthrenus sarnicus Mroczkowski (Coleoptera: Dermestidae). Journal of Chemical Ecology 19, 971-983.
Francke, W., A.R. Levinson, T.I. Jen, H.Z. Levinson, 1979: Carbonsäure-isopropylester – eine neue Klasse von Insektenpheromonen. Angewandte Chemie 91, 843-844.
Fukui, H., F. Matsumura, M.C. Ma, W.E. Burkholder, 1974: Identification of the sex pheromone of the furniture carpet beetle, Anthrenus flavipes Leconte. Tetrahedron Letters 40, 3563-3566.
Fukui, H., F. Matsumura, A.V. Barak, W.E. Burkholder, 1977: Isolation and identification of a major sex attractant component of Attagenus elongatulus (Casey) (Coleoptera: Dermestidae). Journal of Chemical Ecology 3, 539-548.
Green, D.B., 1980: The fauna of a Lancashire deep-pit poultry house. The Entomologist´s Monthly Magazine 116, 13-15.
Hannemann, H.-J., 1977: Kleinschmetterlinge oder Microlepidoptera III. Federmotten (Pfterophoridae), Gespinnstmotten (Yponomeutidae), Echte Motten (Tineidae). Die Tierwelt Deutschlands 63, Jena, Gustav Fischer.
Hall, D.R., A. Cork, R. Lester, B.F. Nesbitt, P. Zagatti, 1987: Sex pheromones of the rice moth, Corcyra cephalonica Stainton. II. Identification and role of female pheromone. Journal of Chemical Ecology 13, 1575-1589.
Herfs, A., 1936: Ökologisch-physiologische Studien an Anthrenus fasciatus Herbst. Zoologica 34, (90).
Hicks, E.A., 1959: Check-List and Bibliography on the Occurrence of Insects in Birds´ Nests. Ames, Iowa State College Press.
Hinton, H.E., 1956: The larvae of the species of Tineidae of economic importance. Bulletin of Entomological Research 47, 251-346.
Hodges, R.J., A. Cork, D.R. Hall, 1984: Aggregation pheromones for monitoring the greater grain borer Prostephanus truncatus. Proceedings Britsh Crop Protection Conference – Pest and Diseases, 255-259.
Horler, D.F., 1970: (-)-Methyl-n-tetradeca-trans-2,4,5-trienoat, an allenic ester produced by the male dried bean beetle, Acanthoscelides obtectus (Say). J. Chem. Soc. C 6, 859-862.
Hwang, Y.-S., M.S. Mulla, H. Axelrod, 1978: Attractants for synanthropic flies: ethanol as attractant for Fannia canicularis and other pest flies in poultry ranches. Journal of Chemical Ecology 4, 463-470.
Kemper, H., 1935: Die Pelz- und Textilschädlinge und ihre Bekämpfung. Hygienische Zoologie, Monographien zur Biologie und Bekämpfung der Gesundheits- und Wohnungs-Schädlinge 7.
Kemper, H., 1938: Hausschädlinge als Bewohner von Vogelnestern. Zeitschrift für Hygieneische Zoologie und Schädlingsbekämpfung 30, 227-236, 269-274, 291-297.
Klausnitzer, B., 1988: Verstädterung von Tieren. Die Neue Brehm Bücherei 579.
Krall, S., 1981: Ökofaunistische Untersuchungen der Insekten in Nestern der Stadttaube (Columba livia domestica L.) unter besonderer Berücksichtigung schädlicher und lästiger Arten. Entomologische Mitteilungen Zoologisches Museum Hamburg 7, 29-44.
Krueger-Carstensen, B., R. Plarre, 2011: Outdoor trapping and genetic characterization of populations of the webbing clothes moth Tineola bisselliella Hummel (Lepidoptera: Tineidae) in the broader area of Berlin. Journal of Entomological and Acarological Research 43, 129-135.
Kuwahara, Y., S. Nakamura, 1985: (Z)-5- and (E)-5-undecenoic acid: Identification of the sex pheromone of the varied carpet beetle, Anthrenus verbasci L. (Coleoptera: Dermestidae). Appl. Entomol. Zool. 20, 354-356.
Kuwahara, Y., C. Kitamura, S. Takahashi, M. Hara, S. Ishii, M. Fukawi, 1971a: Sex pheromone of the almond moth and the Indian meal moth: Cis-9, trans-12-tetradecadienyl acetat. Science 171. 801-802.
Kuwahara, Y., H. Hara, S. Ishii, H. Fukami, 1971b: The sex pheromone of the Mediterranean flour moth. Agric. Biol. Chem. 35, 447-448.
Kuwahara, Y., H. Fukami, R. Howard, S. Ishii, F. Matsumura, W.E. Burkholder, 1978: Chemical studies on the Anobiidae: Sex pheromone of the drugstore beetle, Stegobium paniceum (L.) (Coleoptera): Tetrahedron 34, 1769-1774.
Niethammer, G., 1937: Handbuch der Deutschen Vogelkunde Band 1: Passeres. Leipzig, Akademische Verlagsgesellschaft.
Nordberg, S., 1936: Biologisch-ökologische Untersuchungen über die Vogelnidicolen. Acta Zoologica Fennica 21, 1-168.
Petersen, G., 1969: Beiträge zur Insekten-Fauna der DDR: Lepidoptera – Tineidae. Beiträge zur Entomologie 19, 311-388.
Pinniger, D.B., 2001: Pest Management in Museums Archives and Historic Houses. London, Archetype Press.
Phillips, J.K., P.F. Miller, J.F. Andersen, H.M. Fales, W.E. Burkholder, 1987: The chemical identification of the granary weevil aggregation pheromone. Tetrahedron Letters 49, 6145-6146.
Phillips, T.W., 1997: Semiochemicals of stored-product insects: Research and applications. Journal of Stored Products Research 33, 17-30.
Phillips, T.W., J.K. Phillips, F.X. Webster, R.T. Tang, W.E. Burkholder, 1996: Identification of sex pheromones from the cowpea weevil, Callosobruchus maculatus, and related studies with C. analis (Coleoptera: Bruchidae). Journal of Chemical Ecology 22, 2233-2249.
Pierce, A.M., H.D. Pierce, J.G. Millar, J.H. Boden, A.C. Oehlschlager, 1984: Aggregation pheromones in the genus Oryzaephilus (Coleoptera: Cucujidae). In: Proceedings of the 3rd International Working Conference on Stored Product Entomology, Manhattan (Kansas), USA, 1983, 107-120.
Pierce, A.M., H.D. Pierce, B.D. Johnston, A.C. Oehlschlager, J.H. Borden, 1988: Aggregation pheromone of square necked grain beetle, Cathartus quadricollis (Guer). Journal of Chemical Ecology 14, 2169-2184.
Pierce, A.M., H.D. Pierce, A.C. Oehlschlager, J.H. Borden, 1991: 1-octen-3-ol, attractive semiochemical for foreign grain beetle, Ahasverus advena (Waltl) (Coleoptera: Cucujidae). Journal of Chemical Ecology 17, 567-580.
Plarre, R., 1994: Influence of synthetic Sitophilate, the aggregation pheromone of Sitophilus granarius (L.) (Col:Curculionidae) on dispersion and aggregation behavior of the granary weevil. In: Highly, E., E.J. Wright, H.J. Banks, B.R. Champ (Eds.): Stored Product Protection. Proceedings of the 6th International Working Conference on Stored-product Protection, 17–23 April 1994 in Canberra, Australia, 1274 pp., Vol. 1, Wallingford, UK, CAB International, 570-582.
Plarre, R., 1998: Pheromones and other semiochemicals of stored product insects – A review, current application, and perspective needs. In: Reichmuth, C. (Ed.): 100 Jahre Pflanzenschutzforschung – Wichtige Arbeitsschwerpunkte im Vorratsschutz. Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft, Berlin, H. 342, 341 S., 13-83.
Plarre, R., B. Krueger-Carstensen, 2011: An attempt to reconstruct the natural and cultural history of the webbing clothes moth Tineola bisselliella Hummel (Lepidoptera: Tineidae). Journal of Entomological and Acarological Research 43, 83-93.
Plarre, R., D.C. Vanderwel, 1999: Stored-product Beetles. In: Hardie, R.J., A.K. Minks (Eds.): Pheromones of Non-Lepidopteran Insects Associated with Agricultural Plants. CAB International, 149-198.
Schmuff, N.R., J.K. Phillips, W.E. Burkholder, H.M. Fales, C.W. Chen, P.P. Roller, M. Ma, 1984: The chemical identification of the rice weevil and the maize weevil aggregation pheromone. Tetrahedron Letters 25, 1533-1534.
Schröder, F., R. Fettköther, U. Noldt, K. Dettner, W.A. König, W. Francke, 1994: Synthesis of (3R)-3-hydroxy-2-hexanone, (2R, 3S)-2,3-hexanediol and (2R, 3R)-2,3-hexanediol, the male sex pheromone of Hylotrupes bajulus and Pyrrhidium sanguineum (Cerambycidae). Liebigs Annalen der Chemie 12, 1211-1218.
Silverstein, R.M., J.O. Rodin, W.E. Burkholder, J.E. Gorman, 1967: Sex attractant of the black carpet beetle. Science 157, 85-87.
Suzuki, T., 1980: 4,8-Dimethyldecanal: The aggregation pheromone of the flour beetles, Tribolium castaneum und T. confusum (Coleoptera: Tenebrionidea). Agric. Biol. Chem. 44, 2519-2520.
Tanaka, K., K. Ohsawa, H. Honda, I. Yamomoto, 1981: Copulation release pheromone, erectin, from the azuki bean weevil (Callosobruchus chinensis L.). Journal of Pesticide Science 6, 75-82.
Trematerra, P., 1997: Integrated pest management of stored-product insects: practical utilization of pheromones. Anzeiger für Schädlingskunde, Pflanzenschutz und Umweltschutz 70, 41-44.
Trematerra, P., F. Fiorilli, 1999: Occurrence of Arthropods in a Central Italy feed-mill. Anzeiger für Schädlingskunde, Pflanzenschutz und Umweltschutz 72, 158-163.
Uhlmann, E., 1937/1938: Unsere Material- und Vorratsschädlinge in ihrer Beziehung zum Freilandleben. Mitteilungen der Gesellschaft für Vorratsschutz 13 und 14, 57-60 und 3-10.
Vick, K.W., H.C.F. Su, L.L. Sower, P.G. Mahany, P.C. Drumond, 1974: (Z,E)-7,11-Hexadecadien-1-ol acetate: The sex pheromone of the Angoumois grain moth, Sitotroga cerealella. Experientia 30, 17-18.
Walgenbach, C.A., W.E. Burkholder, 1986: Factors affecting the response of the maize-weevil, Sitophilus zeamais (Coleoptera: Curculionidae), to its aggregation pheromone. Environmental Entomology 15, 733-738.
Weidner, H., 1961: Die Niststätten verwilderter Tauben als Reservoire für Ungezieferplagen. Stadthygiene 12, 91-94.
Wertheim, B.E., J.A. van Baalen, M. Dicke, L.E.M. Vet, 2005: Pheromone-mediated aggregation in nonsocial arthropods: An Evolutionary Ecological Perspective. Annual Review of Entomology 50, 321-346.
White, P.R., M.C. Birch, 1987: Female sex pheromone of the common furniture beetle Anobium punctatum (Coleoptera: Anobiidae): extraction, identification, and bioassays. Journal of Chemical Ecology 13, 1695-1706.
Williams, H.J., R.M. Silverstein, W.E. Burkholder, A. Khorramshahi, 1981: Dominicalure 1 and 2: Components of aggregation pheromone from male lesser grain borer Rhyzopertha dominica (F.) (Coleoptera: Bostrichidae). Journal of Chemical Ecology 7, 759-780.
Wohlgemuth, R., C. Reichmuth, H. Rothert, E. Bode, 1987: Auftreten vorratsschädlicher Motten der Gattungen Ephestia und Plodia außerhalb von Lägern lebensmittelverarbeitenden Betrieben in Deutschland. Anzeiger für Schädlingskunde, Pflanzenschutz und Umweltschutz 60, 44-51.
Wong, J.W., V. Vergin, A.C. Oehlschlager, J.H. Borden, H.D.Jr. Pierce, A.M. Pierce, L. Chong, 1983: Isolation and identification of two macrolide pheromones from the frass of Cryptolestes ferrugineus (Coleoptera: Cucujidae). Journal of Chemical Ecology 9, 451-474.
Woodroffe, G.E., 1953: An ecological study of the insects and mites in the nets of certain birds in Britain. Bulletin of Entomological Research 44, 739-772.
Woodroffe, G.E., B.J. Southgate, 1951/1952: Birds´ nests as a source of domestic pests. Proceedings of the Zoological Sciety of London 121, 55-62.
Yamaoka, R., Y. Shiraishi, T. Uneo, Y. Kuwahara, H. Fukami, 1985: Structure elucidation of Koiganal I and II, the sex pheromones of the webbing clothes moth, using capillary GC/MS. Mass Spectroscopy 33, 189-195.