

Nachweis einer ALS-resistenten Lolium perenne-Population in Norddeutschland
Confirmation of an ALS-resistant Lolium perenne population in Northern Germany
Journal für Kulturpflanzen, 68 (5). S. 117–124, 2016, ISSN 1867-0911, DOI: 10.5073/JfK.2016.05.01, Verlag Eugen Ulmer KG, Stuttgart
Auf einem Ackerschlag im Östlichen Hügelland Schleswig-Holsteins wurde in der Vergangenheit eine Fruchtfolge aus Wintergerste, Winterraps und Winterweizen in einer wiederkehrenden dreijährigen Fruchtfolge angebaut. Im Herbst und Frühjahr 2014/15 wurden in eigenen Untersuchungen erstmals deutliche Bekämpfungsprobleme von Deutschem Weidelgras (Lolium perenne) auf dieser Ackerfläche dokumentiert. Aufgrund dieser Beobachtungen und dem Einsatz gleicher Wirkstoffe in den vergangenen Jahren wurde die Verdachtspopulation auf eine etwaige Resistenz getestet. Nach einer Pflanzenprobenahme im Frühjahr 2015 und sich anschließenden Wirkungsversuchen unter Gewächshausbedingungen mit verschiedenen Dosierungen von Wirkstoffen aus der Gruppe der ACCase- und ALS-Inhibitoren sowie einer molekularen Resistenzanalyse steht fest, dass in Schleswig-Holstein eine bis jetzt noch nicht näher betrachtete ALS-resistente Spezies bestätigt werden konnte. Es zeigte sich bei der Verdachtspopulation neben einer ausgeprägten Resistenz gegenüber ALS-Inhibitoren eine vermutlich zusätzliche metabolische Resistenz in Form von ersten Wirkungsverlusten gegenüber Aryloxyphenoxy-propionaten und Clethodim.
Stichwörter: Lolium perenne, Resistenz, TSR, NTSR, Perennial Ryegrass, ACCase, ALS, Clethodim, Clodinafop, Cycloxydim, Iodosulfuron, Mesosulfuron, Pinoxaden, Propoxycarbazone, Pyroxsulam/Florasulam, Isoproturon
In the east of Schleswig-Holstein, in the recent years on a farmland were grown winter barley, winter oilseed rape and winter wheat in a three-year crop rotation. In autumn and spring 2014/15, severe problems to control perennial ryegrass (Lolium perenne) were recognized for the first time in field-trials. Based on these observations and the use of the same herbicides in recent years, the suspect population was tested for a possible herbicide resistance. After a plant sampling in the spring of 2015 and subsequent greenhouse bioassays with different doses of ACCase and ALS inhibitors, followed by a molecular resistance testing, a hitherto unknown ALS-resistant weed species was confirmed in Schleswig-Holstein. In addition to a marked resistance to ALS inhibitors, a potential metabolic resistance in the form of first effect losses against aryloxyphenoxy-propionates and clethodim was observed in the suspect population.
Key words: Lolium perenne, resistance, TSR, NTSR, perennial ryegrass, ACCase, ALS, clethodim, clodinafop, cycloxydim, iodosulfuron, mesosulfuron, pinoxaden, propoxycarbazone, pyroxsulam/florasulam, isoproturon
In der Praxis wird die Wirksamkeit von Herbiziden häufig durch ungünstige produktionstechnische Bedingungen als auch von weiteren abiotischen und biotischen Faktoren beeinträchtigt. Langanhaltende Niederschlagsperioden in den Herbst- und Frühjahrsmonaten lassen dabei häufig nur schwer eine optimale Terminierung der Applikationen zu. Eine unzureichende Saatbettbereitung als auch zu feuchte Bodenbedingungen können die Wirkung von Bodenherbiziden zusätzlich herabsetzen (Fortmeier et al., 2006; Kassam und Friedrich, 2010). Ebenso sind Sensitivitätsminderungen gegenüber häufig eingesetzten Wirkstoffen bzw. Wirkstoffgruppen denkbar (Zwerger und Ammon, 2012). Neben den bereits in Norddeutschland nachgewiesenen Resistenzen bei Acker-Fuchsschwanz (Alopecurus myosuroides Huds.) und Windhalm (Apera spica-venti L.) gegenüber ACCase- und ALS-Inhibitoren (Rosenhauer et al., 2014) sowie Matricaria spp. gegenüber ALS-Inhibitoren (Drobny et al., 2008, Ulber et al., 2012) treten seit einiger Zeit weitere Problemunkräuter/-ungräser, wie zum Beispiel Hühnerhirse (Echinochloa crus-galli L.), Klatschmohn (Papaver rhoeas L.), Windenknöterich (Polygonum convolvulus L.) und Rübsen (Brassica rapa) auf. Besonders stehen hier Ackerschläge in den schleswig-holsteinischen Naturregionen entlang der Westküste und dem Östlichen Hügelland im Fokus. Großflächige Ackerschläge, enge Getreidefruchtfolgen und oftmals wiederholter Einsatz gleicher Wirkstoffklassen steigern den Selektionsdruck bei potentiell resistenzgefährdeten Schadpflanzen. Im Herbst 2014 wurde auf einem Ackerschlag im Östlichen Hügelland, auf dem seit etwa zehn Jahren eine dreijährige Raps-Getreide-Fruchtfolge vorherrscht, erneut Winterweizen angebaut. Der Winterweizen wurde in BBCH 10–11 gegen eine breite Mischverunkrautung mit 0,35 l/ha Herold® SC (Flufenacet 400 g/l, Diflufenican 200 g/l; Adama) behandelt. Nach einer zusätzlichen Applikation im Frühjahr mit 500 g/ha Atlantis® WG (6 g/kg Iodosulfuron-Methyl-Na, 30 g/kg Mesosulfuron-Methyl; Bayer CropScience) sowie 1,2 l/ha Axial® 50 (50 g/l Pinoxaden; Syngenta) konnte eine nur sehr geringe Wirkung bei Deutschem Weidelgras (Lolium perenne) festgestellt werden. Zur Samenreife des Ungrases wurden 400 bis 700 Ähren/m² auf der Fläche erfasst. Aus dieser Population wurden Samen- und Blattproben entnommen. Auf Basis des entnommenen Saatgutes wurde in Gewächshausstudien die Wirksamkeit von ALS-, ACCase- und PSII-Inhibitoren getestet. Pflanzen, welche die Herbizidbehandlung überlebten, wurden weiterhin auf die bekannten Mutationen am ALS- und ACCase-Gen untersucht.
Die Wirksamkeitsstudien wurden in Gewächshäusern der Universität Kiel durchgeführt. Aussaat und Anzucht der Pflanzen erfolgte bei einem Tag/Nacht-Rhythmus von 12 h sowie bei einer Tagestemperatur von 20°C und einer Nachttemperatur von 18°C. Die Luftfeuchtigkeit wurde konstant bei 65–75% gehalten. Die Pflanzen wurden auf einem häufig in Schleswig-Holstein anzutreffenden Ackerboden (Parabraunerde) mit Ackerzahlen zwischen 45 und 60 kultiviert (LLUR – Landesamt für Landwirtschaft, Umwelt und ländliche Räume des Landes Schleswig-Holstein, 2012). Die Bodenart ist als sandiger bis toniger Lehm (sL/tL) zu klassifizieren. Der Anteil der organischen Masse (Corg) lag bei 3,1%. Der Boden wurde homogenisiert und vor Versuchsbeginn gedämpft. Für die Wirksamkeitsstudien wurden 25 Samen je Topf („Göttinger Pflanztöpfe“, Größe 9 × 9 × 9,5 cm, Inhalt 0,5 l) in dreifacher Wiederholung ausgesät. Als sensitive Referenz diente eine L. perenne-Population des Unternehmens Herbiseed (West End, Twyford, UK, Cat. No. 31615). Die verwendeten Herbizide wurden in drei verschiedenen Aufwandmengen appliziert (Tab. 1). Getestet wurden Wirkstoffe aus der Gruppe der ACCase-Inhibitoren (HRAC-Gruppe A), der ALS-Inhibitoren (HRAC-Gruppe B) sowie der Photosystem II-Inhibitoren (HRAC-Gruppe C). Die mittlere Herbizidkonzentration entsprach dabei der maximal zugelassenen Aufwandmenge der Herbizide in Winterweizen oder Winterraps in Deutschland. Alle Pflanzen wurden zu BBCH 12–13 mit einer Labor-Applikationseinrichtung (SprayLab, Fa. Schachtner) mit einer Wasseraufwandmenge von 200 l/ha, einem Druck von 2,13 Bar und einer Geschwindigkeit von 4 km h–1 behandelt (Düse: TeeJet TP8002EVSvEven Flat Spray Tip, Stainless Steel, yellow). 21 Tage nach Herbizidapplikation wurde die Restbiomasse oberirdisch geerntet und bei 80°C für 72 Stunden in einem Trockenschrank (Memmert, Typ: ULP 600) getrocknet. Zuvor wurden von vier Pflanzen jeder Herbizidvariante und Aufwandmenge, die die Herbizidbehandlung überstanden, ein jeweils ein 5 cm langes Blattfragment für weiterführende genetische Untersuchungen entnommen. Die Extraktion der DNA sowie die weiterführende Aufarbeitung und Analyse des ALS- und ACCase-Gens wurde anhand der Protokolle von Tan et al. (2007), Yu et al. (2007) und Han et al. (2015) durchgeführt.
Tab. 1. Herbizidvarianten mit Aufwandmengen und Wirkstoffgehalten sowie den erzielten Wirkungsgraden 21 Tage nach Applikation von maximaler und doppelt maximaler zugelassener Aufwandmenge bei den beiden Lolium perenne-Biotypen (sensitiver Standard und Verdachtspopulation)
Resistenztest 2015 – Deutsches Weidelgras (21 Tage nach Applikation) | ||||||||||
Nr. | Herbizidvariante | Applikation max. zugel. AWM | Applikation doppelt max. zugel. AWM | Wirkstoff | Wirkstoffgruppe | Wirkungsgrad bei Applikation (%) | Wirkungsgrad bei Applikation (%) doppelt max. zugel. AWM | |||
AWM | AWM | sensitiver Biotyp | resistenter Biotyp | sensitiver Biotyp | resistenter Biotyp | |||||
1. | Unbehandelte Kontrolle | 0 | 0 | 0 | 0 | |||||
2. | Select 240 EC® + Para Sommer | 120,95 | 241,9 | Clethodim | A | 99 | 50 | 100 | 80 | |
3. | Focus® Ultra + Dash® E.C. | 250,0 | 500,0 | Cycloxydim | A | 100 | 98 | 100 | 100 | |
4. | Agil® S | 100,0 | 200,0 | Propaquizafop | A | 100 | 0 | 100 | 0 | |
5. | Pointer® SX® | 30,0 | 60,0 | Tribenuron | B | 60 | 0 | 70 | 0 | |
6. | BroadwayTM + BroadwayTM Netzmittel | 15,03/5,02 | 30,06/10,04 | Pyroxsulam/ | B | 70 | 0 | 80 | 0 | |
7. | Atlantis® WG + Mero | 15,0/3,0 | 30,0/6,0 | Mesosulfuron/ | B | 98 | 0 | 99 | 5 | |
8. | Husar® OD + Mero | 100,0 | 200,0 | Iodosulfuron | B | 95 | 0 | 97 | 0 | |
9. | Axial®50 | 60,0 | 120,0 | Pinoxaden | A | 99 | 0 | 100 | 0 | |
10. | Traxos® | 30,0/30,0 | 60,0/60,0 | Clodinafop/ | A | 100 | 0 | 100 | 0 | |
11. | Attribut® | 70,0 | 140,0 | Propoxycarbazone | B | 98 | 0 | 99 | 0 | |
12. | Arelon® | 1000,0 | 1500,0 | Isoproturon | C | 100 | 70 | 100 | 90 | |
AWM = Aufwandmenge. HRAC = Herbicide Resistance Action Committee. | ||||||||||
Die statistische Auswertung der Trockenmasseerträge erfolgte mit der Statistik-Software R (R Development Core Team). Es wurde ein einseitiger multipler Kontrasttest nach Hasler und Hothorn (2008) durchgeführt, in dem alle Varianten gegen den Mittelwert aller Varianten auf die Wirksamkeit der verschiedenen Herbizide sowie Aufwandmengen getestet wurden und somit einer mehrfaktoriellen ANOVA in Bezug auf Aufwandmenge/Dosierung und Herbizidwahl vorgezogen.
Es zeigten sich 21 Tage nach der Applikation stark differenzierte Wirkungsgrade zwischen den jeweiligen Wirkstoffen und getesteten Aufwandmengen. Dabei konnten ebenso deutliche Unterschiede zwischen den beiden Biotypen (sensitiver Standard/Verdachtspopulation) diagnostiziert werden (Abb. 1).

Abb. 1. Herbizidwirkung 21 Tage nach Applikation der doppelt maximal zugelassenen Aufwandmenge in Winterweizen oder Winterraps in Deutschland im Biotest auf die zwei Biotypen des Deutsches Weidelgrases (oben = sensitiver Standard, unten = resistente Verdachtspopulation). 1 = unbehandelte Kontrolle, 2 = Select 240 EC®, 3 = Focus® Ultra, 4 = Agil® S, 5 = Pointer® SX®, 6 = BroadwayTM, 7 = Atlantis® WG, 8 = Husar® OD, 9 = Axial® 50, 10 = Traxos®, 11 = Attribut®, 12 = Arelon®.
Auffallend waren die geringen bis ausbleibenden Wirkungsgrade bei allen applizierten ALS-Inhibitoren bei der maximalen und doppelt maximal zugelassenen Aufwandmenge (Tab. 1). Die, zur Ungrasbekämpfung eingesetzten
Wirkstoffe Iodo-/Mesosulfuron, Iodosulfuron solo, Propoxycarbazone und Pyroxsulam in Kombination mit Florasulam, zeigten bei der maximal zugelassenen Aufwandmenge keinerlei Wirkung. Beim Vergleich der Versuchsreihe der applizierten doppelt maximal zugelassenen Aufwandmengen konnten nur die Wirkstoffe Iodo-/Mesosulfuron (Atlantis® WG, 1000,0 g a.i./ha; Bayer CropScience) Wuchsdepressionen mit einem Wirkungsgrad von 5% erreichen und statistisch gegenüber dem mittleren Durchschnitt aller Varianten je Aufwandmenge abgesichert werden (Tab. 2, Abb. 2).
Tab. 2. Trockenmasseerträge der Verdachtspopulation 21 Tage nach Applikation von halb maximaler, maximaler und doppelt maximaler zugelassener Aufwandmenge der einzelnen Herbizidvarianten
Herbizidvariante | MW TM-Erträge (g) | P-Value | MW TM-Erträge (g) | P-Value | MW TM-Erträge (g) | P-Value |
1/2 max. zugel. AWM | max. zugel. AWM | doppelt max. zugel. AWM | ||||
1 | 1,32 | 1,0000 | 1,38 | 1,0000 | 1,42 | 1,0000 |
2 | 0,35 | 0,0033 | 0,28 | 0,0035 | 0,16 | 0,0006 |
3 | 0,21 | 0,0000 | 0,20 | 0,0001 | 0,10 | 0,0000 |
4 | 1,01 | 1,0000 | 0,93 | 1,0000 | 0,90 | 1,0000 |
5 | 1,39 | 1,0000 | 1,16 | 1,0000 | 0,86 | 1,0000 |
6 | 1,37 | 1,0000 | 0,95 | 1,0000 | 0,86 | 1,0000 |
7 | 1,21 | 1,0000 | 0,68 | 0,0776 | 0,47 | 0,0151 |
8 | 1,02 | 1,0000 | 0,84 | 1,0000 | 0,71 | 1,0000 |
9 | 1,36 | 1,0000 | 1,07 | 1,0000 | 0,69 | 1,0000 |
10 | 1,39 | 1,0000 | 1,10 | 1,0000 | 0,68 | 1,0000 |
11 | 1,10 | 1,0000 | 0,92 | 1,0000 | 0,52 | 0,0259 |
12 | 0,37 | 0,0017 | 0,17 | 0,0000 | 0,12 | 0,0000 |
MW = Mittelwert. TM = Trockenmasse. AWM = Aufwandmenge. | ||||||
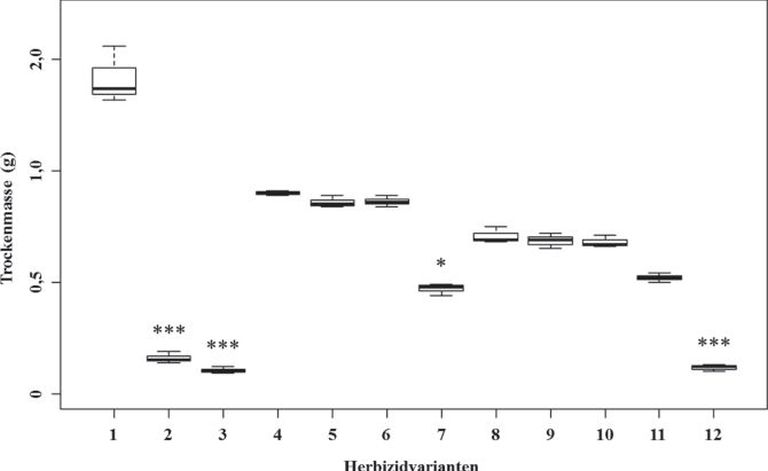
Abb. 2. Darstellung der Trockenmasseerträge nach den jeweiligen Herbizidapplikationen auf die Verdachtspopulationen des Deutschen Weidelgrases. Trockenmasseerträge (g) 21 Tage nach Applikation der doppelt maximalen zugelassenen Aufwandmenge in Winterweizen oder Winterraps mit entsprechend zugelassenen Aktivsubstanz (g a.i.) in Deutschland. 1 = unbehandelte Kontrolle, 2 = Select 240 EC® (241,9), 3 = Focus® Ultra (500,0), 4 = Agil® S (200,0), 5 = Pointer® SX® (60,0), 6 = BroadwayTM (30,06/10,04), 7 = Atlantis® WG (30,0/6,0), 8 = Husar® OD (200,0), 9 = Axial® 50 (120,0), 10 = Traxos® (60,0/60,0), 11 = Attribut® (140,0), 12 = Arelon® (1500,0). Multipler Kontrasttest bei Varianzheterongenität; Signifikanzniveau: P*≤0,05; P**≤0,01; P***≤0,001.
Bei der Betrachtung des sensitiven Standards konnten alle applizierten Herbizide, mit Ausnahme der Varianten fünf (Tribenuron-Methyl) und sechs (Pyroxsulam/Florasulam), einen Wirkungsgrad von ≥ 95% erreichen (Tab. 1). An dieser Stelle muss darauf verwiesen werden, dass bei der Variante fünf keine Wirkung auf Monokotyle erwartet werden durfte und diese somit auch nicht im direkten Vergleich zu allen anderen ALS-Inhibitoren steht. Die im Anschluss an die Wirksamkeitsprüfungen durchgeführte Analyse des ALS-Gens der Verdachtspopulation zeigte einen Aminosäureaustausch von Tryptophan zu Leucin an Position 574 (Nummerierung standardisiert auf Basis von Arabidopsis thaliana) zu 100%. Keine Mutationen konnten hingegen an den getesteten Positionen Pro-197 und Asp-376 diagnostiziert werden. Bei den Wirkungsbonituren der Versuchsreihen mit der halben maximal zugelassenen Aufwandmenge zeigten jedoch die Wirkstoffe Clethodim (60,48 g a.i./ha), Cycloxydim (125,0 g a.i./ha) und Isoproturon (500,0 g a.i./ha) bereits Unterschiede (Tab. 2). Die Wirkung, auch auf die Verdachtspopulation, konnte zudem durch die verringerten Trockenmasseerträge in allen Dosierungen dokumentiert werden (Tab. 1, 2). Die Ergebnisse der Trockenmasseerträge konnten zudem bei der doppelt maximal zugelassenen Aufwandmenge im Vergleich zum Variantenmittel als höchst signifikant abgesichert werden (α ≤ 0,001) (Tab. 2, Abb. 2), wobei der Wirkstoff Cycloxydim über alle Dosierungen die geringsten Trockenmasseerträge lieferte. Bei der Analyse des ACCase-Gens an den Positionen Ile-1781, Trp-2027, Ile-2041, Asp-2078 und Gly-2096 konnten keine Mutationen festgestellt werden. Die Minderwirkung von Propaquizafop, Pinoxaden und Clodinafop-propargyl/Pinoxaden kann folglich mit hoher Wahrscheinlichkeit auf eine metabolische Resistenz zurückgeführt werden. Folglich stellt die Kombination beider Resistenzmechanismen (ALS TSR/ACCase NTSR – wirkstoffbasiert) bei dieser Weidelgras-Population die Besonderheit dar.
Bei der Ungrasbekämpfung in Getreidefruchtfolgen kommt weltweit den Weidelgras-Arten die größte Bedeutung zu (Salas et al., 2013). Über nahezu alle Kontinente können Resistenzfunde bei Lolium spp. gegenüber verschiedenen Wirkstoffklassen nachverfolgt werden. Erste resistente Populationen gegenüber EPSPS-Inhibitoren (Glyphosat) (HRAC-Gruppe: G) sind in Argentinien (2008), Neuseeland (2012); auch in Portugal (2013) bekannt (Heap, 2015). Hier waren vorwiegend die Kulturen Sommergerste, Weizen, Sojabohnen und Kernobstflächen betroffen. Die erste Resistenz gegenüber ACCase-Inhibitoren bei Weidelgräsern wurde 1982 in Winterweizen in Australien entdeckt (Heap und Knight, 1982).
Eine Resistenz gegenüber ACCase-Inhibitoren (Clodinafop-Propargyl und Diclofop-Methyl) konnte bereits 2001 in Chile nachgewiesen werden (Heap, 2015). In den USA sind seit 1989 erste resistente Populationen von Lolium spp. gegenüber ALS-Inhibitoren, Sulfometuron-Methyl (HRAC-Gruppe: B) bekannt, die allerdings an Straßenrändern und Eisenbahnlinien gefunden wurden (Heap, 2015). In Deutschland wurde eine erste multi-resistente Population Deutschen Weidelgrases im Jahr 2008 entdeckt, die gegenüber den Wirkstoffen Iodosulfuron-Methyl-Natrium (HRAC-Gruppe: B), Pinoxaden (HRAC-Gruppe: A) und Pyroxsulam (HRAC-Gruppe: B) eine Resistenz aufwies (Heap, 2015). Aus Hinweisen in der Literatur auf bereits vorherrschende Resistenzen sowie häufig in der Praxis angewandte Herbizide wurde das Versuchsdesign zusammengestellt (Heap, 2015). Im Anschluss an den Biotest wurde eine molekulargenetische Untersuchung zur Absicherung der erhobenen Wirkungsverluste durchgeführt. Da Chandi et al. (2011) von häufig auftretenden Kreuzresistenzen (u.a. auch bei den applizierten Wirkstoffen Pyroxsulam und Mesosulfuron) ausgehen, wurden häufig verwendete Vertreter verschiedener chemischer Stoffklassen (Sulfonylharnstoffe, Triazolpyrimidine, Sulfonyl-amino-carbonyl-triazolinone) in das Versuchsdesign aufgenommen. Daher wurde auch der Wirkstoff Iodosulfuron in zwei Varianten, in Kombination mit und ohne Mesosulfuron, getestet. Literaturangaben belegen, dass Aufwandmengen von 100 bis 200 g/ha von Atlantis® WG (6 g/kg Iodosulfuron-Methyl-Na, 30 g/kg Mesosulfuron-Methyl; Bayer CropScience) ausreichen, um verschiedene Populationen von Weidelgras-Arten zu bekämpfen (Abdullah et al., 2013). Zusätzlich wurde eine Applikationsvariante mit dem Wirkstoff Tribenuron-Methyl (Pointer® SX®) implementiert, obgleich dieses Präparat keine ausgewiesene Ungraswirkung aufweist, die Praxis zumindest aber von einer Teilwirkung ausgeht. Des Weiteren wurden im Biotest ACCase-Inhibitoren mit Wirkstoffen der Cyclohexandione (DIMs), Aryloxyphenoxypropionate (FOPs) und Phenylpyrazoline (DENs) untersucht. Sie spielen häufig in der Landwirtschaft eine wichtige Rolle bei Ungräser-Nachauflaufbehandlungen (Michitte et al., 2003). Unter norddeutschen Praxisbedingungen werden besonders die Wirkstoffe Cycloxydim, Clethodim, Propaquizafop und Isoproturon angewendet und daher ebenfalls in den Biotest implementiert. Isoproturonhaltige Präparate dürfen, um eine Vorwinterentwicklung von Ungräsern zu reduzieren, jedoch nur auf nicht dränierten Flächen appliziert werden. Im Versuchsdesign soll die Applikation von Isoproturon als Harnstoffderivat lediglich als Bodenkomponente verstanden werden. Etwaige Rückschlüsse der analysierten Positionen in den Genen dürfen somit nicht in Verbindung auf eine Resistenz bei PSII-Inhibitoren gebracht werden. Für die Beurteilung einer vorliegenden Wirkort-Resistenz gegenüber ACCase-Inhibitoren, sind für Ungräser einzelne Gen-Positionen bekannt, die diese auch eindeutig bestätigen (Délye, 2005; Powles und Yu, 2010; Kaundun, 2014). Studien zur Genetik haben gezeigt, dass sich die Wirkort-Resistenz in der Regel unabhängig voneinander entwickelt und vor allem schnell an spezifischen Mutationen (Target-site-Mutationen) an den ACCase-Codonpositionen 1781, 1999, 2027, 2041, 2078, 2088 und 2096 zu erkennen ist (Kaundun, 2014). Die Analyse der Blattproben ergab jedoch keine Mutation der entsprechenden Positionen. Folglich kann auch geschlussfolgert werden, dass bei der fehlenden Wirksamkeit der applizierten ACCase-Inhibitoren von einer Nicht-Wirkort-Resistenz (NTSR – Non-Target-Site Resistance) ausgegangen werden kann, wobei die metabolische Resistenz als, die in Deutschland, am häufigsten auftretende NTSR-Wirkmechanismus anzusehen ist. Während Cycloxydim, als in Ungräsern metabolisch stabiler Wirkstoff, weiterhin eine sehr gute Wirkung gegenüber der resistenten Population zeigte, wurde bei Clethodim bereits ein deutlicher Wirkungsabfall beobachtet. Um eine ALS-Wirkort-Resistenz diagnostizieren zu können, müssten Positionen im ALS-Gen verändert sein. Dazu gehören vor allem die aussagekräftigen Codonpositionen Alanin 122 (Ala-122), Prolin 197 (Pro-197), Alanin 205 (Ala-205), Asparaginsäure 376 (Asp-376), Arginin 377 (Arg-377), Tryptophan 574 (Trp-574), Serin 653 (Ser-653) und Glycin 654 (Gly-654) (Tranel und Wright, 2002; Yu und Powles, 2014). Eine Analyse der Position Trp-574 erwies sich als zutreffend und bestätigte den Verdacht einer ALS-TSR. Abschließend kann davon ausgegangen werden, dass die untersuchte Population von L. perenne neben einer ausgeprägten ALS-TSR aller untersuchten Pflanzen an der Position Trp-574 (100%) zusätzlich wahrscheinlich eine metabolische Kreuzresistenz zu Wirkstoffen aus den Stoffklassen der Arylphenoxypropionate und Phenylpyrazolinone aufweist. Zunehmend scheinen sich also auch in Norddeutschland weitere bereits weltweit potentiell resistenzgefährdete Arten den agronomischen Bedingungen anzupassen. Bereits Baker (1974) und Vigueira et al. (2013) gingen davon aus, dass sich insbesondere nicht überall vorkommende Unkräuter erfolgreich anpassen könnten und durch ihre Kurzlebigkeit häufig übersehen werden. Grundsätzlich können resistente Unkräuter nur effektiv kontrolliert werden, wenn sie frühzeitig erkannt werden (Lebaron, 1984). Ein etwaiger Sensitivitätsverlust infolge einer Resistenzbildung sollte somit auch in Deutschland stets in Erwägung gezogen werden. Insgesamt kann eine sorgsam geführte Ackerschlagkartei im Nachhinein oftmals helfen, wenn es um die Klärung geht, ob in einzelnen Jahren wiederkehrend Schadspezies auftraten und Herbizidbehandlungen durch nicht geklärte Umstände überlebt haben. Ferner müsste bei einer nachgewiesenen Herbizidresistenz bei Lolium-Arten bedacht werden, dass bei einem großen Teil dieser Gattung ein Gentransfer und damit eine etwaige Resistenzauskreuzung möglich ist. Eine Unterteilung der Lolium-Arten in zwei Gruppen kann bei der Einordnung helfen. Eine Gruppe (L. perenne, L. multiflorum, L. rigidum GAUD. und L. canariense STEUD.GAUD.) ist selbstinkompatibel (selbststeril) und besitzt damit Fremdbefruchtereigenschaften (Hayman, 1992). Zu der zweiten Gruppe zählen die selbstkompatiblen und somit selbstbefruchtenden Arten, wie L. temulentum, L. remotum SCHRANK, L. persicum BOISS. & HOH.BOTH und Lolium subulatum VIS. (Kubik et al., 1999; Bennett, 1997; Jauhar, 1993). Die erste und zweite Gruppe der Lolium-Arten unterscheiden sich dahingehend, dass in der ersten Gruppe (interfertil) grundsätzlich ein möglicher Genaustausch stattfinden kann und bei den Arten ein hoher Verwandtschaftsgrad durch natürliche Hybridisierung nachweisbar ist (Bennett, 1997). In der zweiten Gruppe hingegen ist ein solcher Austausch nicht möglich. Bei einem etwaigen Anbau von Grasuntersaaten in Maisbeständen müsste diese Thematik gesondert begutachtet werden, da sich die Resistenz bei ungenauer Sortenwahl auskreuzen könnte. Zusätzlich muss noch summiert werden, wie sich betroffene Betriebe aus Gesichtspunkten des Resistenzmanagements verhalten könnten. Um Ackerschläge mit vorhandenen resistenten Populationen weiter nutzen zu können, erfordert es ein Umdenken aus Sicht einer rein monetären und produktbasierten Nahrungsmittelproduktion mit entsprechenden Konsequenzen. Dabei sollte die Anwendung von vorbeugenden Maßnahmen im Ackerbau wie Fruchtfolgegestaltung, Bodenbearbeitungssysteme, Saat- und Pflanzzeiten sowie die Sortenwahl zwingend berücksichtigt werden (Peters et al., 2015). Ebenso gewährleisten homogene Pflanzenbestände (ausreichenden Pflanzendichte mit optimierter räumlicher Verteilung), angepasste oder optimierte Saattermine sowie eine angepasste Düngung mit entsprechender Ausbringtechnik bzw. Platzierung einen positiven Einfluss auf die Unkrautunterdrückung (Blackshaw et al., 2007). Fruchtfolgen leisten dabei einen erheblichen Beitrag als vorbeugende Maßnahme zur Unkrautregulierung und zur Erhaltung der Biodiversität in Agrarsystemen (Liebman und Dyck, 1993; Altieri, 1999). Weiter gilt es vor allem die Unkraut- und Ungrasprobleme (Pallutt, 2000; Bartels, 2002) bei pflugloser Bodenbearbeitung in Verbindung mit einseitiger Fruchtfolge zu minimieren. Eine etwaige Anwendung nicht chemischer Bekämpfungsmaßnahmen, wie die mechanische Unkrautregulierung, könnte ebenso in Betracht gezogen werden, um nachhaltig resistente Populationen zu bekämpfen ohne einen Selektivitätsdruck durch bestimmte Wirkstoffklassen auszuüben (Peters et al., 2015). Auf Grund von teilweise ungenügenden Wirkungsgraden, des hohen Arbeitsaufwandes, etwaiger zusätzlicher Anschaffungskosten sowie der Kosten für zusätzlichen Treibstoff müsste dies hier jedoch als eher als kritisch angesehen werden (Böhm, 2014; Peters et al., 2015).
Abschließend soll hier die geplante Vorgangsweise des betroffenen Ackerbaubetriebes beschrieben werden. In der Vergangenheit wurden häufig Wirkstoffe einer Wirkstoffklasse in aufeinanderfolgenden Jahren angewandt, wie aus der Ackerschlaghistorie der vergangenen fünf Jahre zu entnehmen ist (Tab. 3). Ein Umdenken erscheint hier zwingend notwendig, um die betroffene Ackerfläche und angrenzenden Strukturen vor einer Ausbreitung der resistenten Population zu schützen. Direkt nach der Winterweizenernte wurde mit ersten ackerbaulichen Maßnahmen reagiert. Die nach der Ernte verbliebenen Weidelgraspflanzen wurden durch eine Behandlung mit einem glyphosathaltigen Herbizid (1200 g a.i./ha) abgetötet. Zusätzlich wurden zwei flache Bodenbearbeitungsgänge in einem Abstand von drei Wochen ab Glyphosatbehandlung durchgeführt, die erstens weitere Schadpflanzen zum Auflauf bringen und gleichzeitig andere bereits keimende oder aufgelaufene Ungräser eliminieren sollten. Die Fruchtfolge soll auf der betroffenen Ackerfläche in Zukunft von drei auf sechs Fruchtfolgeglieder, kombiniert aus Sommer- und Winterkulturen (Winterraps, Silomais, Ackerbohne, Winterweizen, Sommerweizen, Zuckerrübe), erweitert werden. Insgesamt soll in dieser Weise die Wirkung, der noch nicht durch eine Resistenz betroffenen Wirkstoffe, möglichst lange erhalten werden und eine weitere Ausbreitung der resistenten Population verhindert werden.
Tab. 3. Schlagspezifische Herbizidhistorie mit der Ackerkultur, den applizierten Herbizidpräparaten sowie den jeweiligen Aufwandmengen und Wirkstoffen der letzten fünf Wirtschaftsjahre
Wirtschaftsjahr | Kultur | Herbizid Herbst | Wirkstoff | Wirkstoffgruppe | AWM | Herbizid Frühjahr | Wirkstoff | Wirkstoffgruppe | AWM |
(nach HRAC) | (nach HRAC) | ||||||||
2014/15 | WW | Herold® SC | Flufenacet, Diflufenican | K3, F1 | 0,35 | Atlantis WG® + AHL; Axial® 50 | Mesosulfuron/ | B/B; A | 500 + 30; 1,2 |
2013/14 | WR | Nimbus® CS; Agil® S; KerbTM Flo | Clomazone, Metazachlor; Propaquizafop; Propyzamid | F3, K3; A; K1 | 2,0; 1,0; 1,875 | ||||
2012/13 | WW | Herold® SC | Flufenacet, Diflufenican | K3, F1 | 0,35 | Atlantis WG® + AHL; Axial® 50 | Mesosulfuron/ | B/B; A | 500 + 30; 1,2 |
2011/12 | WW | Herold® SC | Flufenacet, Diflufenican | K3, F1 | 0,35 | Atlantis WG® + AHL | Mesosulfuron/ | B/B; A | 400 + 30 |
2010/11 | WR | Colzor® Trio; KerbTM Flo | Clomazone, Metazachlor; Propyzamid | F3, K3; K1 | 1,5, 1,0; 1,25 | ||||
WW = Winterweizen. WR = Winterraps. HRAC = Herbicide Resistance Action Committee. AWM = Aufwandmenge. AHL = Ammoniumnitrat-Harnstoff-Lösung. | |||||||||
Al-Doss, A.A., A.I. Ghazy, A.E.K. Salem, H.M. Migdadi, S.A. Al-Faifi, 2013: Identification and distribution of ALS resistant Lolium rigidum populations in Saudi Arabia. Journal of Food, Agriculture and Environment 11, 1311-1314.
Altieri, M.A., 1999: The ecological role of biodiversity in agroecosystems. Agriculture, Ecosystems and Environment 74, 19-31.
Baker, H.G., 1974: The evolution of weeds. Annual Review of Ecology and Systematics 5, 1-24.
Bartels, G., 2002: Pflanzenschutzprobleme bei nicht wendender Bodenbearbeitung. In: Schöber-Butin, B. (Hrsg.): Pflanzenschutz im Ackerbau – Festschrift anlässlich des 80. Geburtstages von Dr. Friedrich Schütte. Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft 388, 25 S.
Bennett, H.W., H.W. Johnson, 1968: Registration of Magnolia annual ryegrass. Crop Science 8, 401.
Blackshaw, R.E., R.L. Andersson, D. Lemerle, 2007: Cultural weed management, In: M.K. Upadhyaya, R.E. Blackshaw, (eds.) Non-Chemical Weed Management: Principles, Concepts and Technology, 35-48. Wallingford, UK, CAB International.
Böhm, H., 2014: Unkrautregulierung durch Fruchtfolgegestaltung und alternative Managementverfahren. Julius-Kühn-Archiv 443, 24-36.
Chandi, A., A.C. York, D.L. Jordan, J.B. Beam, 2011: Resistance to acetolactate synthase and acetyl Co-A carboxylase inhibitors in North Carolina Italian ryegrass (Lolium perenne). Weed Technology 25, 659-666.
Délye, C., 2005: Weed resistance to acetyl coenzyme A-carboxylase inhibitors: an update. Weed Science 53, 728-746.
Drobny, H.G., J. Perez, M. Feierler, F.G. Felsenstein, J.R. Gertz, C. Schleich-Saidfar, N. Balgheim, 2008: Auftreten und Charakterisierung von einzelnen Kamille-Populationen (Matricaria recutita L.) mit Resistenz gegen ALS-Hemmer in Schleswig Holstein. Journal of Plant Diseases and Protection, Special Issue XXI, 11-19.
Fortmeier, R., B. Belitz, B. Glaser, M. Konradt, 2006: Ralon Super – Herbstanwendung gegen Alopecurus myosuroides (Ackerfuchsschwanz) in Wintergerste. Journal of Plant Diseases and Protection. Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz, Sonderheft XX, 997-1003.
Han, H., Q. Yu, M.J. Owen, G.R. Cawthray, S.B. Powles, 2015: Widespread occurrence of both metabolic and target-site herbicide resistance mechanisms in Lolium rigidum populations. Pest Management Science. http://onlinelibrary.wiley.com/doi/10.1002/ps.3995 (Monday, November 02, 2015).
Hasler, M., L.A. Hothorn, 2008: Multiple Contrast Tests in the presence of heteroscedasticity. Biometrical Journal 50, 793-800.
Hayman, D.L., 1992: The S-Z incompatibility system. In: Chapman, G.P. (ed.): Grass Evolution and Domestication, 117-137.
Heap, I., 2015: The International Survey of Herbicide Resistant Weeds. www.weedscience.org (Thursday, October 08, 2015).
Heap, I., R. Knight, 1982: A population of ryegrass tolerant to the herbicide diclofop-methyl. Journal of the Australian Institute of Agricultural Science 48, 156-157.
Hull, R., L.V. Tatnell, S.K. Cook, R. Beffa, S.R. Moss, 2014: Current status of herbicide-resistant weeds in the UK. Aspects of Applied Biology 127, 261-272.
Jauhar, P.P., 1993: Cytogenetics of the Festuca-Lolium Complex. Relevance to Breeding. Monographs Theoretical and Applied Genetics 18. Berlin, Springer-Verlag.
Kassam, A., T.F. Friedrich, 2010: Conservation agriculture in the 21st Century: A paradigm of sustainable agriculture. European Congress of Conservation Agriculture, Madrid. www.fao.org/ag/ca/CAPublications/ECAF_congress_Madrid_2010.pdf (Thursday, October 15, 2015).
Kaundun, S.S., 2014: Resistance to acetyl-CoA carboxylase-inhibiting herbicides. Pest Management Science 70, 1405-1417.
Kubik, C., W.A. Meyer, B.S. Gaut, 1999: Assessing the abundance and polymorphism of simple sequence repeats in perennial ryegrass. Crop Science 39, 1136-1141.
Lebaron, H.M., 1984: Herbicide resistance in plants – future research needs. Weeds Today 15, 2-5.
Liebman, M., E. Dyck, 1993: Crop-rotation and intercropping strategies for weed management. Ecological Applications 3, 92-122.
LLUR, 2012: Die Böden Schleswig-Holsteins. Entstehung, Verbreitung, Nutzung, Eigenschaften und Gefährdung. Landesamt für Landwirtschaft, Umwelt und ländliche Räume des Landes Schleswig-Holstein (LLUR). Schriftenreihe LLUR SH – Geologie und Boden; 11, 22. https://www.umweltdaten.landsh.de/nuis/upool/gesamt/geologie/boden_sh.pdf (Freitag, 11. September 2015).
Martins, B.A.B., E. Sanchez-Olguin, A. Perez-Jones, C. Mallory-Smith, 2012: ACCase cross-resistance in italian ryegrass (Lolium multiflorum) sub-populations from Oregon, US. Julius-Kühn-Archiv 434, 177-182.
Michitte, P., N. Espinoza, R. Prado, 2003: Cross-resistance to ACCase inhibitors of Lolium multiflorum, Lolium perenne and Lolium rigidum found in Chile. Communications in Agricultural and Applied Biological Sciences 68, 397-402.
Moss, I., 2004: Herbicide-resistant weeds in Europe: the wider implications. Communications in Agricultural and Applied Biological Sciences 69, 3-11.
Pallutt, B., 2000: Unkrautunterdrückung und -bekämpfung durch Fruchtfolgegestaltung, Bodenbearbeitung, Aussaatzeit, Saatmenge und Stickstoffversorgung. In: Pallutt, B. (ed.) Pflanzenschutz im Ökologischen Landbau – Probleme und Lösungsansätze – Drittes Fachgespräch am 02.11.1999 in Kleinmachnow –„Unkrautregulierung im ökologischen Landbau“. Berichte aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft 72, 35-46.
Peters, M., B. Freier, F. Holst, S. Goltermann, C. Büttner, 2015: Die Anwendung einer Checkliste zur Bewertung der Umsetzung des integrierten Pflanzenschutzes in den Demonstrationsbetrieben integrierter Pflanzenschutz im Ackerbau am Beispiel Mecklenburg-Vorpommern. Gesunde Pflanzen 67, 33-44.
Powles, S.B., Q. Yu, 2010: Evolution in action: plants resistant to herbicides. Annual Review of Plant Biology 61, 317-347.
RDevelopment Core Team, 2008: A language and environment for statistical computing [Internet]. Vienna, Austria: R Foundation for Statistical Computing, 2008. Available from: http://www.r-project.org.
Rosenhauer, M., B. Jaser, F.G. Felsenstein, J. Petersen, 2013: Development of target-site resistance (TSR) in Alopecurus myosuroides in Germany between 2004 and 2012. Journal of Plant Diseases and Protection 120, 179-187.
Salas, R.A., N.R. Burgos, A. Mauromoustakes, R.B. Lassiter, R.C. Scott, E.A. Alcober, 2013: Resistance to ACCase and ALS inhibitors in Lolium perenne ssp. multiflorum in the United States. Journal of Crop and Weed 9, 168-183.
Tan, M.-K., C. Preston, G.-X. Wang, 2007: Molecular basis of multiple resistances to ACCase-inhibiting and ALS-inhibiting herbicides in Lolium rigidum. Weed Research 47, 534-541.
Tranel, P.J., T.R. Wright, 2002: Resistance of weeds to ALS-inhibiting herbicides: what have we learned? Weed Science 50, 700-712.
Ulber, L., E. Svoboda, B. Jaser, F.G. Felsenstein, P. Zwerger, 2012: Deutschlandweites Monitoring zur ALS-Resistenz bei Kamille-Arten. Julius-Kühn-Archiv 438, 318-319.
Yu, Q., A. Collavo, M.-Q. Zheng, M. Owen, M. Sattin, S.B. Powles, 2007: Diversity of acetyl-coenzyme A carboxylase mutations in resistant Lolium populations: Evaluation using clethodim. Plant Physiology 145, 547-558.
Yu, Q., S.B. Powles, 2014: Resistance to AHAS inhibitor herbicides: current understanding. Pest Management Science 70, 1340-1350.
Zwerger, P., H.U. Ammon (Hrsg.), 2002: Unkraut – Ökologie und Bekämpfung. Unter Mitarbeit von K. Arlt et al. Stuttgart (Hohenheim), Ulmer Verlag, S. 205-218.