

Contarinia pseudotsugae (Condrashoff, 1961) (Diptera, Cecidomyidae): eine nordamerikanische Gallmücke an Douglasien im Nordostdeutschen Tiefland
Contarinia pseudotsugae (Condrashoff, 1961) (Diptera, Cecidomyidae): a North American gall midge on Douglas-fir in the northeast German lowlands
Journal für Kulturpflanzen, 69 (10). S. 351–358, 2017, ISSN 1867-0911, DOI: 10.1399/JfK.2017.10.03, Verlag Eugen Ulmer KG, Stuttgart
Die Douglasie, ein aus Nordamerika eingeführter und mittlerweile in Europa etablierter Neophyt, ist zunehmend von Schäden durch aus ihrer Heimat nachfolgend, eingeschleppte sowie sich anpassende europäische Phytophage betroffen. Die nordamerikanische Gallmückenart Contarinia pseudotsugae wurde in Europa zuerst im Jahr 2015 in den Niederlanden, Belgien und Frankreich nachgewiesen. Eine gezielte Probennahme in Douglasienbeständen im Bundesland Brandenburg zeigt nun, dass Contarinia pseudotsugae auch im Nordostdeutschen Tiefland verbreitet ist. Eine weitere Verbreitung in Deutschland und Europa ist zu erwarten. Die vorliegende Untersuchung stützt die Einschätzung, dass der Versuch einer Ausrottung nicht mehr sinnvoll ist.
Stichwörter: Contarinia pseudotsugae, Cecidomyidae, Diptera, Gallmücke, Pseudotsuga menziesii, Douglasie, Neophyt, Neozoon, invasive Art
Douglas-fir, a deliberately introduced and established neophyte in Europe, is affected at an increasing rate by damage caused by specialized associated insects, which were introduced to Europe following the host, and native European phytophagous insects, which are adapting more and more to Douglas-fir. The first records in Europe of the North American gall midge species Contarinia pseudotsugae were reported from the Netherlands, Belgium and France in 2015. Twig samples collected from Douglas-fir stands in the German federal state of Brandenburg indicated a distributed occurrence of Contarinia pseudotsugae in the northeast German lowlands. Consequently, a broader distribution of the gall midge in Germany and Europe is to be expected. This study supports the assessment that attempting to eradicate the gall midge is no longer feasible.
Key words: Contarinia pseudotsugae, Cecidomyidae, Diptera, gall midge, Pseudotsuga menziesii, Douglas-fir, neophyte, neozoon, invasive species
Einfuhrgeschichte. Im 19. Jahrhundert wurden viele Pflanzenarten als Zierpflanzen nach Europa eingeführt (Seebens et al., 2017), so auch die im westlichen Nordamerika (Kanada, USA, Mexiko) beheimatete Douglasie (Pseudotsuga menziesii (Mirb.) Franco, 1950). David Douglas führte 1827 Douglasiensamen nach Schottland und damit erstmals nach Europa ein (Hermann, 2004). In Deutschland begann die Anpflanzung im Rahmen der Landschaftsgestaltung um 1830 und der forstliche Anbau ab 1850 (Spellmann et al., 2015a). Ein großflächiger Anbau setzte nach 1945 ein (Hermann, 2004). Heute kommt die Douglasie in nahezu allen Ländern Europas vor, mit einem Schwerpunkt in Frankreich, gefolgt von Deutschland (Hermann, 2004) mit einem Anteil von ca. 2% an der Waldfläche (217.604 ha, BMEL, 2016). Im Land Brandenburg sind 0,8% der Waldfläche mit Douglasien bestockt (8.660 ha, LWI Brandenburg, 2013).
Varietäten.
Das disjunkte Areal der Douglasie in Nordamerika hat zur Ausbildung von Varietäten geführt. Im europäischen Schrifttum werden drei Varietäten unterschieden (Hermann, 2004; Spellmann et al., 2015a):
• Pseudotsuga menziesii var. menziesii – Grüne oder Küsten-Douglasie |
• Pseudotsuga menziesii var. glauca – Blaue oder Inlands- Douglasie |
• Pseudotsuga menziesii var. caesia – Graue Douglasie als Übergangsform der Varietäten menziesii und glauca |
Eine Vielzahl von Anbauversuchen zeigte bald, dass sich die Varietäten hinsichtlich ihrer Leistungs- und Widerstandsfähigkeit stark unterscheiden (z.B. Kanzow, 1937; Hennig, 1951).
Heute wird in Deutschland zumeist nur noch die besonders wüchsige und hinsichtlich der Rostigen Douglasienschütte wenig anfällige Varietät menziesii, die Grüne Douglasie, angebaut (Hermann, 2004; Spellmann et al., 2015a).
Forstliche Bedeutung. In Mitteleuropa ist die Douglasie die häufigste gebietsfremde Baumart auf Forstflächen (Da Ronch et al., 2016). Aufgrund ihrer sehr hohen Wuchsleistung und günstigen Holzeigenschaften wird die Douglasie in Deutschland als mit Abstand wichtigste eingeführte Waldbaumart bewertet (Kownatzki et al., 2011; Spellmann, et al. 2015b). Aus forstwirtschaftlicher Sicht wird oft betont, dass die Douglasie hier ihre Anbauwürdigkeit und -sicherheit bewiesen hat (Göhre, 1958; Galonska, 2010; Rieder, 2014; Vor et al., 2015). Aktuell wird ihr in Deutschland große forstwirtschaftliche Bedeutung beigemessen.
Biotische Schäden. In den ersten Jahren des Douglasienanbaus in Europa erschienen die Bäume sehr vital, bald zeigte sich jedoch, dass auch die Douglasie für biotische und abiotische Schäden anfällig ist (Lyr, 1958). 1922 wurde die Rostige (Rhabdocline pseudotsugae Syd. 1922) und 1925 die Rußige Douglasienschütte (Phaeocryptopus gaeumannii (T. Rohde) Petr. 1938) nach Europa eingeschleppt (Hermann, 2004; Möller und Heydeck, 2009). Hennig (1951) betrachtete die Rußige Douglasienschütte als einzige ernste Gefahr für die Grüne Douglasie. In den 1950er Jahren verursachten zwei aus Nordamerika eingeschleppte, auf die Douglasie spezialisierte Insektenarten, neben den beiden Douglasienschütten die größten forstwirtschaftlichen Schäden an der Douglasie: die Douglasien-Samenwespe (Megastigmus spermotrophus Wachtl, 1893) und die Sitka-Fichtengallenlaus (Adelges cooleyi (Gillette, 1907)) (Hennig, 1951; Kruel und Teucher, 1958; Hermann, 2004; Schäfer-Penzel und Schumacher, 2015). Megastigmus spermotrophus wurde wahrscheinlich im letzten Teil des 19. Jahrhunderts in Europa eingeschleppt und ist mittlerweile überall in Europa verbreitet (Roques und Skrzypczynska, 2003; Roques et al., 2006). Das fast vollständige Fehlen von Konkurrenten und natürlichen Feinden ermöglichte der Samenwespe in Europa eine starke Vermehrung mit entsprechend umfangreichen Schäden an Douglasiensaatgut (Roques et al., 2006). Adelges cooleyi wurde 1913 erstmals in Europa (Großbritannien) nachgewiesen und breitete sich in den folgenden Jahrzehnten in Europa aus (Chrystal, 1922; Wimmer, 1935; Francke-Grosmann, 1950). Die Laus galt Kruel und Teucher (1958) als wichtigste und in Europa am weitesten verbreitete forstschädliche Tierart an der Douglasie.
Die große Gefährdung durch die Einschleppung von Schadorganismen wurde für die Douglasie schon vor Jahrzehnten erkannt (Kruel und Teucher, 1958) und ist heute so aktuell wie damals. Weitere Insektenarten folgten der Douglasie nach Europa: 1933 der Amerikanische Nutzholzborkenkäfer (Gnathotrichus materiarius (Fitch, 1858)) und 1999 die Amerikanische Kiefernzapfenwanze (Leptoglossus occidentalis (Heidemann, 1910)) (Balachowsky, 1949; Bernardinelli und Zandigiacomo, 2001; Schmidt, 2004; Rabitsch und Heiss, 2005; Goßner und Ammer, 2006; Goßner, 2008).
Einheimische Tierarten begannen sich an die Douglasie anzupassen, verursachten jedoch nicht so schwerwiegende Schäden wie die eingeschleppten Arten und neigen bisher kaum zu Massenvermehrungen (Kruel und Teucher, 1958; Goßner, 2004; Roques et al., 2006; Blaschke et al., 2008; Lemme, 2009; Roques, 2010a; Kownatzki et al., 2011; Rieder, 2014). Roques (2010a) kam zu dem Schluss, dass die zögerliche Anpassung einheimischer Arthropodenarten an die Douglasie in Europa auf die große phylogenetische Distanz der Douglasie zu den europäischen Baumarten zurückzuführen ist. Heute ist die Douglasie (auch aufgrund der zunehmenden Anbaufläche) einer weiterhin wachsenden Gefährdung durch ihr nachfolgende, eingeschleppte, spezialisierte Organismen und auch durch die Anpassung europäischer Schadorganismen, die durch den erwarteten Klimawandel beschleunigt werden könnte, ausgesetzt (Goßner, 2004; Goßner, 2008; Möller und Heydeck, 2009; Lemme, 2009; Roques, 2010a; Kownatzki et al., 2011; Rieder, 2014; Spellmann et al., 2015a).
Arten.
Seit 1935 waren nadelminierende Gallmücken an der Douglasie in ihrem natürlichen Areal bekannt (Condrashoff, 1961a). Condrashoff beschrieb 1961 drei neue Gallmückenarten, die Gallbildungen an Douglasiennadeln verursachen. Er trennte die folgenden Arten:
• Contarinia pseudotsugae (Condrashoff, 1961) |
• Contarinia constricta (Condrashoff, 1961) |
• Contarinia cuniculator (Condrashoff, 1961). |
C. pseudotsugae galt als häufigste Art, die den regelmäßigsten Befall und die stärksten Schäden auslöste (Condrashoff, 1962).
In Nordamerika leben fünf Gallmückenarten der Gattung Contarinia an Pseudotsuga (Gagne und Jaschhof, 2014). Neben den oben genannten Arten verursachen C. oregonensis und C. washingtonensis Gallenbildungen in den Zapfen (Hedlin, 1974). Sie erschweren die Samenernte, weil ihre Gallen verhindern, dass sich die Zapfen normal öffnen (Hermann, 2004; FAO, 2009).
Biologie. Die drei oben genannten gallbildenden Contarinia-Arten besiedeln ausschließlich den jüngsten Nadeljahrgang (De Angelis, 1994; Hagle et al., 2003). Die Biologie der Arten in Nordamerika beschreiben Condrashoff (1962), Simko (1982), De Angelis (1994) und Bulaon (2005) wie folgt: Pro Jahr entwickelt sich eine Generation. Die Imagines leben nur 1–4 Tage. Die Eiablage erfolgt an jungen Douglasiennadeln und aufgehenden Knospen. Die Larven durchlaufen drei Larvenstadien. Während ihres Minierfraßes in der Nadel erfolgt gleichzeitig die Gallbildung. Im Herbst verlässt die Larve die Nadel und überwintert im Boden, wo im Frühjahr die Verpuppung erfolgt. In Nordamerika treten zyklische Massenvermehrungen auf.
Schäden. Die Gallbildungen gehen einher mit einer Deformation und Verfärbung des jüngsten Nadeljahrgangs und führen teilweise zum vorzeitigen Abfallen der betroffenen Nadeln (Simko, 1982; De Angelis, 1994; Hagle et al., 2003). Nach mehrjährigen Nadelverlusten wurde auch das Zurücksterben von Zweigen beobachtet (Condrashoff, 1962; Hagle et al., 2003). Die verursachten Schäden führten insbesondere in Weihnachtsbaumkulturen zu wirtschaftlichen Verlusten (Simko, 1982; Hagle et al., 2003; Bulaon, 2005). Ganze Pflanzen starben jedoch nicht ab (Condrashoff, 1962).
Arten. Die Gallmücken (Cecidomyiidae) umfassen in Europa ca. 1800 valide Arten in 3 Unterfamilien (Skuhrava und Skuhravy, 2009). Nur in der Unterfamilie Cecidomyiinae treten Gallbildner und phytophage Arten auf (Skuhrava und Skuhravy, 2009). Die Gattung Contarinia steht bezüglich des Artenreichtums mit 135 Arten in Europa an zweiter Stelle (Skuhrava und Skuhravy, 2009). Bis 2014 waren in Europa keine Gallmückenarten und auch keine anderen Gallenerzeuger an der Douglasie bekannt (Roques et al., 2006).
Europa. 2015 wurden nordamerikanische Gallmücken der Gattung Contarinia an Douglasiennadeln in den Niederlanden, Belgien und Frankreich nachgewiesen (NPPO, 2016; Departement de la sante des forets, 2016; EPPO, 2017). Die morphologische Artbestimmung ergab C. pseudotsugae in den Niederlanden, Belgien und Frankreich sowie in den Niederlanden zusätzlich C. cuniculator. Die Fundumstände ließen erkennen, dass die Gallmücken schon seit Jahren in den Niederlanden vorkommen und dort etabliert sind (NPPO, 2016).
Deutschland. 2016 wurde Contarinia pseudotsugae in den südwestdeutschen Bundesländern Baden-Württemberg und Rheinland-Pfalz nachgewiesen (Schumacher, 2017; Delb et al., 2017a, 2017b).
Die Forstbediensteten in den Oberförstereien und Forstrevieren des Landesbetriebes Forst Brandenburg wurden am 6. September 2016 über die neuen Gallmückenarten und ihr Schadbild informiert und aufgefordert, Zweigproben aus verdächtig aussehenden, jungen Douglasienbeständen zu entnehmen und zur Untersuchung an das LFE einzuschicken. Der Zeitpunkt wurde so gewählt, dass bei Vorkommen der Tiere Gallen zu erwarten waren.
103 Einzelproben aus 31 Forstrevieren, die vom 12.–28. September 2016 entnommen wurden, gingen in die Untersuchung ein (vgl. Abb. 7). Das Vorkommen der gesuchten Gallmücken wurde als gesichert bewertet, wenn in den Gallen Larven nachgewiesen wurden. Die Determination des zweiten und dritten Larvenstadiums (L2 und L3) sowie der Gallen erfolgte nach Condrashoff (1961b). Neben der Probenahme wurden auch Angaben zum Standort, zum beprobten Douglasienbestand (Alter, Oberhöhe, Bestockungsgrad, Begründungsart) und zu einem gegebenenfalls vorhandenen Oberstand (Baumgattung, Alter, Bestockungsgrad) erfasst.
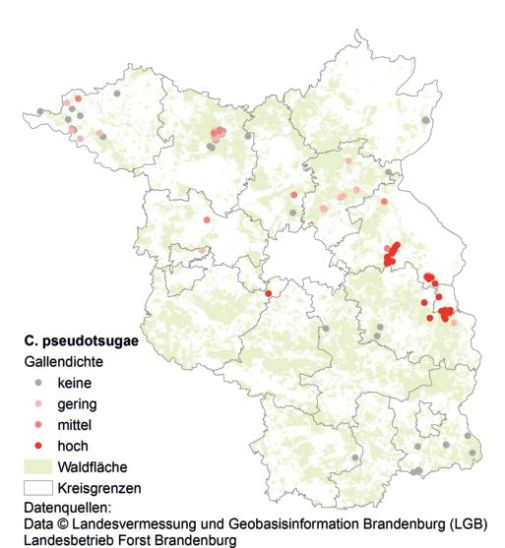
Abb. 7. Contarinia pseudotsugae im Land Brandenburg: Nachweise und Probepunkte (grauer Punkt = Probenahmeort ohne Nachweis).
Von den drei in Nordamerika in Douglasiennadeln minierenden Gallmückenarten (C. pseudotsugae, C. constricta, C. cuniculator; Condrashoff, 1961b) wurde in der vorliegenden Untersuchung nur Contarinia pseudotsugae nachgewiesen (Tab. 1, Abb. 1–6).
Tab. 1. Contarinia pseudotsugae – ausgewählte Merkmale (Condrashoff, 1961b, 1962; ergänzt)
Stadium | ausgewählte Merkmale |
L2 | Larve durchscheinend bzw. fast farblos |
L3 | Larve hellgelb oder weiß bzw. orange gefleckt (Abb. 1), |
Lappen am Vorderteil der Brustgräte (Spatula sternalis) mit konvexen Seiten (Abb. 2) | |
Galle | am diesjährigen Nadeljahrgang; Nadelober- und -unterseite verfärbt, oft leicht geschwollen, |
Die drei Larvenstadien von Contarinia pseudotsugae wurden in Proben aus den folgenden Entnahmezeiträumen nachgewiesen, wobei eine Weiterentwicklung während der Lagerung der Proben nicht auszuschließen ist:
L1: |
13.–16. September 2016 |
|
L2: |
12.–28. September 2016 |
|
L3: |
ab 15. September 2016 |
Pro Douglasiennadel wurden maximal sechs L2-Larven bzw. fünf L3-Larven festgestellt.
Contarinia pseudotsugae wurde in 57% der Proben nachgewiesen. Abbildung 7 zeigt neben der Verbreitung von C. pseudotsugae in Brandenburg auch die Orte der Probenahme und enthält Hinweise auf die Besiedlungsdichte. Im Südteil Brandenburgs wurde die Gallmücke noch nicht nachgewiesen. Ein Vorkommensschwerpunkt liegt östlich von Berlin.
Die forstlichen Bestandesdaten der beprobten Bestände liefern erste Hinweise auf die Habitatansprüche von C. pseudotsugae in Brandenburg. Gallen wurden über die gesamte Altersspanne der untersuchten Douglasien (hauptsächlich 3–35 Jahre, maximal 61 Jahre) nachgewiesen. Die Oberhöhe (Schwankungsbreite der Proben: 0,8–27 m) und der Schlussgrad (0,3–1,38) der Douglasien ließen anhand der vorliegenden Proben keinen Einfluss auf die Besiedlung durch die Gallmücke erkennen. Gallen wurden sowohl in Douglasienpflanzungen als auch in -naturverjüngung nachgewiesen. Douglasien auf allen beprobten Standorten (A2, Z1, Z2, M2, K2) wiesen Gallen auf.
An den untersuchten Douglasienzweigen wurden außerdem häufig die Sitka-Fichtengallenlaus (Adelges cooleyi) und Eigelege von Staubläusen (Psocoptera) vorgefunden. Seltener gelangen Nachweise der Lärchen-Miniermotte (Coleophora laricella (Hübner, (1817)). Die Rußige Douglasienschütte war an fast allen Proben nachweisbar.
Die Färbung der Larven von Contarinia pseudotsugae, die Condrashoff (1961b) als hellgelb oder weiß bzw. orange gefleckt beschreibt, könnte ähnlich wie bei Obolodiplosis robiniae (Haldeman, 1847) auf eine Besiedlung der Gallmückenlarven durch Endoparasitoide zurückzuführen sein. Die Larven von O. robiniae sind ursprünglich weißlich gefärbt, erst die Parasitierung durch Platygaster spec. ändert ihre Farbe hin zu gelb (Skuhrava et al., 2007)
Die Verbreitung und die Häufigkeit der Gallen von C. pseudotsugae im Land Brandenburg zeigen, dass die Gallmücke sehr wahrscheinlich schon vor 2016 nach Brandenburg gelangte. Aufgrund der Nachweise in der Nähe der brandenburgischen Landesgrenze können auch Vorkommen in Polen und den deutschen Bundesländern Mecklenburg-Vorpommern, Sachsen-Anhalt und Niedersachsen erwartet werden. Schumacher (2017) vermutet in den nächsten Jahren eine Ausbreitung von C. pseudotsugae im gesamten Douglasiengebiet Südwestdeutschlands. Seit 2015 sind folgende Fundstellen der Gallmücke in Europa veröffentlicht worden: zwei Provinzen der Niederlande, mehrere Fundorte in Belgien, in Frankreich, mindestens drei Forstämter in Baden-Württemberg, mindestens zwölf in Rheinland-Pfalz verteilte Forstämter sowie 59 in der nördlichen Hälfte Brandenburgs verteilte Fundpunkte. Diese räumlich verteilten Funde lassen eine weitere Verbreitung der unscheinbaren, wahrscheinlich oft übersehenen Gallmücke in Deutschland und Europa erwarten. Die Einschätzung der NPPO (2016), dass eine Ausrottung der Gallmücke aufgrund ihrer weiten Verbreitung nicht mehr möglich ist, wird durch die vorliegende Untersuchung gestützt. Wirtschaftliche Bedeutung könnte die Gallmücke hier durch langfristige Zuwachsverluste bei der Produktion von Douglasienholz (derzeit noch nicht abschätzbar), durch ästhetische Qualitätsminderungen von Douglasien als Weihnachtsbaum (Baumart Douglasie mit nachrangiger Bedeutung) sowie für die Produktion von Schmuckreisig erlangen.
Wie schnell die Ausbreitung auch so fragiler Tiere wie Gallmücken vonstattengehen kann, zeigt die von Skuhrava et al. (2007) beschriebene Ausbreitung von Obolodiplosis robiniae in Europa: O. robiniae und ihr Wirtsbaum die Robinie (Robinia pseudoacacia L.) sind im Ostteil der USA beheimatet. Der erste Nachweis der Gallmücke in Europa erfolgte 2003 in Italien. Skuhrava et al. beschreiben 2007 Vorkommen in weiteren 14 europäischen Ländern. Als mögliche Gründe für die schnelle Verbreitung der Gallmücke nennen die Autoren den Handel mit Baumschulpflanzen, an deren aufbrechenden Knospen die Besiedlung mit bloßem Auge noch nicht erkennbar ist, sowie den starken internationalen Straßenverkehr, der heruntergefallenen Larven oder Imagines schnelle passive Ortswechsel ermöglicht. O. robiniae erreichte eine Ausbreitungsgeschwindigkeit von 2000 km in 3 Jahren. Vor dem Hintergrund der zerstreuten Verbreitung der Robinie in den meisten durch die Gallmücke besiedelten Ländern Europas (Ausnahme: Ungarn) verlief die Ausbreitung von O. robiniae überraschend schnell. Weitere kleine Insektenarten, die sich nach ihrer Einschleppung stark ausgebreitet haben, sind die Rosskastanienminiermotte (Cameraria ohridella (Deschka und Dimic, 1986)) und die Esskastaniengallwespe (Dryocosmus kuriphilus (Yasumatsu, 1951)).
Mit C. pseudotsugae ist eine weitere Einschleppung einer an die Douglasie angepassten Insektenart aus Nordamerika nach Europa erfolgt. Für die Douglasie ist die Gallmücke neben Rhabdocline pseudotsugae, Phaeocryptopus gaeumannii, Adelges cooleyi, Megastigmus spermotrophus, Gnathotrichus materiarius und Leptoglossus occidentalis nun mindestens die siebente aus der Heimat des Wirtsbaumes nach Europa nachfolgende phytophage bzw. phytopathogene Art.
Eingeführten Wirtspflanzen nachfolgende Phytophage treffen in der neuen Heimat kaum auf Parasitoide, Prädatoren und Konkurrenten, was oft zu starker Vermehrung, Ausbreitung und größeren wirtschaftlichen Schäden als in ihrem natürlichen Areal führt (Roques et al., 2006; 2016; Roques, 2010a). Wird eine Baumart eingeführt, deren Gattung im Einfuhrgebiet noch nicht durch andere Arten vertreten ist, so kann die nachfolgende Einschleppung von im Ursprungsareal auf diese Baumart spezialisierten Insektenarten besonders große wirtschaftliche Probleme verursachen (Roques et al., 2006). Das ist bei einigen der aus Nordamerika eingeschleppten Insektenarten, welche die Douglasie besiedeln, bereits der Fall (Roques et al., 2006). Adelges cooleyi gilt Hermann (2004) als wichtigste und in Europa am weitesten verbreitete forstschädliche Tierart an der Douglasie. Megastigmus spermotrophus vernichtet in der Mehrzahl der europäischen Saatgutbestände bis zu 100% der jährlichen Samenernte (Roques et al., 2006).
Auch für Contarinia pseudotsugae könnte in den nächsten Jahren mit einer solchen Entwicklung, die eine schnelle Ausbreitung und vielleicht auch starke Schäden einschließt, gerechnet werden. Erste Berichte aus betroffenen europäischen Ländern weisen jedoch bisher nur auf geringe Schäden hin (NPPO, 2016; Delb et al., 2017a; European Commission, 2017).
Die Zahl der Erstfunde eingeschleppter Arthropodenarten nimmt seit dem 16. Jahrhundert exponentiell zu (Roques, 2010b). Wurden anfangs vornehmlich größere Tierarten eher absichtlich eingeführt, gab es eine Verschiebung hin zur unbeabsichtigten Einschleppung eher kleiner, unauffälliger Arten, die übersehen werden und relativ lange unentdeckt bleiben können. Unter den von Roques (2010b) anhand der DAISIE-Datenbank (DAISIE = Delivering Alien Invasive Species Inventories for Europe) gezählten, in Europa etablierten, 1590 gebietsfremden Arthropodenarten waren zum Beispiel 102 Blattlausarten der Familie Aphididae und 97 Schildlausarten der Familien Diaspididae und Pseudococcidae.
Ein bedeutender Einschleppungsweg für phytophage Arthropoden ist der zunehmende Handel mit lebenden Garten- und Zierpflanzen (Rabitsch, 2010; Roques, 2010b; Roques et al., 2016). Regelungen und Maßnahmen zur Verhinderung der Einschleppung von Neobiota, die lebende Pflanzen betreffen, sind in vielen Ländern unzureichend vorhanden oder umgesetzt (Wingfield et al., 2015).
Aufgrund des zunehmenden und beschleunigten internationalen Handels und Verkehrs wird es immer schwieriger, Einschleppungen zu verhindern. Zudem kann die globale Klimaerwärmung dazu führen, dass eingeschleppte Arten ihr neues Verbreitungsgebiet verschieben, was auch dazu führen kann, dass sie in zuvor ungeeigneten Regionen überleben und sich reproduzieren können (Walther et al., 2009). Auffällig werden einerseits insbesondere die Arten, die wirtschaftliche Schäden oder gesundheitliche Probleme verursachen und andererseits Arten, die durch ihre Häufigkeit auffallen. Monitoring und Ausrottung einmal eingeschleppter Arten sind oft kostenintensiv (z.B. Asiatischer Laubholzbock – Anoplophora glabripennis (Motschulsky 1853)). In vielen Fällen ist eine Ausrottung auch nicht mehr möglich (z.B. Adelges cooleyi).
Seebens et al. (2017), die die Daten zur weltweiten Einschleppung gebietsfremder Arten seit dem Jahr 1500 auswerteten, kamen zu dem Schluss, dass es keine Anzeichen für eine Sättigung der Anzahl eingeschleppter Arten, d.h. für eine Verlangsamung der Einschleppungsrate, gibt. Seit ca. 100 Jahren werden zunehmend nationale Regelungen und internationale Abkommen, die die Einschleppung von Arten verhindern sollen, implementiert. Bisher waren sie jedoch nicht effektiv genug, um die Akkumulation gebietsfremder Arten, insbesondere von wirbellosen Tierarten und Pathogenen zu verlangsamen (Seebens et al., 2017). Die Autoren erwarten deshalb in naher Zukunft die Einschleppung weiterer gebietsfremder Arten. Sie halten die gegenwärtigen Anstrengungen zum Schutz vor Einschleppungen für völlig unzureichend (Seebens et al., 2017; Wingfield et al., 2015).
Dank gilt meinen Kolleginnen und Kollegen aus den Forstrevieren, Oberförstereien und Landeswaldoberförstereien für die Auswahl der Probebestände und die Probenahme. Besonderer Dank gilt auch Frau Nicola Nier, die bei der Untersuchung der Proben half, und meiner Kollegin Frau Cornelia Jacob für die digitale Datenerfassung der Aufnahmebögen. Wietse den Hartog (Nederlandse Voedsel- en Warenautoriteit) hat Fotos der Gallen für den Aufruf zur Probenahme bereitgestellt.
Abb. 1–6: Kati Hielscher
Balachowsky, A., 1949: Faune de France 50. Coleopteres Scolytides. Paris.
Bernardinelli, I., P. Zandigiacomo, 2001: Leptoglossus occidentalis Heidemann (Heteroptera, Coreidae): a conifer seed bug recently found in northern Italy. Journal of Forest Science 47, 56-58.
Blaschke, M., H. Bußler, O. Schmidt, 2008: Die Douglasie – (k)ein Baum für alle Fälle. LWF Wissen 59, 57-61.
Bulaon, B., 2005: Management Guide for Douglas-fir Needle Midges. https://www.fs.usda.gov/Internet/FSE_DOCUMENTS/stelprdb5187407.pdf, (Stand: 29.06.2017).
Bundesministerium für Ernährung und Landwirtschaft (BMEL) [Hrsg.], 2016: Der Wald in Deutschland. Ausgewählte Ergebnisse der dritten Bundeswaldinventur. 2. korrigierte Aufl., Berlin.
Chrystal, R.N., 1922: The Douglas Fir Chermes (Chermes cooleyi.). Bulletin Forestry Commission, London No. 4, 59 S.
Condrashoff, S.F., 1961a: Three New Species of Contarinia Rond. (Diptera: Cecidomyiidae) in Douglas-Fir Needles. The Canadian Entomologist 93, 123-130.
Condrashoff, S.F., 1961b: Description and Morphology of the Immature Stages of Three Closely Related Species of Contarinia Rond. (Diptera: Cicidomyiidae) from Galls on Douglas-fir Needles. The Canadian Entomologist 93, 833-851.
Condrashoff, S.F., 1962: Bionomics of Three Closely Related Species of Contarinia Rond. (Diptera: Cecidomyiidae) from Douglas-fir Needles. The Canadian Entomologist 94, 376-394.
Da Ronch, F., G. Caudull, D. de Rigo, 2016: Pseudotsuga menziesii in Europe: distribution, habitat, usage and threats. In: San-Miguel-Ayanz, J., D. de Rigo, G. Caudullo, T. Houston Durrant, A. Mauri, A. (eds.): European Atlas of Forest Tree Species. Publ. Off. EU, Luxembourg, 146-147.
De Angelis, J.D., 1994: Biology and Control of Douglas-fir Needle Midge in Christmas Trees. EC 1373-E. Oregon State University, 2 S., https://catalog.extension.oregonstate.edu/sites/catalog/files/project/pdf/ec1373.pdf, (Stand: 06.07.2017).
Delb, H., R. John, B. Metzler, J. Schumacher, G. Seitz, J. Wußler, 2017a: Waldschutzsituation 2016/2017 in Baden-Württemberg. AFZ-DerWald 7/2017, 16-20.
Delb, H., R. John, B. Metzler, J. Schumacher, G. Seitz, J. Wußler, 2017b: Waldschutzsituation 2016/2017 in Rheinland-Pfalz und Saarland. AFZ-DerWald 7/2017, 26-29.
Departement de la sante des forets, 2016: Contarinia pseudotsugae sur aiguilles de Douglas, nouvel insecte en France. http://agriculture.gouv.fr/contarinia-pseudostugae-sur-aiguille-de-douglas-un-nouvel-insecte-en-france, (Stand: 21.06.2017).
EPPO, 2017: Contarinia pseudotsugae (Diptera: Cecidomyiidae). Douglas-fir needle midge. https://www.eppo.int/QUARANTINE/Alert_List/insects/Contarinia_pseudotsugae.htm, (Stand: 22.06.2017).
European Commission, 2017: Summary Report of the standing committee on plants, animals, food and feed held in Brussels on 26 January 2017–27 January 2017. (Section Plant Health) https://ec.europa.eu/food/sites/food/files/plant/docs/sc_plant-health_20170126_sum.pdf, (Stand: 06.07.2017).
FAO, 2009: Global review of forest pests and diseases. FAO Forestry Paper 156, Rom, 222 S.
Francke-Grosmann, H., 1950: Die Douglasienlaus Gilletteella cooleyi (Gill.) C. B. als Schädling der Sitkafichte. Forstwissenschaftliches Centralblatt 69, 483-493.
Gagne, R.J., M. Jaschhof, 2014: A Catalog of the Cecidomyiidae (Diptera) of the World. 3rd Edition. Digital version 2., 493 S.
Galonska, H., 2010: Waldbauliche Behandlung und wirtschaftliche Bedeutung der Douglasie in Brandenburg. AFZ-DerWald 65, 22- 24.
Göhre, K., 1958: Die Douglasie und ihr Holz. Berlin, Akademie-Verlag, 595 S.
Goßner, M., 2004: Nicht tot, aber sehr anders! – Arthropodenfauna auf Douglasie und Amerikanischer Roteiche. LWF aktuell 45, 10-11.
Goßner, M., 2008: Insektenwelten – Die Douglsie im Vergleich mit der Fichte. LWF Wissen 59, 70-73.
Goßner, M., U. Ammer, 2006: The effects of Douglas-fir on tree-specific arthropod communities in mixed species stands with European beech and Norway spruce. European Journal of Forest Research 125, 221-235.
Hagle, S.K., K.E. Gibson, S. Tunnock, 2003: Field guide to diseases and insect pests of northern and central Rocky Mountain conifers. Report No. R1-03-08. USDA Forest Service; State and Private Forestry; Northern Region, Missoula, Montana; Intermountain Region, Ogden, Utah. 197 S., https://www.idl.idaho.gov/forestry/forest-health/field-guide.pdf, (Stand: 06.07.2017).
Hedlin, A.F., 1974: Cone and Seed Insects of British Columbia. Pacific Forest Research Centre, Victoria, 63 S.
Hennig, R., 1951: Die Douglasie. Eine monographische Darstellung unserer wichtigsten fremdländischen Holzart. Radebeul, Berlin, Neumann Verlag, 40 S.
Hermann, R.K., 2004: Pseudotsuga menziesii (Mirb.) Franco, 1959. In: Schütt, P., H. Weisgerber, H. J. Schuck, U. Lang, B. Stimm, A. Roloff: Lexikon der Nadelbäume. Hamburg, Nikol Verlag, 513-530.
Kanzow, H., 1937: Die Douglasie. Aufstellung einer Ertragstafel auf Grund der Ergebnisse der Preußischen Probeflächen und Auswertung von Provenienzversuchen. Inaugural-Dissertation, Zeitschrift für Forst- und Jagdwesen 69, 65-93, 113-139, 242-271.
Kownatzki, D., W.-U. Kriebitzsch, A. Bolte, H. Liesebach, U. Schmitt, P. Elsasser, 2011: Zum Douglasienanbau in Deutschland. Ökologische, waldbauliche, genetische und holzbiologische Gesichtspunkte des Douglasienanbaus in Deutschland und den angrenzenden Staaten aus naturwissenschaftlicher und gesellschaftspolitischer Sicht. Landbauforschung Sonderheft 344, 67 S.
Kruel, W., G. Teucher, 1958: Die tierischen Feinde der Douglasie. In: Göhre, K.: Die Douglasie und ihr Holz. Berlin, Akademie-Verlag, 404-436.
Landeswaldinventur (LWI) Brandenburg, 2013: https://bwi.info/inhalt1.3.aspx?Text=1.04%20Baumartengruppe%20(rechnerischer%20Reinbestand)&prrolle=public&prInv=LWIBB2013&prKapitel=1.04 (Stand: 13.06.2017).
Lemme, H., 2009: Eine robuste Nordamerikanerin. LWF aktuell 72, 22-24.
Lyr, H., 1958: Die Krankheiten der Douglasie. In: Göhre, K.: Die Douglasie und ihr Holz. Berlin, Akademie-Verlag, 369-401.
Möller, K., P. Heydeck, 2009: Risikopotenzial und akute Gefährdung der Douglasie – biotische und abiotische Faktoren. Eberswalder Forstliche Schriftenreihe 43, 49-58.
NPPO, 2016: 2016 April Pest Report – The Netherlands. Suspicion of Contarinia pseudotsugae and Contarinia cuniculator in forest trees of Pseudotsuga menziesii in five provinces. https://www.ippc.int/static/media/files/pestreport/2017/02/07/April2016UpdatereportSuspicionofContariniapseudotsugaeandContariniacuniculatorinforesttreesofPseudotsugamenziesiiinfiveprovinces.pdf (Stand: 21.06.2017).
Rabitsch, W., 2010: Pathways and vectors of alien arthropods in Europe. In: Roques, A., M. Kenis, D. Lees, C. Lopez-Vaamonde, W. Rabitsch, J.-Y. Rasplus, D. B. Roy (eds.), 2010: Alien terrestrial arthropods of Europe. Pensoft, BioRisk 4, 27-43.
Rabitsch, W., E. Heiss, 2005: Leptoglossus occidentalis HEIDEMANN, 1910, eine amerikanische Adventivart auch in Österreich aufgefunden (Heteroptera: Coreidae). Berichte des naturwissenschaftlich-medizinischen Vereins Innsbruck 92, 131-135.
Rieder, A., 2014: Die Douglasie. Attraktive Wirtschaftsbaumart für Mitteleuropa. Weitra, Bibliothek der Provinz, 432 S.
Roques, A., 2010a: Review of present and potential insect pests affecting Douglas-fir in europe in a context of global change. Berichte Freiberger Forstliche Forschung 85, 20.
Roques, A., 2010b: Taxonomy, time and geographic patterns. In: Roques, A., M. Kenis, D. Lees, C. Lopez-Vaamonde, W. Rabitsch, J.-Y. Rasplus, D.B. Roy (eds.), 2010: Alien terrestrial arthropods of Europe. Pensoft, BioRisk 4, 11-26.
Roques, A., M.-A. Auger-Rozenberg, T.M. Blackburn, J. Garnas, P. Pysek, W. Rabitsch, D.M. Richardson, M.J. Wingfield, A.M. Liebhold, R.P. Duncan, 2016: Temporal and interspecific variation in rates of spread for insect species invading Europe during the last 200 years. Biological Invasions 18, 907-920.
Roques, A., M.-A. Auger-Rozenberg, S. Boivin, 2006: A lack of native congeners may limit colonization of introduced conifers by indigenous insects in Europe. Canadian Journal of Forest Research 36, 299-313.
Roques, A., M. Skrzypczynska, 2003: Seed-infesting chalcids of the genus Megastigmus Dalman, 1820 (Hymenoptera: Torymidae) native and introduced to the West Palearctic region: taxonomy, host specificity and distribution. Journal of Natural History 37, 127-238.
Schäfer-Penzel, S., J. Schumacher, 2015: Prüfung der Zukunftsfähigkeit der Douglasie (Pseudotsuga menziesii) aus waldhygienischer Sicht. KLIMOPASS-Berichte, 77 S.
Schmidt, O., 2004: Eingeschleppte Borkenkäferarten in Bayerischen Wäldern. LWF aktuell 45, 21-22.
Schumacher, J., 2017: Invasive Schadorganismen in südwestdeutschen Wäldern. AFZ-DerWald 7/2017, 29-33.
Seebens, H., T.M. Blackburn, E.E. Dyer, P. Genovesi, P.E. Hulme, J.M. Jeschke, S. Pagad, P. Pysek, M. Winter, M. Arianoutsou, S. Bacher, B. Blasius, G. Brundu, C. Capinha, L. Celesti-Grapow, W. Dawson, S. Dullinger, N. Fuentes, H. Jäger, J. Kartesz, M. Kenis, H. Kreft, I. Kühn, B. Lenzner, A. Liebhold, A. Mosena, D. Moser, M. Nishino, D. Pearman, J. Pergl, W. Rabitsch, J. Rojas-Sandoval, A. Roques, S. Rorke, S. Rossinelli, H.E. Roy, R. Scalera, S. Schindler, K. Stajerova, B. Tokarska-Guzik, M. van Kleunen, K. Walker, P. Weigelt, T. Yamanaka, F. Essl, 2017: No saturation in the accumulation of alien species worldwide. Nature Communications 8, 1-9.
Simko, B., 1982: Douglas-fir. Needle Midge... Determining a Spray Schedule Through Use of a Midge Trap. Ornamentals Northwest Archives 6 (1), 8-10. http://horticulture.oregonstate.edu/system/files/onn060108.pdf (Stand: 06.07.2017).
Skuhrava, M., V. Skuhravy, 2009: Species richness of gall midges (Diptera: Cecidomyiidae) in Europe (West Palaearctic): biogeography and coevolution with host plants. Acta Societatis Zoologicae Bohemicae 73, 87-156.
Skuhrava, M., V. Skuhravy, G. Csoka, 2007: The invasive spread of the gall midge Obolodiplosis robiniae in Europe. Cecidology 22, 84-90.
Spellmann, H., A. Bolte, T. Vor, A. Michel, O. Schmidt, W. Schmidt, C. Ammer, 2015a: A – Allgemeiner Teil. Zielsetzung, Definitionen, Bewertung. In: Vor, T., H. Spellmann, A. Bolte, C. Ammer [Hrsg.], 2015: Potenziale und Risiken eingeführter Baumarten. Göttinger Forstwissenschaften 7, Göttingen, Universitätsverlag, 1-26.
Spellmann, H., A. Weller, P. Brang, H.-G. Michiels, A. Bolte, 2015b: Douglasie (Pseudotsuga menziesii (Mirb.) Franco). In: Vor, T., H. Spellmann, A. Bolte, C. Ammer [Hrsg.]: Potenziale und Risiken eingeführter Baumarten. Göttinger Forstwissenschaften 7, Göttingen, Universitätsverlag, 187-217.
Vor, T., H. Spellmann, A. Bolte, C. Ammer [Hrsg.], 2015: Potenziale und Risiken eingeführter Baumarten. Göttinger Forstwissenschaften 7, Göttingen, Universitätsverlag, 296 S.
Walther, G.-R., A. Roques, P.E. Hulme, M.T. Sykes, P. Pysek, I. Kühn, M. Zobel, 2009: Alien species in a warmer world: risks and opportunities. Trends in Ecology and Evolution 24, 686-693.
Wimmer, E., 1935: Auftreten der Douglasienlaus im südwestdeutschen Walde. Anzeiger für Schädlingskunde 11, 61-63.
Wingfield, M.J., E.G. Brockerhoff, B.D. Wingfield, B. Slippers, 2015: Planted forest health: The need for a global strategy. Science 349, 832-836.