

Einfluss perennierender und annueller Fruchtarten auf Arthropodengesellschaften – Dynamik und Triebkräfte in Agrar-Ökosystemen
Impact of perennial and anual crops on arthropod communities – dynamics and driving forces within agro – ecosystems
Journal für Kulturpflanzen, 70 (9). S. 273–290, 2018, ISSN 1867-0911, DOI: 10.1399/JfK.2018.09.01, Verlag Eugen Ulmer KG, Stuttgart
Untersuchungen mit Bodenfallen zum Einfluss der Kulturarten auf die Dynamik von Arthropodengesellschaften werden vorgestellt. Sie betreffen vier perennierende Kulturen (extensives Grünland, Chinaschilf und die Baumarten Pappel und Weide) sowie die Wintergerste als annuelle Frucht. Die Kulturarten prägten die Diversität (Shannon-Weaver-Index) der Arthropodengesellschaften, wobei die Diversität der Baumkulturen statistisch meist von der Diversität in den Ackerbaukulturen unterschieden war. Dieser Befund war auf zeitliche Änderungen im Artenbestand (Artenidentität) sowie der Artendominanz (Dominanzidentität) zurück zu führen und belegt eine hohe Dynamik des Arthropodenauftretens innerhalb und zwischen den Kulturen. Über die Kulturarten werden zeitlich und örtlich getrennte Teilpopulationen ausgebildet. Mögliche Triebkräfte für die Anpassung der Arthropodengesellschaften an die Fruchtarten wurden über die Erfassung des Energiestatus der Anbausysteme analysiert. Grundlage waren Bewirtschaftungsdaten, die Pflanzenerträge sowie begleitende Informationen zum Anfall von Biomasse. Die Kennzahl „landwirtschaftlicher Energiegewinn“ fasst diese Einflüsse auf energetischer Ebene zusammen. Der Rückfluss von Biomasse in das Anbausystem wurde als „ökosystemarer Energiegewinn“ beschrieben. Beide Parameter beschreiben das Auftreten der Arthropoden in den Kulturen. Ansteigender landwirtschaftlicher Energiegewinn wirkte sich negativ aus, ökosystemarer Energiegewinn bewirkte das Gegenteil. Weiterhin konnte eine Zuordnung der Arthropoden in funktionale Gruppen die Arten- und Dominanzunterschiede der Arthropodengemeinschaften in den Kulturen erklären. Sie beruhen auf der Notwendigkeit der Energiedissipation und berühren den Energiefluss über die Trophiestufen. Die Stellung der Arthropodenarten im Nahrungsnetz wird modifiziert. Aus den Befunden ist ersichtlich, dass Energie basierte Daten Hinweise auf den Biodiversitätsstatus der Anbausysteme geben. Sie können Grundlage für die Ableitung indirekter Status- und Wirkungsindikatoren sein. Daneben fördern die Befunde das Verständnis über Ökosystemprozesse und zu den Inhalten des Begriffes „Intensität“ im Kontext der Bewertung ökologischer Nachhaltigkeit.
Stichwörter: perennierende und annuelle Fruchtarten, Arthropodengesellschaft, Assoziationen, Populationsdynamik, Energiegewinn, Energieinput, Intensität, Nahrungsnetz, ökologische Nachhaltigkeit
Investigations with pitfall traps into the influence of crop species on the dynamics of arthropod communities are presented. They included four perennial crops (extensive grassland, miscanthus and poplar and willow tree species) as well as winter barley as annual crop. The cultivars determined the diversity (Shannon-Weaver-Index) of arthropod communities, whereby the diversity of the tree species was mostly statistically different from the diversity in agricultural crops. This finding was due to temporal changes in the species stock (species identity) and the species dominance (dominance identity) and demonstrates high dynamics of arthropod presence within and between crops. The crop species lead to temporally and locally separated metapopulations. Possible driving forces stimulating the adaptation of arthropod communities to crops were analyzed by recording the energy status of the cropping systems. It was based on management data, plant yields and accompanying information about biomass accumulation. The term “agricultural energy gain” summarizes these influences on the energy level. The return of biomass to the cultivation system was described as “ecosystem energy gain”. Both parameters elucidate the arthropod presence within the crops. Increasing agricultural energy gain was negatively related in contrast to the energy gain of the entire ecosystem. Furthermore, the splitting of arthropods into functional groups helped to explain the species and dominance variation of arthropod communities between crops. This is based on the need for energy dissipation and influences the energy flow across trophic levels. The position of arthropod species within the food web gets modified. The results show that energy-based data serve to evaluate the biodiversity status of cropping systems. They can be the basis for derivation of indirect status or impact indicators. In addition, the findings promote the understanding of ecosystem processes and the meaning of “intensity” in the context of ecologically sustainable land use.
Key words: perennial and annual crops, Arthropod community, associations, population dynamics, energy gain, energy input, intensity, food web, environmental sustainability
Interaktionen zwischen Landnutzung und Biodiversität sind in den letzten Jahren stark in das Blickfeld der Umweltforschung gerückt. Allerdings ist „Biodiversität“ ein eher politisch getragener Begriff der inhaltlich wissenschaftlich allumfassend ist (Hoffmann, 2006). Daher sind Biodiversitätsforschungen sehr vielgestaltig und widmen sich Themen wie der Bestandsaufnahme von Arten und Lebensräumen (Schlumprecht, 2000; Osterburg, 2006; Beaufoy, 2009; EEA, 2013) oder dem Einfluss der Landschaftsstruktur auf das Artenauftreten (Hoffmann und Greef, 2000; Walz, 2004). Der Informationsumfang zu diesen Themen ist immens, weil sich Untersuchungsergebnisse durch die Betrachtungen unterschiedlicher Arten- oder Artengruppen sowie verschiedener Betrachtungsebenen (Habitat, Boden, Natur- oder Landnutzungsfläche, Landschaft oder Betriebsflächen) vervielfachen. Aus den Biodiversitätsinhalten leitet sich ein weiterer Forschungsansatz ab. Er widmet sich Fragen der Beziehungen zwischen den Arten sowie der biotischen- und abiotischen Umwelt und ihrer Modifikationen durch landnutzungsbedingte Eingriffe. Diese Forschungen bilden die Grundlage zur Einschätzung des Verhaltens von (Agrar-) Ökosystemen, z.B. in Hinsicht auf ihre Produktivität, Stabilität, Resilienz oder der Bedeutung der Biodiversität (als Artengemeinschaften) für die Realisierung von Ökosystemfunktionen. Eingebettet in diese Untersuchungen steht oft die Frage nach einer Zustandsbewertung von Nutz- Ökosystemen, wobei die Bedeutung und Anwendung von Indikatoren zur Sprache kommt (Oppermann et al., 2000; Siebrecht und Hülsbergen, 2008; Neumann und Dierking, 2014). Aus der Differenzierung der Forschungsansätze wird deutlich, dass unterschiedliche Zielsetzungen bedient werden und Indikatoren nicht generell auf andere Sachbezüge übertragbar sind (Heyer und Christen, 2004b, Duelli und Obrist, 2003). So ist für eine Beurteilung der ökologischen Nachhaltigkeit landwirtschaftlicher Anbausysteme eine funktionale Sichtweise auf „Biodiversität“ unverzichtbar, weil eine von Arten getragene funktionale Diversität Ökosystemprozesse (Kinzing et al., 2002; Anderson, 2018) stützt. Diese Sichtweise widerspiegelt sich auch in inhaltlich analogen Begriffen des Naturhaushaltes, Ökosystemdienst- oder Gratisleistungen sowie Ökosystemservice. In diesem Kontext untersucht vorliegende Arbeit zunächst die Assoziation von Arthropodengemeinschaften mit perennierenden und annuellen Kulturen und analysiert in einem zweiten Schritt mögliche Triebkräfte, die zur Anpassung der Lebensgemeinschaften an Landnutzungssysteme führen und fachliche Grundlage für das Verständnis von Ökosystemprozessen und die Ableitung von Indikatoren zur Bewertung einer ökologischen Nachhaltigkeit sein können.
Die Untersuchungen erfolgten am Standort Bad Lauchstädt. Standortcharakteristika können aus Altermann et al. (2005) entnommen werden. Innerhalb einer als „Energiepark“ angelegten Versuchsanlage (Freydank, 2007) wurden in vier Parzellen mit perennierenden Pflanzenarten und eine Fläche mit annuellen Fruchtarten jeweils 5 Bodenfallen aufgebaut und über 9 Fangserien im Jahr 2009 fängig gestellt (Deter, 2011). Die Leerungstermine der Fangserien waren: 08.04.2009 Termin 1, 08.05.2009 Termin 2, 08.06.2009 Termin 3, 08.07.2009 Termin 4, 08.08.2009 Termin 5, 08.09.2009 Termin 6, 08.10.2009 Termin 7, 08.11.2009 Termin 8 und 08.12.2009 Termin 9. Einbezogene Kulturen sowie ihre Bewirtschaftungsdaten können der Tab. 1 entnommen werden. Die Größe der im Versuch beprobten Teilparzellen betrug 720 m². Die Fänge wurden in ihrer Gesamtheit ausgewertet, wobei Laufkäfer und Webespinnen weitgehend bis zur Art bestimmt wurden. Zweifelsfälle wurden als „morphologische Art“ registriert. Kurzflügelkäfer wurden (mit Ausnahme gut kenntlicher Arten) bis zur Ordnung bzw. Unterfamilie determiniert. Neben den angeführten Arthropoden fanden sich zahlreiche „Beifänge“, insbesondere Collembolen und Asseln, weiterhin auch Vertreter nicht epigäischer Lebensweisen. Letzteres betraf verschiedene Käferfamilien, Blattläuse, Zikaden, Zweiflügler und parasitische Wespen. Angeführte Gruppen wurden als Individuenanzahl der Familie (z.B. Marienkäfer, Schnellkäfer), Überfamilie (z.B. Blattläuse, Erzwespen) oder auch Unterordnung (Zikaden, Fliegen, Mücken) zugeordnet. Die Dynamik des Arthropodenauftretens wurde mittels biologischer Kennwerte charakterisiert, der Diversität (Shannon-Weaver-Index), der Artenidentität (Jaccard-Index) sowie der Dominanzidentität (Renkonen-Index) (Soutwood, 1987). Weiterhin wurden die Diversitätsdifferenzen zwischen den Fangserien und Kulturarten einer statistischen Bewertung nach Macarthur (1965) und Poole (1974) unterzogen. Zur Erfassung der ökologischen Hintergründe der Populationsdynamiken erfolgte eine Zuordnung der Arthropoden zu funktionalen Gruppen (vergl. Tab. 3). Sie repräsentieren hauptsächlich das Nahrungsnetz von den Destruenten über Phytophaga (Primärkonsumenten) zu den räuberisch bzw. parasitisch lebenden Sekundärkonsumenten. Die Produzentenebene wurde über den Eintrag von Biomasse bzw. entsprechender energetischer Kennzahlen beschrieben. Der Energieinput fasst in Tab. 1 aufgeführte anthropogene Störungen (Agrotechnische und agrochemische Maßnahmen) auf energetischer Ebene zusammen. Die Energiebindung entspricht der in der Biomasse (Ertrag) gebundenen Energie als vergleichbarer Wert für die unterschiedlichen Ernteprodukte. Energiegewinn (Landwirtschaft) berechnet sich aus der Energiebindung abzüglich des Energieaufwandes für die Bewirtschaftung bzw. Pflege (Energieinput) und der Energiegewinn (Ökosystem) ergibt sich aus der im Ökosystem verbleibenden Biomasse, z.B. Mulchmaterial (GL), Ernte und Wurzelrückstände (z.B. G/R, Misc) oder entspricht der Energiebindung im System, wenn keine Abfuhr von Biomasse erfolgte (Pap, Weide Ernte im 6. Jahr). Die Berechnung der energetischen Kennzahlen basiert auf versuchsbegleitenden Stichproben zum Anfall von Biomasse auf dem Boden (Baumkulturen und Chinaschilf) (vergl. Abb. 8), auf Angaben von Freydank (2007) zu den Erträgen der Baumkulturen bzw. Deter (2011) zu den Ertragsleistungen der Gerste und des Grünlands (vergl. Tab. 1), sowie auf REPRO – Berechnungen (Ackerland, Grünland) (Hülsbergen et al., 2001), denen KTBL – Daten der Bewirtschaftungsverfahren hinterlegt sind und die auf Energieäquivalente für biogene Energieträger und landwirtschaftliche Inputs (Düngemittel, Pflanzenschutzmittel, Maschineneinsatz) zurückgreifen. Sie sind ebenfalls bei Rathke und Diepenbrock, 2003 sowie Deike et al., 2008 dokumentiert. Über die Arbeitshypothese, dass Energieflüsse die Abundanz und Diversität der Arthropodengemeinschaften beeinflussen und Triebkraft ihrer Dynamiken sind, wurden die abiotischen und biotischen Datengrundlagen für die Versuchsauswertung zusammengeführt.
Tab. 1. Fruchtarten, Bewirtschaftung sowie Biomasseerträge und energetische Kennzahlen der Anbausysteme
Fruchtart bzw. Kultur/ | Agrotechnische Maßnahmen | Agrochemische Maßnahmen | Biomasseertrag/ |
Parzelle G/R | |||
Wintergerste, Hordeum vulgare L. | Innerhalb dreigliedriger Fruchtfolge, Triticale, Wintergerste, Winterraps | Grunddüngung 5.3.: | Biomasse: 90 dt Korn, 43 dt Stroh/ha |
Raps, | Schwergrubber: 11.8. Pflugkombination: 21.8. | Herbizid: 27.8.2009, 3 l/ha | Biomasse: 47 dt Korn, |
Parzelle GL |
|
|
|
Extensive Wiese | Zweischnittnutzung | ohne | Biomasse: 67,4 dt/ha (FM Gesamt) |
Parzelle Misc |
|
|
|
Chinaschilf, | Pflanzung: 2000 | Grunddüngung 18.3.: | Biomasse: 994 dt/ha |
Parzelle Pap |
|
|
|
Schwarzpappel, | Pflanzung: 2000 | Grunddüngung 18.3.: | Biomasse: 495 dt/ha nach 6 Jahren |
Parzelle Weide |
|
| |
Weide, | Pflanzung: 2000 | Grunddüngung 18.3.: | Biomasse: 545 dt/ha nach 6 Jahren |
Tab. 3. Einordnung der Arthropodenfänge nach ihrer Ökosystemfunktion als Individuenanzahl
Funktion | G/R | Pap | Misc | GL | Weide | Gesamt |
Bestäuber | 2 | 2 | 5 | 2 |
| 11 |
Destruenten | 1912 | 2508 | 1060 | 1624 | 1886 | 8990 |
Phytophage | 256 | 789 | 381 | 695 | 613 | 2820 |
Räuber | 973 | 724 | 713 | 1076 | 1001 | 4487 |
Parasit/Parasitoid | 243 | 184 | 95 | 108 | 239 | 869 |
Schädlingsförderer | 151 | 892 | 327 | 5431 | 1272 | 8073 |
Anmerkung: Die tatsächliche funktionale Struktur ist oft komplexer, so dass Arten verschiedene Funktionen erfüllen können. Die Tabelle orientiert auf bekannte Hauptfunktionen der Arten. | ||||||
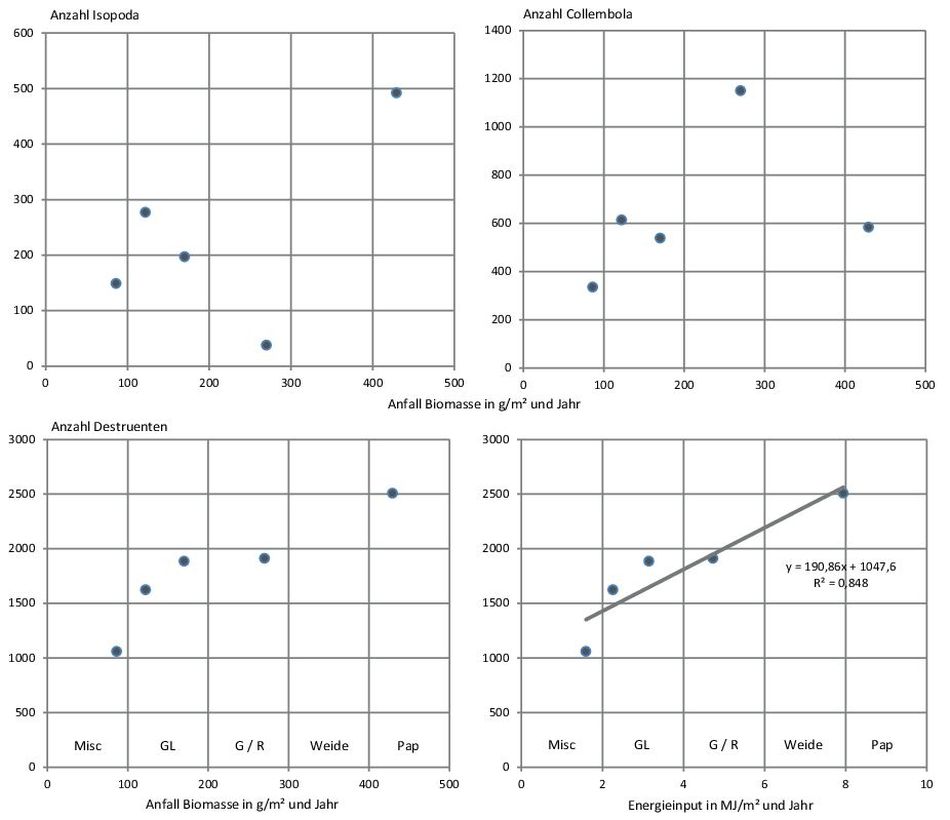
Abb. 8. Zusammenhang zwischen der Menge anfallender Biomasse und der Anzahl gefangener Asseln (Isopoda) (A), Springschwänze (Collembola) (B) und der Gesamtanzahl Destruenten (C) bzw. des Energiegehaltes der Biomasse und der Anzahl aller in den Fruchtarten bzw. Kulturen auftretenden Destruenten (D).
Mit der Abb. 1 sind die Dynamiken der Individuenanzahl als auch des Artenauftretens über die Untersuchungszeit in den Kulturen verdeutlicht. Aus der Darstellung ergeben sich einige wichtige Hinweise. Klar ist allgemein, dass über die Vegetationszeit eine Zu- und spätere Abnahme der Individuen- und Artenzahlen zu erwarten war. Für die Individuenzahlen stellten sich in den Kulturen jedoch erhebliche Unterschiede in der Abundanz ein. Die Fangzahlen waren insbesondere auf dem Grünland sehr hoch. Hohe Abundanzen zeigten sich auch in den Baumkulturen Pappel und Weide. Auffällig ist jedoch, dass die Abundanzmaxima über die untersuchten Fruchtarten zeitlich differenziert waren. Sie liegen bei Gerste/Raps (G/R) früher und zeigen ein zweites Maximum. Es folgen am dritten Fangtermin Grünland (GL) und Pappel (Pap), dann die Baumart Weide und Miscantus (Misc) im fünften Fangzeitraum. In Bezug auf das Arten bzw. Artengruppenauftreten sind die Kurvenverläufe über die Zeit für die Fruchtarten weniger differenziert. Ihre Anzahl lag für die Einzelkultur meist im Bereich zwischen 20 und 40. In der Summe aller Fruchtarten- bzw. Kulturen ergab sich allerdings eine Spannweite zwischen ca. 40 und 60 auftretenden Arten bzw. Artengruppen zu den Hauptfangzeiten, d.h. das Artenspektrum war in den Frucht- bzw. Kulturarten nur zum Teil identisch und erhöht sich in der Gesamtschau der Fruchtarten erheblich. Angesprochene Unterschiede können durch den Shannon – Weaver – Index genauer interpretiert werden, denn er berechnet sich aus der Artenanzahl und der Individuenanzahl der Arten (Dominanzidentität). Mit der Abb. 2 wird die Variabilität des Diversitätsindex über die Zeit, aber auch im Vergleich der Frucht- bzw. Kulturarten aufgezeigt. Innerhalb der Fruchtarten ergaben sich erhebliche Unterschiede im Diversitätsindex in Abhängigkeit von den Fangterminen. Die Fangtermine mit dem höchsten und niedrigsten Index sind ebenfalls aus der Abb. 2 zu entnehmen. Der niedrigste Index trat hauptsächlich z.Z. der 2. Fangperiode auf. Die Maxima zeigten eine größere zeitliche Variabilität. Im Vergleich der Fruchtarten ergab sich eine stärkere Variabilität zwischen den Gerste/Raps (G/R) und Grünlandflächen (GL) zu den anderen Kulturen. Letztere waren über die Zeit in ihrer Diversitätsausstattung stabiler. Auch hier war in der Summe der Kulturen der Diversitätsindex am höchsten. Mit der Tab. 2 wird Auskunft gegeben, ob die zwischen den Fruchtarten bzw. Kulturen in Abb. 2 ersichtlichen Unterschiede in der Diversitätsausstattung auch statistisch erheblich sind. Auf Grundlage der statistischen Bewertung der Diversitätsdifferenz zeigt sich, dass die Arthropodengesellschaften besonders in den Fangperioden 3 bis 6 häufiger signifikant verschieden waren. Am häufigsten hob sich die Diversität in Gerste/Raps (G/R) (36 Fälle) von den übrigen Kulturen ab. Auch die Gemeinschaften des Grünlandes zeigten oft statistisch gesicherte Diversitätsdifferenzen zu den anderen Fruchtarten und Kulturen (30 Fälle). Eine geringere Häufigkeit statistischer Unterschiede ergab sich für die Weidenkultur (19 Fälle). In Bezug auf die Gesamtfänge waren diese in 28 Fällen von der Diversität der Einzelkulturen signifikant zu differenzieren. Zum besseren Verständnis der Hintergründe benannter Diversitätsunterschiede wurden zusätzlich der Jaccard- und Renkonen-Index berechnet. Beide Kennzahlen verdeutlichen die prozentuale Übereinstimmung in der Artenanzahl bzw. der Wahrscheinlichkeit ihrer Präsenz (Dominanzanteil der Arten) in den Fruchtarten bzw. Kulturen. In der Abb. 3 sind beide Kennzahlen gemeinschaftlich dargestellt. Der Jaccard-Index bewegt sich als Mittelwert in einem Bereich von ca. 45–55% bei Betrachtung der Einzelkulturen sowie der Gesamtfänge. Allein ergeben die Mittelwerte allerdings ein unvollständiges Bild von der Dynamik des Artenauftretens, weil die Spannweite der Jaccard-Zahl über den Fangzeitraum sehr erheblich ist. Sie bewegt sich zwischen ca. 28–72% Artenübereinstimmung. Gleichzeitig macht Abb. 3 darauf aufmerksam, dass sich die in den Fruchtarten bzw. Kulturen auftretenden Arthropodengesellschaften nicht allein im Artenauftreten differenzieren, sondern ihre Dynamik ebenfalls aus Dominanzverschiebungen zwischen den Arten entsteht. Dieser Prozess ist z.T. stärker ausgeprägt als die Wirkung der Kulturen auf das Artenspektrum, denn es ergaben sich für den untersuchten Zeitverlauf Spannweiten des Renkonen-Index zwischen 18 bis 85%. Damit stellt sich die Frage, wie stark die einzelnen Fruchtarten bzw. Kulturen die Anteile ausgewählter Arthropodengesellschaften an den Fängen als Mittelwert und Spannweite über den Untersuchungszeitraum variieren. Ausgewählt wurden Insekten (Laufkäfer und Kurzflügelkäfer) sowie Spinnen (Webespinnen, Weberknechte) und Krebstiere (Asseln). Es sind Vertreter epigäisch lebender Arthropoden, deren Auftreten mit Bodenfallen gut zu erfassen ist. Mit Abb. 4 wird die Variabilität des Auftretens von sechs Laufkäfergattungen unter dem Einfluss der Fruchtarten bzw. Kulturen veranschaulicht. Allgemein waren Laufkäfer der Gattung Harpalus und Pterostichus in den Fängen häufiger vertreten als Käfer der weiteren dargestellten Gattungen. Sie erlangten Dominanzanteile bis über 7%, allerdings in unterschiedlichen Kulturen. In Grünland (GL) Harpalus- und Chinaschilf (Misc) Pterostichus-Arten. Amara-Arten waren auf dem Acker (G/R), dem Grünland (GL) sowie der Baumart Weide bei hoher zeitlicher Abhängigkeit häufiger in den Fängen vertreten. Schwerpunkt im Auftreten der Carabus-Arten war Chinaschilf. Bei den Trechus-Arten ergab sich eine Konzentration bei Ackerbaufrüchten (G/R) und Vertreter der Gattung Nebria waren auf den Pappelstandort konzentriert und traten im Chinaschilf nicht auf. Mit Ausnahme der letztgenannten Gattung waren alle aufgeführten Laufkäfergattungen in jeder Kultur präsent. Mit Abb. 5 ist das Auftreten ausgewählter Kurzflügelkäfer (Unterfamilien Aleocharinae, Omalinae, Oxytelinae) sowie ausgewählter Gattungen (Xantholinus, Leptacinus, Tachyporus sowie Philonthus, Quedius, Ocypus) im Versuch verdeutlicht. In der Pappelkultur waren Käfer der Gattungen Xantholinus und Leptacinus sowie ebenfalls Philonthus, Quedius und Ocypus in starker Abhängigkeit vom Fangzeitpunkt häufiger zu finden. Die Aleocharinae waren im Chinaschilf und Pappel häufig, die Omalinae in Chinaschilf und Weide. Letztere waren im Ackerbau (G/R) und Grünland (GL) kaum zu finden. Tachyporus-Arten waren in höherer Anzahl im Chinaschilf präsent. Bis auf die benannten Ausnahmen, zeigt sich für die ausgewählten Kurzflügelkäfergemeinschaften ebenfalls, dass sie in allen Kulturen vertreten waren. Die Präsenz ausgewählter Webespinnenfamilien und der Weberknechte verdeutlicht Abb. 6. Auch für diese Arthropoden zeigt sich eine ausgeprägte Dynamik ihres Auftretens über die Zeit (Spannweite der Fänge) und im Vergleich der Fruchtarten bzw. Baumkulturen. Baldachinspinnen (Lyniphiidae) waren häufiger auf dem Ackerstandort (G/R) anzutreffen, Wolfsspinnen (Lycosidae) im Chinaschilf (Misc). Glattbauchspinnen (Gnaphosidae) fanden sich in höherer Anzahl bei Grünlandnutzung (GL) des Standortes, während Weberknechte (Opiliones) verstärkt in den Baumkulturen auftraten und auf Acker- und Grünland nur selten zu finden waren. Daneben zeigt Abb. 6 auch, dass die benannten Bindungen der Spinnenfamilien an die Fruchtarten und Kulturen nicht ausschließlich sind, denn Webespinnen und Weberknechte traten mehr oder weniger häufig in allen Fruchtarten auf. Abbildung 7 gibt einen Einblick in die Abhängigkeit des Auftretens weiterer ausgewählter Arthropoden von den Kulturen. Fliegen (Brachycera) und Springschwänze (Collembola) fanden sich überdurchschnittlich häufig bei Ackerbewirtschaftung (G/R); Schnellkäfer (Elateridae) auf dem Grünland und Asseln (Isopoda) bei Pappelanbau. Ihr Auftreten in den genannten Kulturen ist jedoch ebenfalls nicht ausschließlich, denn die aufgeführten Arthropoden fanden sich ebenfalls in den anderen Kulturen und erreichten dort z.T. erhebliche Fanganteile (z.B. Brachycera). Wegen der vorstehenden Resultate stellt sich die Frage nach den Ursachen der zeitlichen und an die Kulturarten gebundenen Dynamik, also nach Zusammenhängen zwischen der Art der Landnutzung und der Präsenz von Arthropoden. Die Analyse der Ursache-Wirkung-Beziehungen erfolgte über die Zuordnung der Arthropoden zu ihren funktionalen Leistungen im Ökosystem, was Tab. 3 verdeutlicht. Aufgeführt sind sechs Ökosystemdienstleistungen, die von Arten bzw. Artengruppen zur Aufrechterhaltung des Naturkreislaufes erbracht werden. Blütenbestäuber wurden auf Grund der verwendeten Methodik nur marginal erfasst und ihre Anzahl war für weitere Analysen ungeeignet. Für Agrar-Ökosysteme sind Leistungen der Destruenten von besonderer Bedeutung. Sie mineralisieren organische Substanz und stellen über diesen Abbauprozess Pflanzennährstoffe bereit. Mit der Abb. 8 wird ersichtlich, dass das Auftreten aller Destruentengruppen sehr deutlich vom Anfall organischen Materials bzw. dessen Energiegehalt beeinflusst wird (Abb. 8C, D) denn trotz geringem Stichprobenumfang erweist sich der Zusammenhang als gesichert (α = 10%). Auf Ebene einzelner Gruppen (Ordnungen) stellt sich dieser Zusammenhang hingegen nicht ein (Abb. 8A, B), weil die mit Gerste bzw. Winterraps (G/R) bestellte Fläche aus dem Gesamtbild fällt. Dort spielen Asseln als Destruenten eine geringere Rolle wohingegen die Bedeutung der Collembolen für die angesprochene Ökosystemleistung steigt, d.h. es ergeben sich Dominanzverschiebungen zwischen den Arthropodengesellschaften als funktionale Anpassung des Ökosystems an den jeweiligen Lebensraum bzw. der Qualität der umzusetzenden Biomasse. Unter Phytophaga sind herbivore Arthropoden gruppiert, die sich von lebendem Pflanzenmaterial ernähren. Die Gruppe umschließt Käferfamilien (Blattkäfer, Blatthornkäfer, Schnellkäfer, Rüsselkäfer), Hemiptera (Pflanzenläuse, Zikaden) sowie Heteroptera (Wanzen). Aus biologischer Sicht Arten der 1. Trophieebene bzw. Primärkonsumenten. Aus landwirtschaftlicher Sicht Schadinsekten. Abb. 9 verdeutlicht den Einfluss der Fruchtarten bzw. Kultur auf das Auftreten phytophager Insekten auf Grundlage der im jeweiligen Pflanzenaufwuchs gebundenen Energie. Letzteres entspricht der Leistung der Pflanzenbestände als Primärproduzenten im Nahrungsnetz des Versuches. Demnach bindet Chinaschilf (Misc) die höchste Energiemenge bezogen auf eine Vegetationszeit, gefolgt von Gerste/Raps (G/R). Geringere Energiemengen werden über die Baumkulturen und aus dem extensiven Grünland bereitgestellt. Auf diesen Energiegradienten reagiert die Abundanz der Primärkonsumenten deutlich in negativer Richtung. Dies wird insofern verständlich, weil die Arten direkt an den Pflanzenbestand gebunden sind und die aufgezeigte Energiemenge dem System zur Erntezeit entnommen wird (G/R, Misc). Zugleich war die Seneszenz der Pflanzenbestände unterschiedlich, so dass sich Abundanzmaxima zu unterschiedlichen Vegetationszeiten einstellten, von April (G/R) über Juni (GL) bis August (Weide) (Abb. 9). Mit Abb. 10 wird ersichtlich, dass sich bereits beschriebene Einflüsse der Kulturen auf das Auftreten von Destruenten und Phytophaga über das Nahrungsnetz auf Sekundärkonsumenten auswirkt. Nach landwirtschaftlichem Verständnis handelt es sich hierbei um Arthropoden, die auf das Auftreten der Primärkonsumenten Einfluss nehmen können (Nützlinge). Es wird verdeutlicht, wie das unterschiedliche Auftreten der Collembolen als Destruenten in den Fruchtarten bzw. Kulturen auf Sekundärkonsumenten rückwirkt. Dargestellt ist die Laufkäferart Loricera pilicornis (Abb. 10A) sowie die Familie der Baldachinspinnen (Linyphiidae) (Abb. 10B). Das Auftreten des räuberischen Laufkäfers L. pilicornis wurde erheblich über die Anzahl der Nahrungstiere (Collembolen) differenziert. Ebenso war die Abundanz der Baldachinspinnen vom Auftreten der Springschwänze abhängig. Das Signifikanzniveau lag bei α = 0,05. Mit der Abb. 11 wird verdeutlicht, dass die Abundanz von Sekundärkonsumenten räuberischer Lebensweise (Prädatoren) ebenfalls über die Individuenanzahl phytophager Arthropoden (Primärkonsumenten) beeinflusst wurde. Unter Bezug auf alle Fruchtarten bzw. Kulturen kann (Abb. 11A) davon ausgegangen werden, dass die Variation des Auftretens räuberischer Artengruppen zu ca. 40% (α = 0,05) von der Anwesenheit der Beuteinsekten (Primärkonsumenten) abhängt. Für die Fruchtart Gerste (G/R) erwies sich die Abhängigkeit zwischen Raub- und Beuteinsekten unter erhöhtem Signifikanzniveau (α = 0,005) als noch wesentlich stärker (Abb. 11B). Phytophage Insektengruppen werden ebenfalls von Parasiten/Parasitoiden als Nahrung genutzt. Aus den Versuchsdaten ließ sich nachweisen, dass die Abundanz der Sekundärkonsumenten parasitischer Lebensweisen ebenfalls über das Beuteangebot in den Fruchtarten bzw. Kulturen geregelt wird. Darauf macht Abb. 12 aufmerksam. Die dargestellte Parasitoid-Beute-Relation beruht auf den Daten aller Flächen über den Versuchszeitraum und erreicht ein Signifikanzniveau von α = 0,005 (Abb. 12A). Dieser statistische Zusammenhang ließ sich für die einzelnen Fruchtarten bzw. Kulturen nicht bestätigen, weil eine deutlich Zeitverschiebung durch die Dichterückkopplung zwischen Wirt und Parasit/Parasitoid auftrat. Darauf verweisen beispielhaft die mit Abb. 12B dargestellten Abundanzkurven der Phytophagen und Parasitoiden. Ein synchroner Kurvenverlauf zwischen beiden Gruppen stellte sich erst nach dem dritten Fangzeitraum ein. Vorstehende Abbildungen und Aussagen verdeutlichten die Systemrückkopplung zwischen den Trophieebenen. Dieser Prozess ist Ausdruck des Energieflusses bzw. der Energiedissipation in den untersuchten Anbausystemen. Mit der Abb. 13 wird nachgefragt, ob energetische Beschreibungen der Anbausysteme auch Einflüsse auf die Arthropodenfauna erfassen. Dargestellt ist zunächst der jährliche Energiegewinn der Anbausysteme aus landwirtschaftlicher Sicht. Dabei wird offensichtlich, dass mit Anstieg des Energiegewinnes eine Reduktion der Arthropodenfauna einhergeht (Abb. 13A). Mit dem Energiegewinn für das Ökosystem wird beschrieben, welche Energiemenge nach der Entnahme des Erntegutes im Ökosystem verbleibt. Unter dieser Prämisse nimmt die Individuenanzahl der Arthropodengesellschaften zu (Abb. 13B). Letzthin widerspiegelt sich diese Abhängigkeit auch in Bezug auf die Diversität. Sowohl bei den Laufkäfern als auch den Webespinnen ergibt sich eine positiv verlaufende Tendenz. Die Bezeichnung „Funktionale Gruppen“ beinhaltet in der Tab. 3 aufgezeigte Ökosystem-Funktionen, untersetzt mit den jeweils zugeordneten Arthropoden Familien und Ordnungen. Auch nach dieser Zuordnung ergibt sich offensichtlich eine positive Entwicklung in Abhängigkeit vom ökosystemaren Energiegewinn (Abb. 13D).

Abb. 1. Individuenanzahl (links) und Anzahl der Arten bzw. Artengruppen (rechts) in den beprobten Frucht- bzw. Kulturarten über den Untersuchungszeitraum.
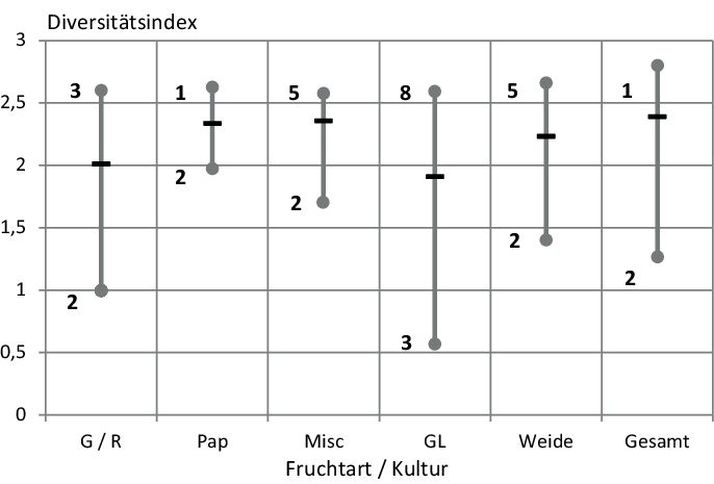
Abb. 2. Diversitätsindex nach Shannon – Weaver als Mittelwert sowie registrierte maximal/minimal Werte z.Z. der angegebenen Erhebungstermine.
Tab. 2. Signifikanz der Diversitätsdifferenzen nach Mac Arthur (1965) und Poole (1974) zwischen den Frucht- bzw. Kulturarten über die Untersuchungstermine.
Termin | G/R (a) | Pap (b) | Misc (c) | GL (d) | Weide (e) | Gesamt |
1 |
|
|
| a,b | d | a,b,c,d |
2 | a | a,b | a,b,c | a,b | a,b,c | |
3 | a | b | a,b,c | a,d | a,b,c,d,e | |
4 | a,b,c | a,b,c | b,c,d,e | |||
5 | a | a | a,b,c | a,d | a,b,d | |
6 | a | a | a,b,c | a,c,d | a,d | |
7 | a | a | a | a | a | |
8 | a | a,b | a | a,c | a,b,c | |
9 |
| a | a | b | c | a,b,c |
Gleichartige Buchstaben bedeuten signifikante Unterschiede zwischen erstgenannter Kultur zu den weiteren Kulturen und dem Gesamtauftreten der Arten und Artengruppen. | ||||||
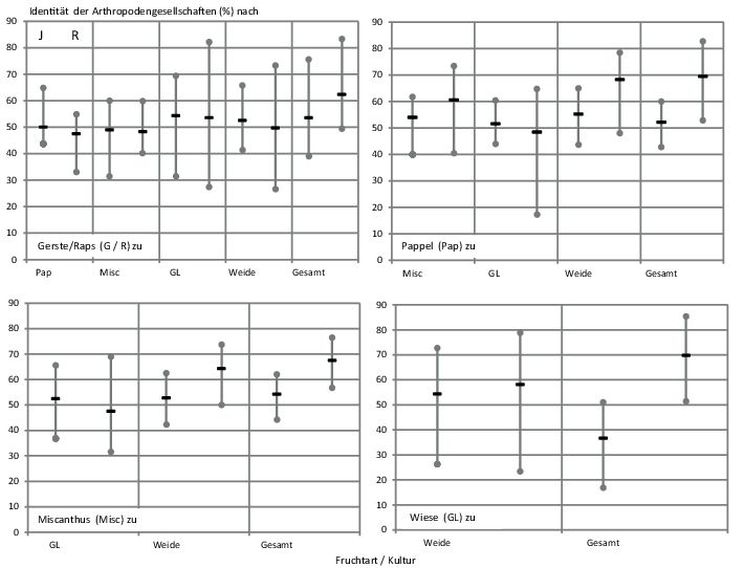
Abb. 3. Identität der Arthropodengesellschaften nach Artenidentität (Jaccard – Index, J) bzw. Dominanzidentität (Renkonen – Index R) im Vergleich der Fruchtarten bzw. Kulturen und Spannweite der Befunde über die Fangtermine.
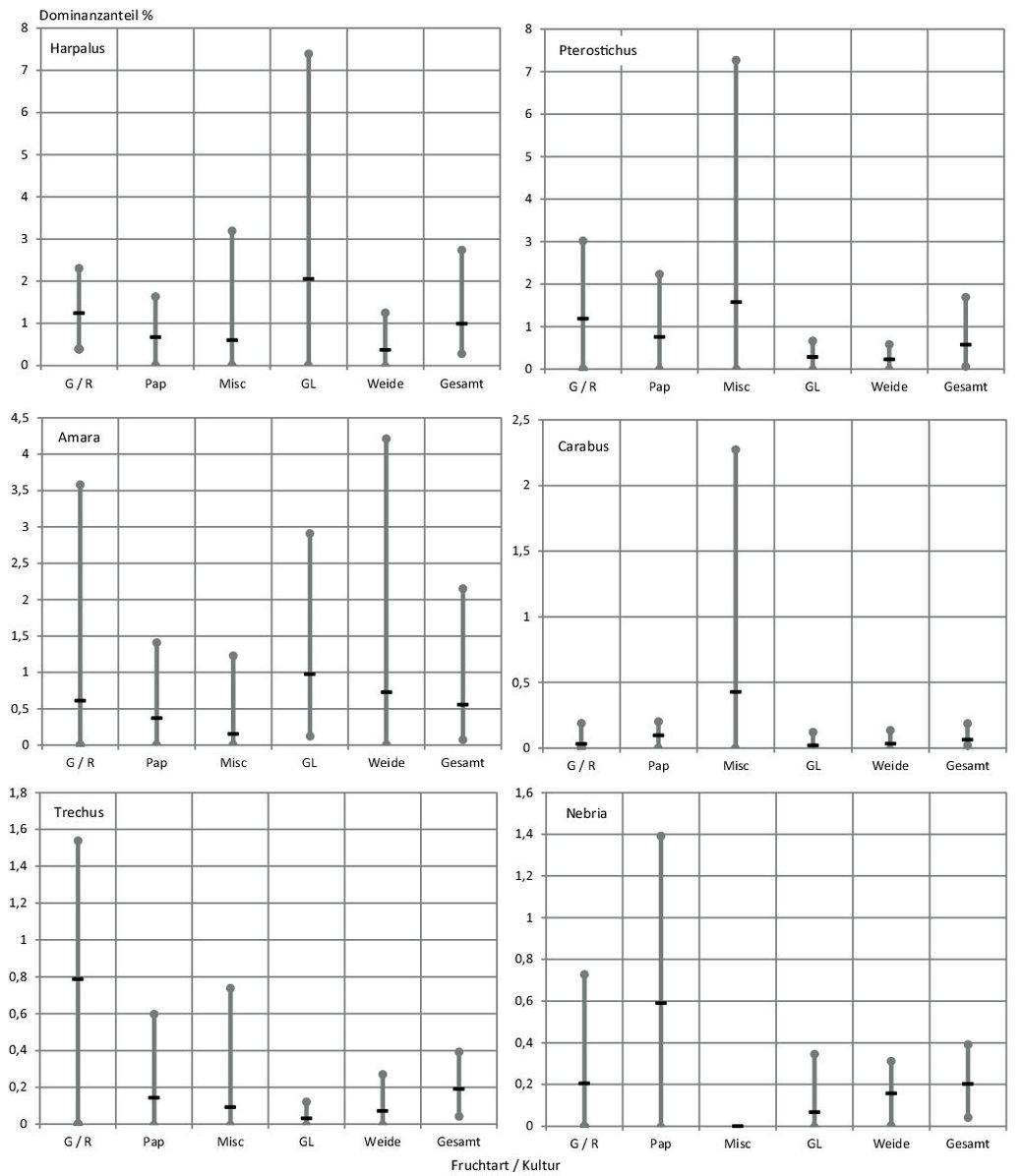
Abb. 4. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Gattungen der Laufkäfer im Vergleich der Fruchtarten bzw. Kulturen.

Abb. 5. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Unterfamilien bzw. Gattungen der Kurzflügelkäfer im Vergleich der Fruchtarten bzw. Kulturen.
![Abb. 6. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Familien der Webespinnen (Wolfsspinnen [Lycosidae], Baldachinspinnen [Linyphiidae], Glattbauchspinnen [Gnaphosidae]) sowie der Ordnung der Weberknechte (Opiliones) im Vergleich der Fruchtarten bzw. Kulturen.](bilder/jfk_2018_09_heyer_et_al_bld-006.jpg)
Abb. 6. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Familien der Webespinnen (Wolfsspinnen [Lycosidae], Baldachinspinnen [Linyphiidae], Glattbauchspinnen [Gnaphosidae]) sowie der Ordnung der Weberknechte (Opiliones) im Vergleich der Fruchtarten bzw. Kulturen.
![Abb. 7. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Artengruppen der Gliederfüßer (Arthropoda) (Fliegen [Brachycera], Schnellkäfer [Elateridae]) sowie der Springschwänze (Collembola) und Asseln (Isopoda) im Vergleich der Fruchtarten bzw. Kulturen.](bilder/jfk_2018_09_heyer_et_al_bld-007.jpg)
Abb. 7. Dominanzanteile und deren zeitliche Spannweiten für ausgewählte Artengruppen der Gliederfüßer (Arthropoda) (Fliegen [Brachycera], Schnellkäfer [Elateridae]) sowie der Springschwänze (Collembola) und Asseln (Isopoda) im Vergleich der Fruchtarten bzw. Kulturen.
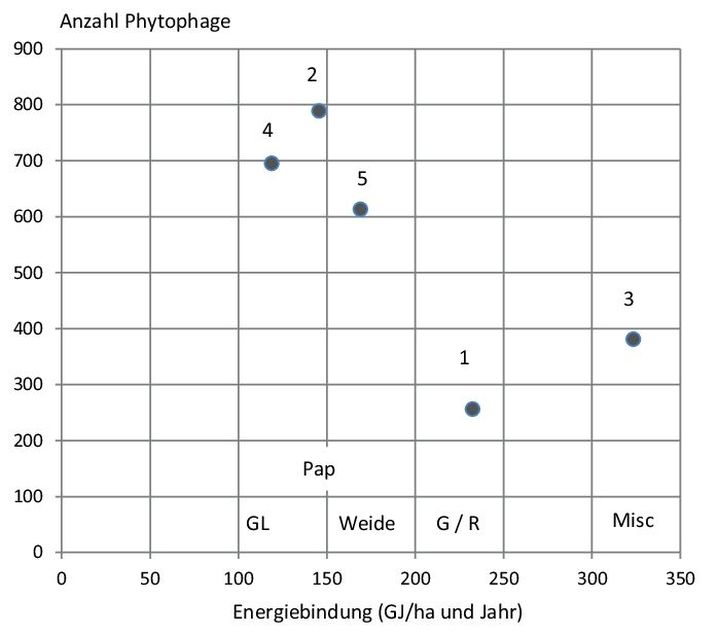
Abb. 9. Zusammenhang zwischen der im Pflanzenmaterial gebundenen Energie und dem Auftreten phytophager Insektengruppen. Zahlen indizieren den Zeitpunkt des Auftretens der Abundanzmaxima nach Fangzeitraum.
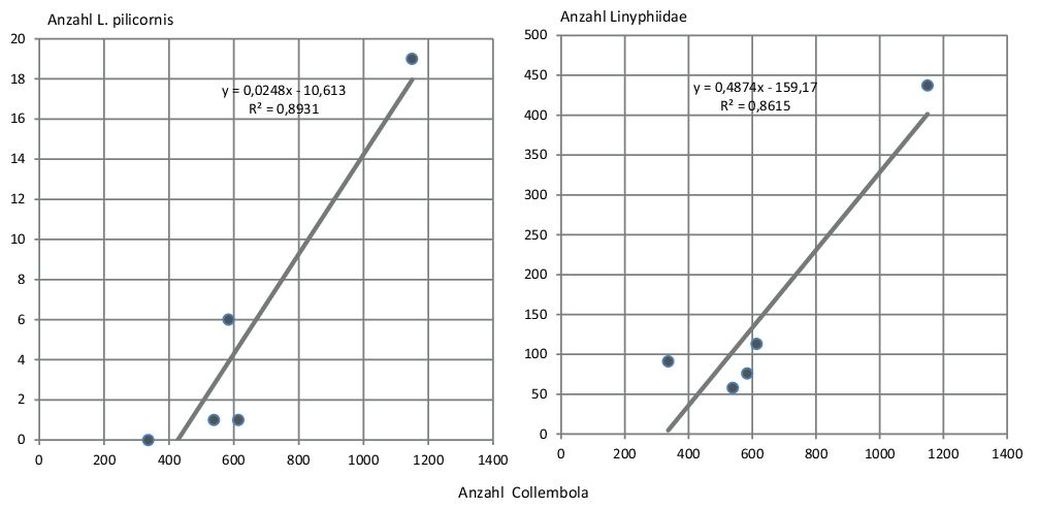
Abb. 10. Zusammenhang zwischen dem Auftreten von Collembolen (Primärkonsumenten) und der Laufkäferart Loricera pilicornis (A) sowie den Baldachinspinnen (Linyphiidae) (B) als Sekundärkonsumenten.
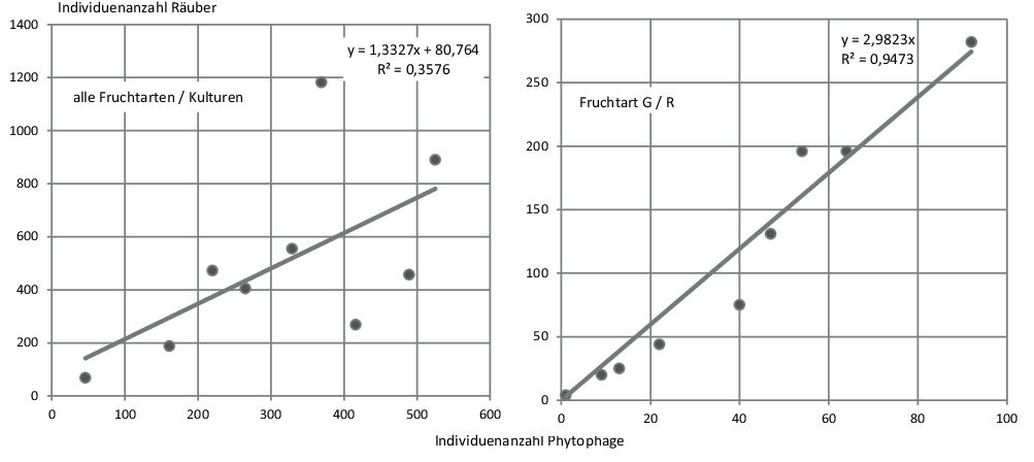
Abb. 11. Zusammenhang zwischen dem Auftreten phytophager Insekten (Primärkonsumenten) und räuberischer Insekten (Sekundärkonsumenten) unter Berücksichtigung der Daten aus allen Kulturen (A) bzw. der Befunde aus der Fruchtarte Gerste/Raps (G/R) (B) unter Berücksichtigung der Einzelwerte für die neun Fangserien.
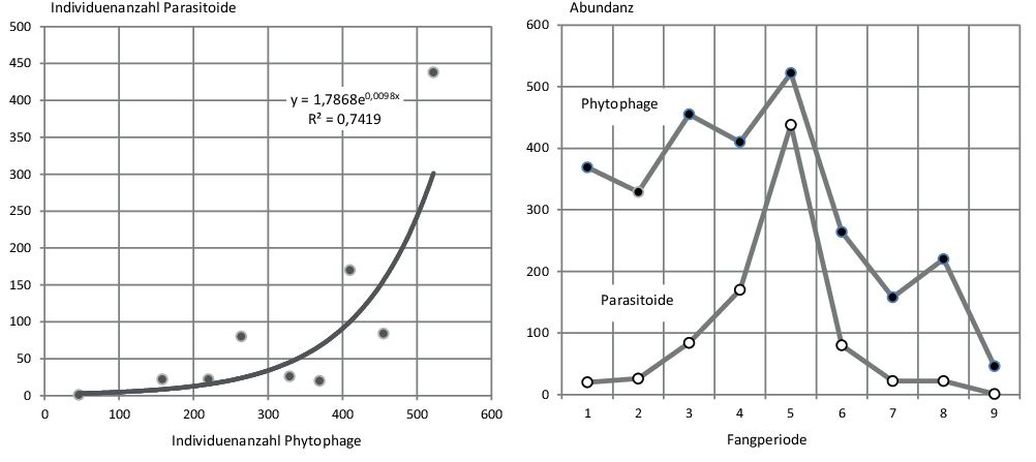
Abb. 12. Zusammenhang zwischen dem Auftreten phytophager Insekten (Primärkonsumenten) und Parasitoide (Sekundärkonsumenten) über alle Kulturen und Fangserien (A) sowie Abundanzdynamik beider Gruppen unter Berücksichtigung der Einzelwerte für die neun Fangserien (B).

Abb. 13. Einfluss des landwirtschaftlichen (A) bzw. ökosystemaren Energiegewinns (B) auf die Anzahl gefangener Arthropoden sowie des Eintrags fossiler Energie (C) und des ökosystemaren Energiegewinns (D) auf die Diversität ausgewählter Artengruppen.
Im Parameter „Eintrag fossiler Energie“ widerspiegelt sich die anthropogene Einflussnahme auf das Anbausystem, d.h. Maßnahmen der Düngung, des Pflanzenschutzes sowie der Bestandsetablierung und Pflege. Die Populationen der Laufkäfer und Webespinnen scheinen auf diesen Faktor zu reagieren (Abb. 13C), als funktionale Gruppen zusammengefasste Artengemeinschaften hingegen nicht.
Die Arthropoden wurden mit Bodenfallen gefangen. Diese Methode erfasst die Aktivitätsdichte der Tiere, weshalb die Nachweiswahrscheinlichkeit von Arten mit der Anzahl Bodenfallen zunimmt. Nach Mader und Mühlenberg (1981) sowie Sesseg (1984) stellt sich mit 5–6 Bodenfallen ein optimales Verhältnis zwischen Artennachweis, Erfassung der Dominanzstrukturen und Arbeitsaufwand ein. Die Fänge haben keinen direkten Flächenbezug und sind letztlich auch von Witterungsbedingungen abhängig (Heyer et al., 1993). Auch der „Laufwiderstand“ durch die Unterschiedlichkeit der Bodenbeschaffenheit könnte die Fangergebnisse beeinflussen. Nach Untersuchungen von Manuel (1999) ist dieser Effekt gering. Zwar erfassen Bodenfallen hauptsächlich epigäisch lebende Arthropoden (Laufkäfer, Kurzflügelkäfer, Spinnen), erbringen jedoch immer Beifänge anderer Tiergruppen. Genannte Effekte betrafen jedoch alle Kulturen gleichermaßen, weshalb Vergleiche zwischen ihnen nicht gestört sind. Die Auswertung der Beifänge erweiterte die Erfassung funktional wirksamer Gruppen. Dennoch ist anzunehmen, dass die Anzahl phytophager Arten und der Parasitoide unterbewertet ist. Sie bewegen sich in der Krautschicht und gelangen mit geringerer Wahrscheinlichkeit in Bodenfallen. Dies kann den Verlauf ausgewiesener Regressionen zwischen phytophagen und räuberischen Arten beeinflussen, aber die aufgezeigten Zusammenhänge nicht in Frage stellen. Neben den methodischen Fragen kommt der Einordnung der Befunde in den eingangs beschriebenen Forschungsrahmen Bedeutung zu. Verschiedene Autoren betonen, dass zur Indikation einer Nachhaltigen Landbewirtschaftung die Artenebene entscheidend ist (Büchs, 2003). Daher existieren umfassende Untersuchungen zur Bindung ausgewählter Tiergruppen an Fruchtarten, Agrar-Ökosysteme oder Landschaften. So zu epigäischen Raubarthropoden (Dammer und Heyer, 1997; Kreuter und Schmidt, 2007), zur Lumbricidenfauna (Papaja und Hülsbergen, 2000), der Bodenmikrofauna (Hofmann et al., 2009) oder avifaunistische Untersuchungen (Trautmann, 2013; Hoffmann, 2014a). Eine genauere Analyse dieser Untersuchungen zeigt, dass Nachhaltigkeit als ökologischer Prozess angesprochen wird, die Forschungen sich jedoch auf Einzelelemente des Naturkreislaufes begrenzen, sich der Beschreibung von Strukturmerkmalen widmen oder den Einfluss von Bewirtschaftung widerspiegeln. Einzelelemente des Naturkreislaufes betreffen z.B. die Auswahl der untersuchten Pflanzen- und Tiergruppen. Sie repräsentieren jeweils nur eine funktionale Ebene des Ökosystems. Neben den bereits angeführten Autoren sind die Begleitflora als Produzentenebene (Meyer et al., 2010), Regenwürmer als Destruenten (Hofmann et al., 2009; Schmitt, 2017) oder Nützlinge als Sekundärkonsumenten Freier et al., 1999) hauptsächlich untersucht. Die Rolle der Primärkonsumenten (Herbivore oder Pflanzenschädlinge) ist, mit Ausnahme des Grünlandes, bei ökologischen Erhebungen weitgehend ausgespart. Die Erfassung von Strukturen dient in erster Linie der Beurteilung von Habitatangebote für ausgewählte Tierarten der Agrarlandschaft. Hier sind es überwiegend Vogelarten die im Forschungsinteresse stehen (Lutze et al., 1999, Trautmann, 2013; Bellebaum et al., 2015; Hötker und Leuschner, 2014). Wichtige Forschungsfrage ist daneben die Abhängigkeit des Artenreichtums von der Landschaftsstruktur (Steiner und Köhler, 2000).
Bei der dritten Forschungsfrage geht es vornehmlich um die Assoziation zwischen angebauten Ackerbaukulturen und dem Auftreten von Arten, oft epigäischen Artengruppen (Irmler, 2003, Heyer et al., 2003, Heyer und Christen, 2004a). Eingeschlossen sind Untersuchungen zur Auswirkung von Pflanzenschutzmaßnahmen z.B. auf Laufkäfergesellschaften (Schützel, 2004; Krengel und Freier, 2016). Sehr vielgestaltig sind ebenfalls Vergleichsuntersuchungen zwischen ökologischen und konventionellen Anbauverfahren (Mäder et al., 2002, Hole et al., 2005). Gerade aus letzteren Publikationen wird geschlossen, dass intensiver wirtschaftende Anbausysteme für „Biodiversität“ nachteilig sind, was hauptsächlich mit dem Einsatz von Pflanzenschutzmittel begründet wird (Hole et al., 2005). Unbeachtet bleibt die Frage nach einer inhaltlichen Klarstellung des Begriffs „Intensität“. Er wird meist festgemacht an einzelnen Faktoren, wie der Anbaustruktur, den Umfang eingesetzter Pflanzenschutzmittel (Krengel und Freier, 2016) und Dünger oder am Ertrag (Storkey et al., 2012). Krengel und Freier (2016) kommen in ihrer Studie zu der Schlussfolgerung, dass sich die Intensität des Pflanzenschutzes nicht in der Struktur der Carabidengesellschaften widerspiegelt, weil die Vielgestaltigkeit begleitender Einflüsse einzelne Wirkungsfaktoren überdeckt. Auf die Unterschiedlichkeit der Verwendung des Begriffs der Intensität und seiner Anwendung als Indikator verweisen auch Shriar, 2000 und Erb et al., 2013. Beide ordnen den Begriff in ein gesamtheitliches Landnutzungskonzept der Nachhaltigkeit unter ökonomischen, sozialen und ökologischen Aspekten ein und bewerten Landnutzungsintensität auf Grundlage mehrerer Kennzahlen. Trotz abweichendem Rahmen in der wissenschaftlichen Fragestellung ergeben sich für die Einordnung vorliegender Forschungen wichtige Hinweise. Sie beziehen sich auf den Vorschlag über Input-Output-Relationen Veränderungen im Systemverhalten des (Agrar-) Ökosystems, seiner Netto Primärproduktion, der Kohlenstoff- und Nährstoffkreisläufe sowie der Biodiversität zu bewerten (Erb et al., 2013). Diesem Ansatz wurde in vorliegenden Forschungsanalysen gefolgt.
Mit den Untersuchungen zum Auftreten der Arthropodengemeinschaften an annuellen und perennierenden landwirtschaftlichen Fruchtarten konnte unter Anwendung ökologischer Kennzahlen zunächst die Dynamik bestehender Assoziationen beschrieben werden. Wichtige Erkenntnis ist, dass sowohl die Arten- als auch die Dominanzidentität erhebliche Änderungen über die Vegetationszeit erfuhren, was sich zusammengefasst im Diversitätsindex zeigt. Auf Grundlage der Bewertung der Diversitätsdifferenzen zeigten sich Besiedlungsunterschiede insbesondere im Vergleich des Ackerlandes zu den Baumkulturen als statistisch bedeutend. Diese Dynamiken haben eine erhebliche Bedeutung für das Ökosystemverständnis und berühren die Metapopulationstheorie. Danach führen zeitliche und/oder örtliche getrennte Teilpopulationen zu einer erhöhten Stabilität und Resilienz des Ökosystems, weil natürliche oder anthropogen verursachte Störungen nicht die Gesamtheit einer einheitlichen Population treffen. Daher müssen Arten- und Dominanzdifferenzen in den Arthropodengesellschaften als positiver Struktureffekt gesehen werden, der sich aus dem Nebeneinander der Fruchtarten ergibt. Auf diesen Hintergründen fußen z.B. Indikatoren zur Abbildung der Wirkungen von Landnutzungen auf Biodiversität, denen die Anbaustruktur, das Vorhandensein von Lebensraumtypen (LRT) oder für Arten notwendige Habitatstrukturen hinterlegt sind (Steiner und Köhler, 2000; Lutze et al., 2007; Hoffmann, 2014b). Diese Herangehensweise ist für eine Wertung der ökologischen Nachhaltigkeit landwirtschaftlicher Nutzsysteme allein nicht ausreichend, weil Fruchtarten-Arten-Assoziationen standortspezifisch variieren (Shriar, 2000) und die zentrale Frage ökologischer Nachhaltigkeit in der Aufrechterhaltung der Ökosystemprozesse liegt.
Hier greifen die Vorschläge von Erb et al. (2013) Kreislaufprozesse zu erfassen und Steinborn (2000) macht auf thermodynamische Betrachtungen von Ökosystemen und Möglichkeiten der Quantifizierung ökosystemarer Selbstregulation auf Grundlage energetischer Zusammenhänge aufmerksam. Er geht von der Produzentenebene aus und hebt die Bedeutung der Energiedissipation für die Stabilität der Ökosystemfunktionen hervor. Neben physikalischen Faktoren (z.B. Wärmeabgabe, Wasserverdunstung) beruht die Energiedissipation vor allem auf der Energieverteilung über das Nahrungsnetz, wobei über die Arten unterschiedliche funktionale Aufgaben im Naturkreislauf wahrgenommen werden. Sie bauen abgestorbene Biomasse ab (Destruenten), fungieren als Primär-(Herbivore) oder Sekundärkonsumenten (Räuber, Parasitoide). Die funktionale Tätigkeit der Organismen ist somit Voraussetzung für die Wahrung des Energieflusses im Ökosystem. Somit setzt die Erfassung des Ökosystemzustands immer eine Verbindung der Produzenten- und Konsumentenebenen voraus. Darüber wird die Funktionsfähigkeit des Nahrungsnetzes beurteilt (Schaeffer, 2003). Im Jenaer Experiment wird diese Verbindung für Grünlandgesellschaften hergestellt, indem die Produzentenebene Versuchsvarianten mit 1–60 Grünlandpflanzen umfasst (Ebeling et al., 2018) und die Arthropodengemeinschaften (Sekundärkonsumenten) sich nach ihren funktionalen Aufgaben (u.a. Destruenten, Herbivore, Carnivore) im Versuch differenzierten (Scherber et al., 2010). Ackerbausysteme sind auf der Produzentenebene im Regelfall durch eine beschränkte Anzahl Kulturpflanzen auf der Feldfläche charakterisiert. Vielgestaltigkeit ergibt sich überwiegend aus dem Neben- und Nacheinander unterschiedlicher Fruchtarten. Auch unterliegt die Vegetationsentwicklung der Fruchtarten einer hohen Dynamik (Hoffmann, 2014a). Somit ist die Produzentenebene nicht durch die Anzahl bzw. Diversität der Pflanzengesellschaft des Einzelfeldes zu charakterisieren. Aus der Gesamtschau vorstehender Zusammenhänge leitete sich die Arbeitshypothese vorliegender Untersuchungen ab. Sie sagt, dass die Produzentenebene im Nahrungsnetz über energetische Kennzahlen beschrieben werden kann und die Abundanz der Arthropoden bzw. die Diversität der Arthropodengemeinschaften in einem Zusammenhang mit dem Energiestatus bzw. dem Energiedargebot der Produzentenebene stehen. Diese können als Triebkräfte der beschriebenen Biodiversitätsdynamik verstanden werden. Der Energiestatus als landwirtschaftlicher Energiegewinn hatte einen Negativeinfluss auf die beschreibenden Parameter der Arthropodengesellschaften. Er wird von der Ertragsleistung der Kulturpflanze dominiert und dokumentiert die Energieabfuhr aus dem System. Wie von Storkey et al., 2012 dokumentiert, gilt diese Aussage nicht allein für Arthropoden, sondern auch für Segetalpflanzen, denn mit steigendem Weizenertrag nahm ihre Artenanzahl ab. Hingegen zeigte das Energiedargebot, beschrieben als ökosystemarer Energiegewinn, positive Auswirkungen auf die untersuchten Arthropodengemeinschaften und das Nahrungsnetz. Schmitt, 2017 bestätigt diesen Zusammenhang auch für das Bodenleben, wobei der Anteil organischer Bodensubstanz das Energiedargebot belegt. Weitere Informationen ergeben Analogieschlüsse aus Untersuchungen zu ökologischen Anbausystemen, denn Nährstoffkreisläufe werden dort verstärkt über die Zufuhr von Biomasse getragen. Ihre Mineralisierung setzt Energie für den Bestand des Nahrungsnetzes frei und beeinflusst alle Trophieebenen. Die bodenbiologische Aktivität bis zu Vogelarten (Fuchs, 2000; Tischer, 2000; Mäder et al., 2002; Hole et al., 2005; Raupp und Oltmanns, 2006; Massucati et. al, 2010). Zwar erschwerte die Einordnung der Untersuchungen in eine bestehende Versuchsanlage mit lediglich fünf Kulturen die statistische Untermauerung aller beschriebenen Zusammenhänge. Die Aussagen und Ergebnisse entsprechen jedoch thermodynamischen Prinzipien und sind daher allgemeingültig, wie auch Brock et al., 2017 für den Energiegewinn der Bodenmikroflora aus PSM-Wirkstoffen bemerkt. Die gewonnenen Kenntnisse können bestehende Verfahren zur Erfassung des „Biodiversitätsstatus“ landwirtschaftlicher Betriebe ergänzen. Sie wenden überwiegend Scoringsysteme (Dimkic und Schumacher, 1999; Oppermann et al., 2000; Neumann und Dierking, 2014; Anonym, 2017) an, die den Bestand von LRT, Habitate und landwirtschaftliche Bewirtschaftungsmaßnahmen in einem Punktsystem erfassen. Es werden hauptsächlich Strukturparameter bewertet, während energetische Daten die Intensität der Systemkreisläufe beschreiben und Rückschlüsse auf die Funktionsfähigkeit des „Naturhaushaltes“ zulassen. Sie können zur Ableitung indirekter Status- und/oder Wirkungsindikatoren (OECD, 1998) dienen, die eine abwägende Beurteilung landwirtschaftlicher Produktion unter Einschluss aller Ökosystemebenen und unter Berücksichtigung weiterer Umweltschutzgüter (Boden, Wasser, Luft, Biodiversität) ermöglichen (Heyer und Christen, 2007). Damit ist ein Betriebsleiter unter Praxisbedingungen konfrontiert. Landwirtschaftliche Kenndaten (Erträge, Bewirtschaftung, Fruchtfolge etc.) sind mit allen Schutzgütern korreliert, wie bereits von Abraham (2001) für Gewässer, Hülsbergen (2008) für Treibhausgase sowie Heyer et al. (2003), Mäder et al. (2002) und Siebrecht und Hülsbergen (2008) für Biodiversität beschrieben.
Abraham, J., 2001: Auswirkung von Standortvariabilitäten auf den Stickstoffhaushalt ackerbaulich genutzter Böden unter Berücksichtigung der Betriebsstruktur, der standortspezifischen Bewirtschaftung und der Witterungsbedingungen. Diss. Martin-Luther-Universität Halle-Wittenberg, 128 S.
Altermann, M., J. Rinklebe, I. Merbach, M. Körschens, U. Langer, B. Hofmann, 2005: Chernozem – Soil of the Year 2005. J. Plant Nutr. Soil Science 168, 725-740.
Anderson, M. (Editor), 2018: Integrating community assembly and biodiversity to better understand ecosystem function: the Community Assembly and the Functioning of Ecosystems (CAFE) approach. Ecology Letters 21: 167-180.
Anonym, 2017: Basline Report. Biodiversität in Standards und Labels der Lebensmittelindustrie, EU LIFE Programm und Deutsche Bundesstiftung Umwelt. www.food-biodiversity.eu.
Beaufoy, G., 2009: Neuer Leitfaden Zur Anwendung Des HNV-Indikators. Rural Evaluation News, Nr. 2, März 2009.
Bellebaum, J., P. Bernardy, J. Hoffmann, R. Joest, T. Langgemach, J.-D. Ludwigs, N. Meyer, R. Oppermann, F. Schöne, 2015: Positionspapier zur Ausgestaltung der Ökologischen Vorrangflächen aus Sicht des Vogelschutzes in der Agrarlandschaft. Vogelwarte 53 (3), 316-319.
Büchs, W., 2003: Biotic indicators for biodiversity and sustainable agriculture – introduction and background. Agriculture, Ecosystems & Environment 98, 1-16.
Brock, A., M. Kaestner, S. Trapp, 2017: Microbial growth yield estimates from thermodynamics and its importance for degradation of pesticides and formation of biogenic non-extractable residues. Environmental Research 28, 1-22.
Dammer, K.-H., W. Heyer, 1997: Quantifying the influence of the cultivated plant species on the occurrence of carabid beetles within certain species using contingency table analysis. Environmental and Ecological Statistics, Chapman & Hall, 4, 321-336.
Deter, A., 2011: Rückwirkungen der Diversifizierung des Kulturpflanzenanbaus unter spezieller Berücksichtigung der Biomasseproduktion (erneuerbare Energien) auf die Biodiversität im Agrarraum. Masterarbeit Hochschule Anhalt, 162 S.
Deike, S., B. Pallutt, B. Melander, J. Strassemeyer, O. Christen, 2008: Long-term productivity and environmental effects of arable farming as affected by crop rotation, soil tillage intensity and strategy of pesticide use: A case-study of two long-term field experiments in Germany and Denmark. Europ. J. Agronomy 29, 191-199.
Dimkic, C., W. Schumacher, 1999: Das Bonner Verfahren ÖKABB. In Pointereau et al.: Umweltbewertungsverfahren für die Landwirtschaft – Drei Verfahren unter der Lupe. Solagro, Toulouse, 47-58.
Duelli, P., M.K. Obrist, 2003: Biodiversity indicators: the choice of values and measures. Agriculture, Ecosystems & Environment 98, 87-98.
Ebeling, A., J. Hines, L.R. Hertzog, M. Lange, S.T. Meyer, N.K. Simons, W. Weisser, 2018: Plant diversity effects on arthropods and arthropod-dependent ecosystem functions in a biodiversity experiment. Basic and Applied Ecology, 26, 50-63.
Erb, K.H., H. Haberl, M. Rudbeck Jepsen, T. Kuemmerle, M. Lindner, D. Müller, P.H. Verburg, A. Reenberg, 2013: Current Opinion in Environmental Sustainability 5, 464-470.
Freier, B., C. Volkmar, T. Kreuter, H. Triltsch, A. Stark, R. Forster, 1999: Nützlinge als Bioindikatoren für die ökologischen Auswirkungen des Pflanzenschutzes in Feldstudien – Methoden und die Probleme bei der Interpretation der Daten. Anz. Schädlingskunde 72, 5-11.
Freydank, S., 2007: Leistungsvergleich annueller und perennierender Energiepflanzen im Mitteldeutschen Trockengebiet. Diss. Martin-Luther-Universität Halle-Wittenberg, 130 S.
Heinze, S., J. Raupp, R.G. Jörgensen, 2010: Effects of fertilizer and spatial heterogeneity in soil pH on microbial biomass indices in a long-term field trial of organic agriculture. Plant Soil 328, 203-215.
Fuchs, E., 2000: Einfluss fünfjähriger ökologischer Bewirtschaftung eines Landwirtschaftsbetriebes auf die Vogelfauna – dargestellt am Ökohof Seeben. In: Hülsbergen, K.-J., W. Diepenbrock (Hrsg.): Die Entwicklung von Fauna, Flora und Boden nach Umstellung auf ökologischen Landbau – Untersuchungen auf einem mitteldeutschen Trockenlößstandort. Martin-Luther-Univ. Halle (Saale), UZU Schriftenreihe, 217-229.
Heyer, W., J. Döring, K.H. Dammer, 1993: Beurteilung des Fanges epigäischer Nützlinge mit Bodenfallen in Kulturpflanzenbeständen. Kühn Archiv, Landwirtschaftliche Fakultät der MLU Halle, 87, 53-61.
Heyer, W., K.-J. Hülsbergen, K.-J., Wittmann, Ch., Papaja, S., O. Christen, 2003: Field related organisms as possible indicators for evaluation of land use intensity. Agriculture, Ecosystems & Environment 98, 453-461.
Heyer, W., O. Christen, 2004a: Quantifizierung des Einflusses der Fruchtarten- und Sortendiversität auf ausgewählte epigäische Räubergruppen: IÖR-Schriften, 43, 205-222.
Heyer, W., O. Christen, 2004b: Zum Miteinander von Landwirtschaft und Natur. Institut für Landwirtschaft und Umwelt (ilu), Biodiversität in der Kulturlandschaft. Tagungsband zur Fachveranstaltung am 13. Juli in Bonn, Heft 7/2004,15-42.
Heyer, W., O. Christen, 2007: Analyse- und Bewertungsansatz für die biologische Vielfalt auf der Ebene des Landwirtschaftsbetriebes. KTBL-Schrift 458, 109-138.
Hole, D.G., A.J. Perkins, J.D. Wilson, I.H., Alexander, P.V. Grice, A.D. Evans, 2005: Does organic farming benefit biodiversity? Biological Conservation, 122, 113-130.
Hoffmann, J., 2014a: Konsens oder Dissens von Intensivierungen in Ackerbaugebieten zu Biodiversitätszielen – können Indikatorvogelarten Auskunft geben? Tagung der Sächsische Interessengemeinschaft Ökologischer Landbau 2013, Bad Düben, 06.03.2014.
Hoffmann, J., 2014b: Die Mischung macht’s – Kurzumtriebsplantagen können ökologisch sinnvoll sein. ForschungsReport Spezial Ökologischer Landbau, 10-11.
Hoffmann, J., J.M. Greef, 2000: Mosaik indicators – theoretical approach for the development of indicators for species diversity in agricultural landscapes. Agriculture, Ecosystems & Environment 98, 387-394.
Hoffmann, S., 2006: Biodiversität: Ein wissenschaftliches Konstrukt auf politischem Prüfstand. „Umwelt- und Ressourcenökonomik“ für NachwuchswissenschaftlerInnen, Universität Kiel und Institut für Weltwirtschaft 20.-21. Februar 2006. 23 S.
Hofmann, B., S. Tischer, O. Christen, 2009: Auswirkungen langjähriger unterschiedlicher Bodenbearbeitungsintensität auf Humushaushalt, mikrobielle Aktivität und Lumbricidenfauna. Schriftenreihe der Pflanzenbauwissenschaften des Instituts für Agrar- und Ernährungswissenschaften, Martin-Luther-Universität Halle-Wittenberg, 6, 151-158.
Hötker, H., Ch. Leuschner, 2014: Naturschutz in der Agrarlandschaft am Scheideweg – Misserfolge, Erfolge, neue Wege. Michael Otto Stiftung für Umweltschutz, 69 S.
Hülsbergen, K.-J., B. Feil, S. Biermann, G.-W. Rathke, W.D. Kalk, W. Diepenbrock, 2001: A method of energy balancing in crop production and its application in a long-term fertilizer trial. Agriculture, Ecosystems and Environment 86, 303-321.
Hülsbergen, K.-J., 2008: Klimawandel und Ökolandbau – Situation, Anpassungsstrategien und Forschungsbedarf. KTBL-Tagung vom 1. – 2. Dez. in Göttingen, 65-80.
Irmler, U., 2003: The spatial and temporal pattern of carabid beetles on arable fields in northern Germany (Schleswig-Holstein) and their value as ecological indicators. Agriculture, Ecosystems & Environment 98, 141-152.
Krengel, S., B. Freier, 2016: – Pflanzenschutzmittel und Biodiversität – Aktueller Kenntnisstand zur Indikatorgruppe Laufkäfer. 60. Deutsche Pflanzenschutztagung, Julius – Kühn – Archiv 454, 369.
Kreuter, T., W. Schmidt, 2007: Selbstregulation im pfluglosen Ackerbau. Abschlussbericht zum Projekt „Wirkung bodenschonender Bewirtschaftungsverfahren auf das Bodenleben und die Selbstregulation von Ackerflächen“. Schriftenreihe der Sächsischen Landesanstalt für Landwirtschaft, Heft 10.
Lutze, G., R. Wieland, A. Schultz, 1999: Habitatmodelle für Tiere und Pflanzen – Instrumente zur integrativen Abbildung und Analyse von Lebensraumansprüchen ausgewählter Ziel- und Leitarten mit direktem Bezug zur Landschaftsstruktur und Landnutzung. In: Blaschke (Hrsg.): Umweltmonitoring und Umweltmodellierung: Grundlagen einer nachhaltigen Entwicklung. H. Wichmann Verlag Heidelberg, 223-236.
Lutze, G., A. Schultz, K.-O. Wenkel (Hrsg.), 2007: Landschaften beobachten, nutzen und Schützen – Landschaftsökologische Langzeit-Studie in der Agrarlandschaft Chorin 1992-2006. Teubner-Verlag, 259 S.
Macarthur, R.H., 1965: Patterns of species diversity. Biological Rev. 40, 510-533.
Mader, H.-J., M. Mühlenberg, 1981: Artenzusammensetzung und Ressourcenangebot einer kleinflächigen Habitatinsel, untersucht am Beispiel der Carabidenfauna. Pedobiologia 21, 46-59.
Mäder, P., A. Fließbach, D. Dubois, L. Gunst, P. Fried, U. Niggli, 2002: Bodenfruchtbarkeit und biologische Vielfalt im ökologischen Landbau. Ökologie & Landbau 124, 12-16.
Manuel, A.A., 1999: Massenwechsel und Einschätzung des Wirkungspotenziales epigäischer Räuber (Carabidae, Staphylinidae) sowie Interaktionen von Ameisen (Formicidae) und Blattläuse (Aphididae) in Apfelanlagen. Diss. Martin-Luther-Univ. Halle-Wittenberg, 153 S.
Massucati, L.F.P., Perkons, U., U. Köpke, 2010: Unkrautregulierung durch Mulchmanagement in Direktsaatverfahren von Ackerbohnen (Vicia faba L.) im Ökologischen Landbau. Mitt. Ges. Pflanzenbauwiss. 22, 83-84.
Meyer, S., K. Wesche, C. Leuschner, T. van Elsen, J. Metzner, 2010: Schutzbemühungen für die Segetalflora in Deutschland – Das Projekt „100 Äcker für die Vielfalt“ – Treffpunkt Biologische Vielfalt IX – BFN-Skripten 265: 59-64.
Neumann, H. & Dierking, 2014: Ermittlung des „Biodiversitätswerts“ landwirtschaftlicher Betriebe in Schleswig-Holstein – Ein Schnellverfahren für die Praxis. Naturschutz und Landschaftsplanung 46, 145-152.
OECD, 1998: Report of the OECD Workshop on Agri-Environmental Indicators. York, September 1998. Organisation for Cooperation and Development. Paris, France. COM/AGR/CA/ENV/EPOC (98), 136 S.
Oppermann, R., Nürnberger, M., S. Kunz, 2000: Kriterien zur Messung ökologischer Leistungen in der Landwirtschaft. – Schriftenr. Agrarspectrum, 31, 31-43.
Osterburg, B., 2006: High Nature Farmland als Indikator zur Begleitung und Bewertung der ELER-Verordnung. Monitoring und Indikatoren der Agrobiodiversitä. Agrobiodiversität – Schriftenreihe des Informationszentrums für Biologische Vielfalt, 27, 288-299.
Papaja,S., K.-J. Hülsbergen, 2000: Die Entwicklung von Regenwurmpopulationen unter dem Einfluss der Bewirtschaftungsumstellung. In: Hülsbergen, K.-J., W. Diepenbrock (Hrsg.): Die Entwicklung von Fauna, Flora und Boden nach Umstellung auf ökologischen Landbau – Untersuchungen auf einem mitteldeutschen Trockenlößstandort. Martin-Luther-Univ. Halle (Saale), UZU Schriftenreihe, 108-122.
Poole, R.W., 1974: An Introduction to Quantitative Ecology. McGrave Hill. Inc., New York, 532 S.
Rathke, G.W., W. Diepenbrock, 2003: Biogene Energieträger – eine Übersicht. Pflanzenbauwissenschaften 7, 1, 39-47.
Raupp, J., M. Oltmanns, 2006: Farmyard manure, plant based organic fertilisers, inorganic fertiliser – which sustains soil organic matter best? Aspects of Applied Biology 79, 273-276.
Schaeffer, M., 2003: Biozönosen und Ökosysteme: Welche Bedeutung hat die Diversität der Fauna? In: Gradstein, S. R., Willmann, R. und G. Zizka (Hrsg.). Biodiversitätsforschung – Die Entschlüsselung der Artenvielfalt in Raum und Zeit. Kleine Senckenberger Reihe 45, 147-160.
Scherber, C., Eisenhauer, N., Weisser, W.W., Schmid, B., Voigt, W., M. Fischer, 2010: Bottom-up effects of plant diversity on multitrophic interactions in a biodiversity experiment. Nature, 468, 553-556.
Schmitt, A.-K., 2017: Auswirkungen des Anbaus und Umbruchs von Kurzumtriebsplantagen auf ausgewählte physikalische, chemische und biologische Bodenparameter. Diss. Univ.-Halle, 139 S.
Schlumprecht, H., 2000: Das Schlüsselartensystem für ein Naturschutzmonitoring und die FFH-Arten. BfN Schriftenreihe für Landschaftspflege und Naturschutz, 68, 153-168.
Schützel, A., 2004: Synökologische Studien auf Ackerstandorten im Bundesland Sachsen-Anhalt und Möglichkeiten ihrer Nutzung in Überwachungs- und Förderprogrammen. Diss. Univ.-Halle, 113 S.
Siebrecht, N., K.-J. Hülsbergen, 2008: Das Biodiversitätspotential – ein Ansatz zur Analyse potenzieller biotischer Effekte Landwirtschaftlicher Betriebe.. In: Beiträge zur 10. Wissenschaftstagung Ökologischer Landbau 1, S. 410-413.
Sesseg, I., 1984: Beeinflussung der epi- und hypogäischen Fauna durch Pflanzenschutzmaßnahmen im Zuckerrübenanbau. Diss. Eidgenössische Technische Hochschule Zürich, ETH Nr. 7603.
Shriar, A.J., 2000: Agricultural intensity and its measurement in frontier regions. Agroforestry Systems 49, 301-318.
Soutwood, T.R.E., 1987: Ecological Methods – with particular reference to the study of insect populations. Second Edition, Chapman & Hall, 524 S.
Steinborn, W., 2000: Quantifizierung von Ökosystem-Eigenschaften als Grundlage für die Umweltbewertung. Diss. Univ. Kiel, 119 S.
Steiner, N.C., W. Köhler, 2000: Effects of landscape patterns on species richness – a modelling approach. Agriculture, Ecosystems & Environment 98, 353-361.
Storkey, J., S. Meyer, K.S. Still, C. Leuschner, 2012: The impact of agricultural intensification and land-use change on the European arable flora. Proc. R. Soc. B 279, 1421-1429.
Tischer, S., 2000: Veränderungen der mikrobiologischen Aktivität nach Bewirtschaftungswechsel. In: Hülsbergen, K.-J., Diepenbrock, W. (Hrsg.): Die Entwicklung der Fauna, Flora und Boden nach Umstellung auf ökologischen Landbau – Untersuchungen auf einem mitteldeutschen Trockenlößstandort. Martin-Luther-Univ. Halle (Saale), UZU-Schriftenreihe, 101-107.
Trautmann, S., 2013: Vogelarten der Agrarlandschaft als Bioindikatoren für landwirtschaftliche Gebiete. Julius-Kühn-Archiv 442, 18-32.