

Parasitische Pilze auf Blättern der Spätblühenden Traubenkirsche: Ein Beitrag zum biologischen Pflanzenschutz
Parasitic fungi on leaves of Black Cherry: A contribution to biological plant protection
Journal für Kulturpflanzen, 70 (12). S. 342–347, 2018, ISSN 1867-0911, DOI: 10.1399/JfK.2018.12.02, Verlag Eugen Ulmer KG, Stuttgart
Es werden vier auf der Spätblühenden Traubenkirsche (Prunus serotina) vorkommende Pilzarten beschrieben, einschließlich ihrer Krankheitsbilder und ihrer taxonomischen sowie infektionsbiologischen Besonderheiten. Asteroma padi gilt als Krankheitserreger und Verursacher hell brauner Flecke. Der Pilz besitzt eine endophytische Entwicklungsphase, die durch Fraßtätigkeit von Insektenlarven in eine pathogene Phase übergehen kann. Paecilomyces crassipes sp. nov. wird erstmals als neue Art beschrieben und abgebildet. Phoma pomorum besitzt ein ähnliches Krankheitsbild wie Asteroma padi, unterscheidet sich jedoch von dieser durch kleinere Sporen. Taphrina farlowii, die als „verschollene Art“ bekannt geworden ist, verursacht an jungen Blättern blasenartige, farblich auffällige Deformationen. – Es wird die Frage gestellt, ob einer der genannten Pilze als „Mykoherbizid“ zur Eindämmung von Prunus serotina eingesetzt werden kann.
Stichwörter: Spätblühende Traubenkirsche, Asteroma padi, Mykoherbizid, Paecilomyces, Phoma pomorum, Prunus serotina, Taphrina farlowii
Four fungus species occurring on Wild Black Cherry (Prunus serotina) are described, including their symptoms and taxonomic and infection biology characteristics. Asteroma padi is considered to be the causative agent of light-brown leaf spots. The fungus has an endophytic stage of development, which can change into a pathogenic phase caused be feeding of insect larvae. Paecilomyces crassipes sp. nov. is described here for the first time as a new species. Phoma pomorum is causing symptoms similar to Asteroma padi, but differentiated by smaller spores.Taphrina farlowii, known as “lost species”, causes bubble-like, conspicuously coloured deformations on young leaves. – This article raises the question whether one of the mentioned fungi can be applied as “mycoherbicide” against the spreading of Prunus serotina.
Key words: Black Cherry, Asteroma padi, Mycoherbicide, Paecilomyces, Phoma pomorum, Prunus serotina, Taphrina farlowii
Unsere Fauna und Flora ist dauernden Veränderungen unterworfen, sei es durch Rückgang oder Aussterben von Arten, sei es durch Zuwanderung nicht heimischer Pflanzen oder Tiere. Viele Neophyten bzw. Neozoen bereichern heute unsere Tier- und Pflanzenwelt. Andererseits gibt es unerwünschte Einwanderer, die teilweise schon zu erheblichen Störungen in unseren Ökosystemen geführt haben. Zu den kritischen Arten aus der Gruppe der Neophyten gehört auch die Spätblühende Traubenkirsche (Prunus serotina), die bereits Ende des 17. Jahrhunderts von Nordamerika übernommen und zunächst als Zierbaum in Europa in Parks und Gärten angepflanzt wurde. Später wurde diese Baumart auf Eignung für die Forstwirtschaft geprüft. Im Gegensatz zu ihrem Heimatland, wo sie baumartige Bestände bildet, wächst die Traubenkirsche bei uns aber nur strauchartig. Durch unkontrollierte Ausbreitung erschwert sie heute die Naturverjüngung heimischer Gehölze und behindert die forstlichen Pflege- und Erntemaßnahmen (Haag und Wilhelm, 1998). Seit einigen Jahren werden daher in Deutschland Versuche unternommen, die Bestände der Traubenkirsche zu reduzieren (Münte, 2009). Neben mechanischen Methoden wurden auch biologische Verfahren getestet, z. B. mit dem Violetten Knorpelschichtpilz (Chondrostereum purpureum), der als „Mykoherbizid“ zum Abtöten und Abbau der Wurzelstöcke in norddeutschen Wäldern eingesetzt wurde (Heydeck und Münte, 2008). Ähnliche Versuche sind vorher schon in Holland erfolgreich durchgeführt worden (De Jong, 2000).
Die Anwendung von parasitischen Blattpilzen zur Eindämmung oder sogar Abtötung unerwünschter Pflanzen ist grundsätzlich nicht neu. Vielmehr gibt es bereits zahlreiche Berichte über die Wirksamkeit, aber auch über die Problematik dieser Verfahrensweise (Hershenhorn et al., 2016). Ehe eine solche Technik auch für Prunus serotina angewandt werden kann, sollte man wissen, welche Pilze überhaupt auf Blättern dieser Baumart vorkommen und welche Arten für einen Mykoherbizid-Einsatz besonders geeignet sind. Die vorliegende Zusammenstellung ist als kleiner Beitrag dazu gedacht. Gleichzeitig können die Angaben auch zur Bestimmung der auf Blättern von Prunus serotina vorkommenden Pilzarten herangezogen werden. Alle Felduntersuchungen wurden von 2004 bis 2018 in Niedersachsen in den Wäldern um Celle, Faßberg, Gifhorn und Soltau durchgeführt.
Von den auf der Spätblühenden Traubenkirsche vorkommenden Blattpilzen (Brandenburger, 1984; Ellis and Ellis, 1985; Sutton, 1980) sollen vier Arten, die häufiger auf dieser Baumart beobachtet werden können, ausführlicher beschrieben werden. Ihre Anordnung erfolgt in alphabetischer Reihenfolge.
Der Pilz gehört zur heimischen Pilzflora mit Vorkommen auch in Nordamerika. Er verursacht bräunliche Nekroseflecke, die sich in Größe und Farbe kaum von denen der Phoma pomorum unterscheiden. Eine Differentialdiagnose erfolgt am sichersten an Hand der größeren Sporen. Nicht selten kommt es zu Mischinfektionen, vor allem mit Paecilomyces crassipes, so dass der wahre Erreger der Blattflecke zunächst nicht eindeutig erkannt werden kann. Die Fruchtkörper des Pilzes (Acervuli) finden sich meist zu mehreren auf der Oberseite der Blätter. Sie sind flach, schwärzlich, 100 bis 150 μm groß und enthalten 14–16 × 3–3,5 μm große, spindelförmige Konidien (Sutton, 1980).
Asteroma padi ist infektionsbiologisch dadurch besonders ausgezeichnet, dass der Pilz eine endophytische, symptomlose Entwicklungsphase besitzt, die erst durch besondere Reizeinwirkung in eine parasitische Phase übergeht. In unserm Fall spielt offenbar die Larvenentwicklung eines blattbewohnenden Insekts (Lyonetia ?) die Rolle des Auslösers. Die Insektenlarve stirbt bei diesem Vorgang ab, wogegen der Pilz seine Entwicklung erfolgreich fortsetzt. Derartig komplexe Vorgänge sind bereits bei anderen tierischen Gallen bekannt (Pehl und Butin, 1994). In unserem Fall konnte die Insekten-Pilz-Beziehung nur gelegentlich beobachtet werden, so dass die pathogene Entwicklung von Asteroma padi offenbar auch unabhängig davon ablaufen kann.
Der im folgenden zu beschreibende Pilz gehört zu den auffälligsten und relativ häufigen Krankheitserregern der Späten Traubenkirsche. Trotzdem fehlen in der Literatur Hinweise auf seine taxonomische Zugehörigkeit sowie Angaben über seine Biologie. Ein wesentlicher Grund mag darauf beruhen, dass bestimmte Fruktifikationen, die für eine Bestimmung erforderlich sind, in der Natur nur selten gebildet werden. Nach Auffinden einer solchen Fruchtform in Niedersachsen kann jetzt folgende Erstbeschreibung des zu den Hyphomyceten gehörenden Pilzes gegeben werden:
Diagnosis:. Conidiophores fixed basally in necrotic cells of the epidermis of infected leaves, up to 100 μm, composed of two or three large, pale brown inflated cells, 10–14 μm wide; upper portion consisting of dense whorls of vertically arranged, short, hyaline branches, each bearing 2 to 5 phialides. Phialides 4–6 × 3 μm, with inflated basal portion, tapering into a short cylindrical, thin neck. Conidia one-celled, ellipsoidale to short cylindric, 2–3,5 × 1,5–2,0 μm, in short chains.
Colonies on malt-agar growing moderate fast, attaining a diameter of 40 mm within 14 days at room temperature, at first white to grey, changing later into pale yellow and yellowish-brown. Older cultures with brown pigmentation. Conidiophores mostly arising from submerged, vegetative, pale yellow hyphae, 30–60 × 6–8 μm, consisting of few irregularly arranged, short branches bearing verticillate standing phialides. Phialides hyaline, 4,5–6 × 3 μm, with a swollen basal portion tapering into a distinct neck, sporulating hyaline, 2,5–3,5 × 1,5 μm conidia in short chains, forming slimy heads. Chlamydospores present, single or in short chains, brown to dark brown, smooth-walled, globose to subglobose or pyriform, 8 × 14 μm, thick-walled.
Typus:. Deutschland, Niedersachsen, Eichen-Kiefern-Mischwald mit strauchförmigem Unterwuchs von Prunus serotina, nördlich von Faßberg an der Straße nach Trauen, 71 m NN, (MTB 1604); (Koordinaten: N 52° 54´ 43.8´´; E 10° 9´ 1.50´´); auf lebenden Blättern von Prunus serotina Ehrh., leg. Heinz Butin, 04. 09. 2013, dep. in Herbarium Wien, Naturhistorisches Museum, Botanische Abteilung, Acq. No. W-2018–0005609; Abb. 1a–d und Abb. 2a–d.

Abb. 1. Paecilomyces crassipes: a Fleckenbildung an Blättern der Spätblühenden Traubenkirsche, b Blattfleck mit zentral gelegenen Sporenträgern, c losgelöste Sporenträger (Makrokonidien), d Konidienträger mit Mikrokonidien aus Freiland (Anilinblau-Färbung).
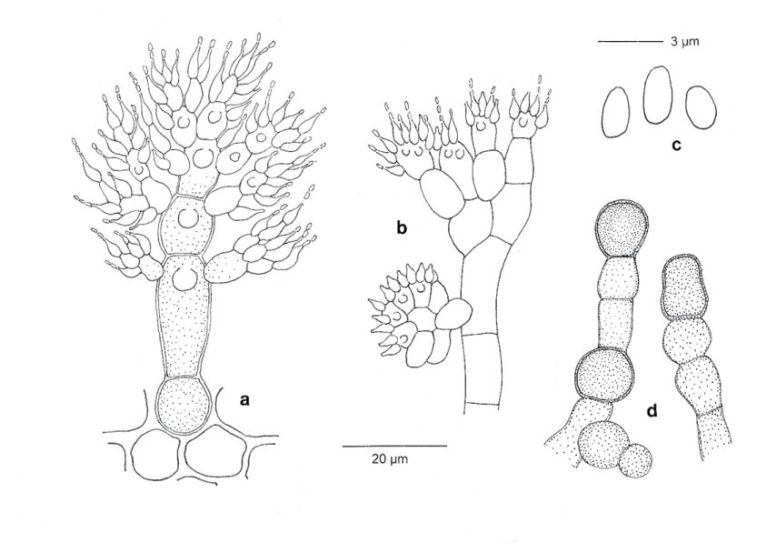
Abb. 2. Paecilomyces crassipes: a in Natur gebildete Sporophore mit Mikrokonidien, b in Kultur auf Malzagar gebildeter Sporenträger, c zugehörige Mikrokonidien, d in Kultur gebildete Chlamydosporen (Zeichnung Butin).
Etymologie:. nach den dicken, basalen Stielzellen der Sporenträger benannt.
Die makroskopischen Symptome dieses relativ häufig auf noch grünen Blättern auftretenden Pilzes sind rundliche bis ovale, 3–6 × 3–5 mm große, anfangs braune, später dunkel braunviolette Flecke (Abb. 1a), die gelegentlich zu mehreren zusammenfließen und dann zum vorzeitigen Abwurf der vergilbenden Blätter führen. Zur Abgrenzung gegenüber anderen Blattpilzen besitzen diese Flecke einen diffusen, bräunlich-violetten Rand. Im Zentrum der braunen Flecke finden sich blattoberseits (später auch blattunterseits) weißliche Pusteln (Abb. 1b), die sich im mikroskopischen Bild als bäumchenartig verzweigte Gebilde zu erkennen geben (Abb. 1c). In dieser Form sind sie den ganzen Sommer über nachweisbar. Sie lösen sich leicht von der Unterlage und können so als Ganzes durch Wind oder Regen weithin verbreitet werden. Ihre Besonderheit liegt u.a. darin, dass jede einzelne Zelle des Sporenträgers unter günstigen Bedingungen auskeimen und zu neuen Infektionen führen kann. Der vorliegende Zellkomplex fungiert hier gewissermaßen als keimungsfähige Makrokonidie (Propagula). Im Herbst, oft auch erst im folgenden Frühjahr, werden relativ selten (meist auf der Blattunterseite) an den äußeren Trägerzellen zahlreiche kleine, quirlförmig angeordnete Phialiden gebildet, an deren Spitze farblose Konidien (Mikrokonidien) kettenförmig abgeschnürt werden (Abb. 1d, 2a). Da eine Keimung weder auf natürlichem Blattmaterial noch auf künstlichen Medien erzielt werden konnte, nehmen wir an, dass die Mikrokonidien die Funktion von Spermatien besitzen und bei der Teleomorphenbildung eine Rolle spielen.
Wird der Pilz auf Malzagar kultiviert, so entstehen schon nach wenigen Tagen zahlreiche, einzeln abgeschnürte oder in Ketten angeordnete Chlamydosporen (Abb. 2d). Eine Woche später findet man die ersten Sporophoren (Abb. 2b), deren apikaler Teil sich in schleimige, rundliche Sporenköpfchen verwandelt. Die relativ rasch wachsenden, anfangs weißen Kulturen verfärben sich im Laufe der Zeit gelblich bis schließlich ockerbraun.
Für die Einordnung des Pilzes in die Hyphomycetengattung Paecilomyces sprechen in morphologischer Hinsicht zunächst die quirlständig angeordneten, flaschenförmigen Phialiden, die an ihrer Spitze farblose, einzellige Konidien in Ketten abschnüren (Seifert et al., 2011). Bei einem Vergleich mit anderen Arten ergeben sich Ähnlichkeiten vor allem mit Vertretern der Sektion Isarioidea, die sich durch kompaktere Sporenköpfchen und kürzere Trägerzellen auszeichnen. Ergänzt werden die morphologischen Gemeinsamkeiten durch das Vorhandensein von Chlamydosporen in Kultur. Eine weitere Auffälligkeit der Arten untereinander besteht in der für diese Gattung besonderen Färbung der Myzelkulturen. Die Zugehörigkeit des neuen Pilzes zur Hyphomycetengattung Paecilomyces wird schließlich durch den Nachweis von byssochlamysähnlichen Fruchtkörpern untermauert, die auf abgefallenen, von Paecilomyces crassipes besiedelten Blättern nachgewiesen werden konnten. Von einigen Paecilomyces-Arten ist die Verbindung zur Ascomycetengattung Byssochlamys als Teleomorphe bereits bekannt (Samson, 1974). Weitere Untersuchungen werden erforderlich sein, um diese Verbindung auch bei dem neuen Pilz zu verifizieren.
Der zu den Coelomycetes gehörende Pilz ist ein weltweit verbreiteter Krankheitserreger, der auf zahlreichen Pflanzengattungen (Sutton, 1980) als Erreger von Blatt- und Stängelnekrosen auftritt (Smith et al., 1988). Auf der Spätblühenden Traubenkirsche ist er durch kreisförmige bis ovale, 4 bis 8 mm große, homogen bräunliche Nekrosen ausgezeichnet, die sich scharf von gesundem Gewebe des Blattes absetzen, häufig umsäumt von einem hellen, grünlichgelben Ring. Die Flecke finden sich meist zu mehreren auf der Blattoberseite, oft vermischt mit den Nekrosen anderer Blattfleckenerreger. Seine Fruchtkörper (Acervuli) – die nicht immer nachgewiesen werden können – sind schwarz, kugelig und apikal mit einem runden Porus versehen. Sie enthalten zahlreiche, farblose, 5–6 × 2,5 μm große Konidien. Ein vorzeitiges Vergilben der Blätter wurde auch bei einem stärkeren Befall nie festgestellt.
Der zu den Taphrinales gehörende, hoch wirtsspezifische Pilz verursacht auf jungen Blättern von Prunus serotina verschieden große, einzeln oder gehäuft auftretende, blasenartige Aufwölbungen, die entweder hellgrünlich oder auch rötlich gefärbt sein können (Abb. 3a). Die infizierten Wirtszellen sterben bei der Gallenbildung keineswegs ab, vielmehr reagiert die Wirtspflanze mit vermehrter Zellbildung, die teilweise monströsen Charakter annehmen kann. In dieser Form erinnert das Befallsbild an die „Kräuselkrankheit“ der Pfirsichblätter, die aber durch eine andere Art, Taphrina deformans, verursacht wird. An älteren Befallsstellen von T. farlowii treten zuweilen bräunliche Nekrosen auf, die durch Sekundärinfektionen saprobiontischer Pilze (z.B. Cladosporium spp.) verursacht werden. Echte, zellulär differenzierte Fruchtkörper fehlen bei Taphrina spp. Ihre dikariotische Entwicklungsphase besteht ausschließlich aus Aszi, die subkutikulär angelegt werden und später durch die Kutikula nach außen brechen. Im Blattquerschnitt (Abb. 3b) erkennt man palisadenartig nebeneinander angeordnete Sporenschläuche, die die Blattunterseite wie mit einem weißlichen Reif überziehen. Die 30–40 × 10–14 μm großen Aszi enthalten jeweils acht rundliche bis eiförmige, 5,6–7,5 × 4,5–6 μm große Askosporen, die sich im Sporenschlauch noch weiter durch Sprossung vermehren können.
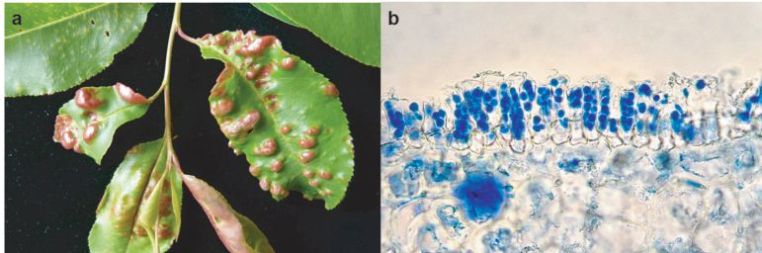
Abb. 3. Taphrina farlowii: a Befall an jungen Blättern von Prunus serotina, b Querschnitt durch ein befallenes Blatt mit Aszi und Askosporen (Anilinblau-Färbung).
Als Ergänzung zur Beschreibung von Taphrina farlowii soll noch auf die Geschichte des Pilzes eingegangen werden, zumal diese nicht ganz ohne Irrtümer und Widersprüche abgelaufen ist. Beschrieben wurde der Pilz erstmals von Sadebeck (1890) an Hand von Belegmaterial aus Nordamerika. Als Wirtspflanze wird die Spätblühende Traubenkirsche (Prunus serotina) angegeben. In seiner Monographie über die Gattung Taphrina wird von Mix (1949) auch ein Fund aus Deutschland aufgeführt (Mycoth. Marchica Nr. 3459, Charlottenburg, Schlossgarten, leg. P. Sydow 1891). In den folgenden über 100 Jahren ist kein weiterer Fund mehr aus Deutschland bekannt geworden. Erst zu Anfang des 21. Jahrhunderts wurde wieder ein Taphrina-Befall auf Blättern von Prunus serotina beobachtet, so dass von der „Wiederentdeckung einer verschollenen Art“ gesprochen wurde (Butin und Regin, 2008). Bei der Nachprüfung des ursprünglichen Referenzbeleges hat sich nun herausgestellt (Kummer, 2007), dass es sich bei der damaligen Probe um Prunus padus gehandelt hat, also um eine Baumart, auf der Taphrina farlowii gar nicht vorkommt. Damit existiert kein Beleg (mehr) über das damals angebliche Vorkommen des Pilzes in Deutschland. Das heute zu beobachtende relativ häufige Vorkommen von Taphrina farlowii in Europa geht damit offensichtlich auf eine Einschleppung jüngeren Datums zurück.
Nach der Klärung des vermeintlich früheren Taphrina-Vorkommens hat eine Mitteilung von Kummer (2007) neue Verwirrung gestiftet, wonach eine andere in Deutschland gefundene Taphrina-Art, T. confusa (G. F. Atk.) Giesenh. ebenfalls auf Prunus serotina vorkommen soll. Nach Mix (1949) ist diese Art aber an P. virginiana und – mit einiger Unsicherheit – auch an P. alabamensis gebunden. Es besteht damit noch weiterer Forschungsbedarf, um den Taphrina-Prunus-Komplex endgültig aufzuklären.
An dieser Stelle sollen noch einige weitere, auf Blättern von Prunus serotina vorkommende Pilzarten genannt werden, die als Saprobionten oder seltener auftretende Parasiten von uns beobachtet worden sind. Es handelt sich um Ampelomyces quisqualis Ces. ex Schlecht., Cladosporium sp., Epicoccum purpurascens Ehrenb., Microsphaeropsis olivacea (Bon.) Höhnel, Monilia linhartiana Sacc., Podosphaera tridactyla (Wallr.) de Bary sowie Truncatella angustata (Pers.) Hughes. Schließlich tritt als regelmäßiger, saprobischer Erstbesiedler an vergilbenden Blättern der Coelomycet Coleophoma cylindrospora (Desm.) Höhn. auf.
Bei einer Beschreibung von Krankheitserregern und ihren Schadbildern schließt sich meist die Frage nach ihrer Verhütung bzw. Bekämpfung an. Im vorliegenden Fall ergeben sich interessanterweise zwei unterschiedliche Antworten. Tritt einer der hier genannten Pilze dauerhaft an einem Einzelbaum von Prunus serotina auf, der als Zierbaum Beachtung finden soll, so könnte man den Einsatz von Fungiziden in Betracht ziehen. Es gibt aber noch eine andere, weniger übliche Sichtweise, die ganz das Gegenteil im Auge hat. Nachdem sich die Spätblühende Traubenkirsche im forstlichen Bereich als Problembaum erwiesen hat, werden erhebliche Anstrengungen zur Eindämmung der invasiven Art gemacht (vgl. Einleitungstext). Zu den Bekämpfungsmaßnahmen gehören auch biologische Verfahren. In diesem Zusammenhang könnte man über den Einsatz von Blattpilzen als Mykoherbizid nachdenken, um zumindest eine Reduktion des Pflanzenwachstums zu erreichen. Nach dem Befallsbild in der Natur ist das Pilzauftreten zwar bei allen hier besprochenen Pilzarten eher eine ästhetische Beeinträchtigung als eine lebensbedrohliche Baumerkrankung. Diese Bewertung könnte sich aber ändern, wenn man die Blätter künstlich mit einer Suspension von infektiösem Material besprühen würde. Als ein solches „biologisches Entlaubungsmittel“ wäre Paecilomyces crassipes besonders geeignet, zumal der Pilz schon unter natürlichen Bedingungen ein vorzeitiges Vergilben mit nachfolgendem Blattfall verursachen kann (s. Titelbild). Für die Wahl dieses Pilzes spräche auch die labortechnisch einfache Gewinnung von keimfähigem Sporenmaterial (Chlamydosporen). Lateralschäden wären im übrigen bei diesem Pilz nicht zu befürchten, da Paecilomyces crassipes nur auf Prunus serotina vorkommt. Praktische Versuche in dieser Hinsicht sind geplant, wobei auch die Eignung der übrigen, hier genannten Pilzarten geprüft werden soll.
Brandenburger, W., 1984: Parasitische Pilze an Gefäßpflanzen in Europa. Gustav Fischer Verlag, Stuttgart, 1248 S.
Butin, H., H. Regin, 2008: Taphrina farlowii – die Wiederentdeckung einer verschollenen Pilzart. Der Tintling 13 (3), 40-42.
De Jong, M.D., 2000: The BioChon story: development of Chondrostereum purpureum to suppress stump sprouting in hardwoods. Mycologist 14 (2), 58-62.
Ellis, M.B., J.P. Ellis, 1985: Microfungi on Land Plants. Croom Helm, London, 818 S.
Haag, G., U. Wilhelm, 1998: Die Spätblühende Traubenkirsche: Arbeiten mit ´unerwünschter` Baumart oder Verschleppung einer Katastrophe? AFZ DerWald (6), 276-279.
Hershenhorn, J., F. Casella, M. Vurro, 2016: Weed biocontrol with fungi: past, present and future. Biocontrol Science and Technology 26 (10), 1313-1328.
Heydeck, P., M. Münte, 2008: Der Violette Knorpelschichtpilz als “Bioherbizid” gegen Traubenkirsche. AFZ DerWald (4), 188-190.
Kummer, V., 2007: Bemerkenswerte Pilzfunde auf der 37. Brandenburgischen Botanikertagung in Neuendorf bei Oranienburg. Verhandlung des Botanischen Vereins Berlin Brandenburg 140, 141-155.
Mix, A.J., 1949: A monograph of the genus Taphrina. Bibliotheca Mycologica 18, 167 S. (Reprint 1969).
Münte, M., 2009: Spätblühende Trauben-Kirsche in Berlin. AFZ DerWald (13), 688-690.
Pehl, L., H. Butin, 1994: Endophytische Pilze in Blättern von Laubbäumen und ihre Beziehungen zu Blattgallen (Zoocecidien). Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft (297), 65 S.
Sadebeck, R., 1890: Kritische Untersuchungen über die durch Taphrina-Arten hervorgebrachten Baumkrankheiten. Jahrbuch der Hamburgischen Wissenschaftlichen Anstalten, Jahrg. VIII, 61-95. (Arbeiten des Botanischen Museums, Hamburg, 1891).
Samson, R.A., 1974: Paecilomyces and some allied Hyphomycetes. Studies in Mycology (6), 119 S.
Seifert, K., G. Morgan-Jones, W. Gams, B. Kendrick, 2011: The Genera of Hyphomycetes. CBS-KNAW, Fungal Biodiversity Centre, Utrecht, 997 S.
Smith, I.M., Smith, J. M., D. H. Phillips, R. A. Elliott, 1988: European Handbook of Plant Diseases. Blackwell Scientific Publications, Oxford, 583 S.
Sutton, B.C., 1980: The Coelomycetes. Commonwealth Mycological Institute, Kew, Surrey, 696 S.