

Risiken von Pyrrolizidinalkaloiden in Tee und Kräutertee
Risks of pyrrolizidine alkaloids in tea and herbal infusions
Journal für Kulturpflanzen, 72 (4). S. 63–77, 2020, ISSN 1867-0911, DOI: 10.5073/JfK.2020.04.02, Verlag Eugen Ulmer KG, Stuttgart
 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de).
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de).Pyrrolizidinalkaloide (PA) sind sekundäre Pflanzeninhaltsstoffe, die von einer Vielzahl von Pflanzen gebildet werden und u. a. zur Abwehr von Fraßfeinden dienen. Toxikologisch bedeutsam sind die PA, die eine Doppelbindung in 1,2-Position aufweisen. Diese können zu gesundheitlichen Schäden bei Mensch und Tier führen, wobei die Leber das Hauptzielorgan darstellt. Neben den bekannten hepatotoxischen Effekten können 1,2-ungesättigte PA auch die DNA schädigen und krebserzeugend wirken. Die Verbindungen gelangen in erster Linie über Wild- und Beikräuter in die Lebensmittelkette. In der im Jahr 2016 durch das Bundesinstitut für Risikobewertung (BfR) veröffentlichten Bewertung stellte der Verzehr von kontaminiertem Tee und Kräutertee die wesentliche Expositionsquelle für die Bevölkerung gegenüber 1,2-ungesättigten PA in Deutschland dar; aber auch andere Lebensmittel können zur Aufnahme beitragen. In der vorliegenden Arbeit, in der ausschließlich Tee und Kräutertee berücksichtigt werden, zeigt sich, dass die Gehalte an 1,2-ungesättigten PA in dieser Lebensmittelgruppe im Vergleich zu 2016 deutlich gesunken sind. Dennoch kann es insbesondere bei Personen, die langfristig hohe Mengen Kräutertee bzw. Rooibostee verzehren, auch gegenwärtig noch zu Aufnahmemengen kommen, die in einem Margin of Exposure von unter 10.000 resultieren, weshalb es auch weiterhin angezeigt scheint, Maßnahmen zur Senkung der Gehalte durchzuführen.
Stichwörter: Pyrrolizidinalkaloide, Tee, Kräutertee, Risikobewertung, Expositionsschätzung
Pyrrolizidine alkaloids (PA) are secondary plant metabolites which are produced by a large number of plants, e. g. to ward off herbivores. PA with a double bond in the 1,2-position are of toxicological relevance. These derivatives can cause adverse health effects in humans and animals, with the liver being the major target organ. Besides the known hepatotoxic effects, 1,2-unsaturated PA may also damage DNA and may be carcinogenic. The occurrence of these compounds in foods is primarily caused by contamination with wild herbs. In the assessment published in 2016 by the German Federal Institute for Risk Assessment (BfR), consumption of contaminated tea and herbal tea was the main source of exposure for the population to 1.2-unsaturated PA in Germany; however, other foods can also contribute to intake. The present study, which focuses exclusively on tea and herbal tea, shows that levels of 1,2-unsaturated PA in this food group have decreased significantly compared to 2016. Nevertheless, persons who consume high amounts of herbal tea or rooibos tea in the long term may still be exposed to intakes that result in a margin of exposure of less than 10,000, which is why it still seems appropriate to implement measures to reduce the levels.
Key words: pyrrolizidine alkaloids, tea, herbal infusion, risk assessment, exposure assessment
Bei Pyrrolizidinalkaloiden (PA) handelt es sich um eine große Gruppe sekundärer Pflanzeninhaltsstoffe – mehrere hundert PA und deren N-Oxide sind bislang bekannt (Wiedenfeld et al., 2008). Die Verbindungen erfüllen mehrere ökologische Funktionen. Zum einen dienen sie den Pflanzen als Schutzmechanismus gegen Fraßfeinde, daneben fungieren sie aber beispielsweise auch als Lockstoff für bestimmte Insekten (Wink, 2019). Auf Grundlage chemotaxonomischer Überlegungen wird davon ausgegangen, dass PA weltweit in mehr als 6000 verschiedenen Pflanzenspezies vorkommen (Teuscher und Lindequist, 2010). Die PA-bildenden Pflanzen gehören vornehmlich den Familien der Korbblütler (Asteraceae), der Rauhblatt- oder Borretschgewächse (Boraginaceae) und der Hülsenfrüchtler (Fabaceae oder Leguminosae) an (Smith und Culvenor, 1981). In PA-bildenden Pflanzenarten kommen sehr viele strukturell unterschiedliche PA vor. Insbesondere einige Boraginaceen-Arten weisen eine hohe strukturelle Vielfalt auf (These et al., 2013). Die genaue Zusammensetzung der PA-Profile sowie die Gehalte können auch in der gleichen Pflanzenart, in Abhängigkeit beispielsweise von den Wachstumsbedingungen sowie dem Alter der Pflanze, variieren. Darüber hinaus können verschiedene Pflanzenteile unterschiedlich hohe Gehalte aufweisen (Allgaier und Franz, 2015).
Aus chemischer Sicht handelt es sich bei PA um Ester aus einer Necinbase (1-Hydroxymethylpyrrolizidin-Grundgerüst) und Necinsäuren (aliphatischen Mono- oder Dicarbonsäuren). Sie können als Monoester (Veresterung der Hydroxylgruppe am C9) oder als Diester (Veresterung einer weiteren Hydroxylgruppe am C7) vorliegen. Erfolgt die Veresterung beider Carboxylgruppen durch eine Dicarbonsäure, so entsteht ein zyklischer Diester. Je nach Struktur der Necinbase werden im Wesentlichen PA vom Retronecin-, Heliotridin-, Otonecin- oder Platynecin-Typ unterschieden (Abb. 1). Während die ersten drei Typen eine Doppelbindung zwischen Position C1 und C2 aufweisen, handelt es sich beim Platynecin-Typ um eine gesättigte Necinstruktur. PA vom Retronecin- und Heliotridin-Typ unterscheiden sich nur dadurch, dass es sich bei ihnen um Diastereomere an Position C7 handelt (Hartmann und Witte, 1995).
Es ist bereits seit vielen Jahrzehnten bekannt, dass bestimmte PA ein toxisches Potenzial aufweisen. Toxikologische Relevanz besitzen dabei in erster Linie die 1,2-ungesättigten PA, die außerdem mindestens eine verzweigte Necinsäure enthalten. Zu diesen Verbindungen zählen die PA des Retronecin-, Heliotridin- und Otonecin-Typs, nicht jedoch die gesättigten PA des Platynecin-Typs. Von letzteren wird gemeinhin angenommen, dass sie eine geringe Toxizität aufweisen (IPCS/INCHEM, 1988; Wiedenfeld et al., 2008; Ruan et al., 2013; Allgaier und Franz, 2015; Fu, 2017).
Bei Weidevieh werden immer wieder schwere und häufig letal verlaufende Vergiftungen beobachtet, nachdem die Tiere Wildkräuter aufgenommen haben, die 1,2-ungesättigte PA bilden (Fu et al., 2017; Panziera et al., 2018). Derartige vergiftungsbedingte Erkrankungen sind beispielsweise unter den Namen „Walking disease“ (USA), „Dunziekte“ (Südafrika), „Winton disease“ (Neuseeland) oder „Schweinsberger Krankheit“ (Deutschland) bekannt. Bei Schlachtrindern, die Alpenkreuzkraut über Heu und Silage aufgenommen haben, wurde das gehäufte Auftreten von Leberzirrhosen beschrieben. Bei Pferden wurden mit Leberdegeneration einhergehende Erkrankungen, die Seneciosen oder auch die „Zdárer Pferdeseuche“, beobachtet (Petzinger, 2011a, b).
Beim Menschen werden immer wieder schwere Vergiftungen mit zum Teil tödlichem Ausgang nach Aufnahme großer Mengen an 1,2-ungesättigten PA berichtet. In den letzten Jahrzehnten sind beispielsweise in Afghanistan mehrere tausend Fälle von endemisch auftretenden Vergiftungen dokumentiert worden, die durch Verzehr von Getreide, das mit 1,2-ungesättigten PA kontaminiert war, verursacht wurden. Die Kontaminationen wurden dabei durch eine starke Ausbreitung von Pflanzen der Gattung Heliotropium in den Getreidefeldern verursacht (Molyneux et al., 1991; Kakar et al., 2010). Gerade im asiatischen Raum werden Vergiftungen zudem mit der Aufnahme bestimmter Kräuter in Verbindung gebracht, die dort im Rahmen der traditionellen chinesischen Medizin Anwendung finden und entweder selbst 1,2-ungesättigte PA enthalten oder aber mit PA-haltigen Kräutern verwechselt werden bzw. mit diesen kontaminiert sind (Dai et al., 2007; Ma et al., 2018; Zhuge et al., 2019).
1,2-ungesättigte PA können über verschiedene Wege in die Lebensmittelkette gelangen. Zum einen kann es bei der Ernte pflanzlicher Erzeugnisse wie Tee zu einer Kontamination durch PA-haltige Wild- oder Beikräuter kommen; zum anderen werden gelegentlich auch Pflanzen, die selbst 1,2-ungesättigte PA bilden, als Lebensmittel verwendet. Ein Beispiel: Borretsch, der 1,2-ungesättigte PA bildet, gilt als charakteristische Gewürzpflanze in der „Frankfurter Grünen Soße“. Auch pflanzenbasierte Nahrungsergänzungsmittel (NEM) können auf der Basis von Pflanzen und Pflanzenteilen oder -Extrakten hergestellt sein, die selbst 1,2-ungesättigte PA bilden. Daneben ist prinzipiell außerdem ein Übergang aus belasteten Futtermitteln in tierische Lebensmittel (Fleisch, Milch und Eier) möglich.
In der im Jahr 2016 durch das Bundesinstitut für Risikobewertung (BfR) veröffentlichten Bewertung stellte der Verzehr von kontaminiertem Tee und Kräutertee die wesentliche Expositionsquelle für die Bevölkerung gegenüber 1,2-ungesättigten PA in Deutschland dar. Daher fokussiert sich der vorliegende Artikel auf diese Lebensmittelgruppe. Es soll an dieser Stelle aber ausdrücklich darauf hingewiesen werden, dass für die Bewertung möglicher gesundheitlicher Risiken grundsätzlich die Gesamtexposition gegenüber diesen Pflanzentoxinen über alle Lebensmittel herangezogen werden muss.
Der Metabolismus 1,2-ungesättigter PA sowie ihrer N-Oxide umfasst sowohl toxifizierende als auch detoxifizierende Schritte (Fu et al., 2004; Wiedenfeld et al., 2008). Die Toxizität einzelner 1,2-ungesättigter PA hängt vermutlich maßgeblich davon ab, welche der beiden metabolischen Routen (entgiftende Route und Ausscheidung oder Toxifizierung) quantitativ dominiert.
Zu den entgiftenden Reaktionen gehört zum einen die durch Esterasen katalysierte Hydrolyse der Ester (Abb. 2). Die Metaboliten in Form der Necinbase und der Necinsäuren scheinen toxikologisch keine Relevanz zu besitzen; sie werden aufgrund ihrer guten Wasserlöslichkeit rasch ausgeschieden (Fu et al., 2004; Allgaier und Franz, 2015). Die Hydrolysierbarkeit 1,2-ungesättigter PA durch Esterasen hat somit einen direkten Einfluss auf deren Toxizität. Da Ester mit stark verzweigten Necinsäuren aufgrund der sterischen Hinderung schlechter hydrolysiert und ausgeschieden werden, können diese Verbindungen prinzipiell eine höhere Toxizität aufweisen (Mattocks, 1982; Wiedenfeld et al., 2008). Bei den 1,2-ungesättigten PA vom Retronecin- und Heliotredin-Typ stellt die durch Cytochrom-P-450-Monooxygenasen (CYP) und/oder Flavin-abhängige Monooxygenasen (FMO) vermittelte N-Oxidation einen weiteren entgiftenden Pfad dar (Abb. 2). Die N-Oxide sind ebenfalls gut wasserlöslich und werden i.d.R. schnell mit dem Urin ausgeschieden. Nach oraler Aufnahme können N-Oxide allerdings durch Reduktasen im Darm oder in der Leber zur reduzierten Form der Alkaloide toxifiziert werden (Allgaier und Franz, 2015; Yang et al., 2017).
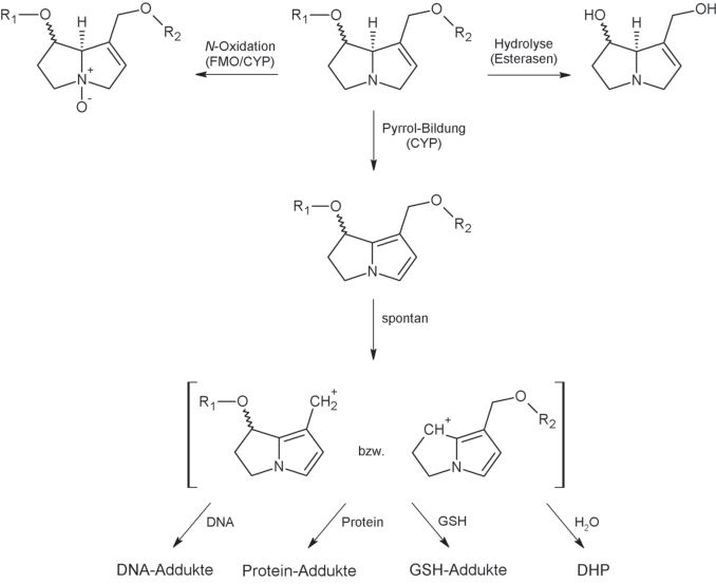
Abb. 2. Wesentliche metabolische Pfade 1,2-ungesättigter PA, einschließlich deren Toxifizierung zu reaktiven Pyrrol-Estern. R1 und R2: Necinsäuren; FMO: Flavin-abhängige Monooxygenasen; CYP: Cytochrom-P-450-Monooxygenasen; GSH: Glutathion; DHP: (±)-6,7-Dihydro-7-hydroxy-1-hydroxymethyl-5H-pyrrolizin.
Die Toxifizierung 1,2-ungesättigter PA wird ebenfalls durch Enzyme des Cytochrom-P-450-Systems vermittelt. Dabei scheinen beim Menschen insbesondere CYP3A4, CYP3A5 und CYP2A6, aber auch andere CYP-Enzyme, die Giftungsreaktion zu katalysieren (Ruan et al., 2014). Nach Hydroxylierung der Necinbase und anschließend spontan ablaufender Abspaltung von Wasser kommt es zur Bildung eines aromatischen Pyrrol-Systems, welches verhältnismäßig instabil ist. Unter spontaner Abspaltung der Necinsäuren kommt es zur Ausbildung hochreaktiver Carbokationen, die starke Alkylantien darstellen. Diese Intermediate können z.B. an nukleophile Strukturen von Proteinen bzw. der DNA binden, was zur Bildung von Protein- bzw. DNA-Addukten führt (Abb. 2). Außerdem kann es zur Quervernetzung dieser Strukturen unter Bildung von Protein-DNA-Crosslinks und DNA-DNA-Crosslinks kommen (Fu, 2017). Diese kovalenten Modifikationen an Biomolekülen können zu einer Schädigung der Zelle führen. In der Konsequenz kann es u. a. zu einem Absterben der Zelle oder zu Fehlern am genetischen Material kommen. Die Bildung der reaktiven Pyrrol-Metaboliten wird daher als primäre Ursache sowohl für die nicht-neoplastische Schädigung der sinusoidalen Endothelien in der Leber als auch für die genotoxisch-kanzerogenen Wirkungen angesehen (Fu et al., 2004; Wiedenfeld et al., 2008; Allgaier und Franz, 2015; Fu, 2017; Ma et al., 2018). Der genaue Mechanismus der durch die Pyrrol-Verbindungen vermittelten Schädigung ist aber noch nicht in jedem Detail verstanden.
Neben der beschriebenen Alkylierung von Biomolekülen können die reaktiven Pyrrol-Ester auch durch spontane Reaktion mit Wasser zum racemischen (±)-6,7-Dihydro-7-hydroxy-1-hydroxymethyl-5H-pyrrolizin (DHP) hydrolysiert werden (Abb. 2), welches im Vergleich mit den Pyrrol-Estern weniger reaktiv ist, aber immer noch alkylierende Eigenschaften besitzt (Fu et al., 2004; Xia et al., 2018). Außerdem können die reaktiven Pyrrol-Verbindungen mit reduziertem Glutathion (GSH) reagieren (Abb. 2) (Xia et al., 2015; Chen et al., 2016). Insbesondere letztere Reaktion gilt prinzipiell als Entgiftungsmechanismus. Dabei ist allerdings zu beachten, dass neuere Erkenntnisse darauf hindeuten, dass die gebildeten GSH-Addukte, wie auch weitere potenzielle Pyrrol-Metaboliten, selbst eine gewisse Reaktivität aufweisen. So konnten Xia et al. im Zellkulturmodell zeigen, dass es auch durch verschiedene Metaboliten (u. a. 7,9-Di-Valin-DHP, 7-Valin-DHP, 7-GSH-DHP, 7-Cystein-DHP, Dehydroretronecin) zur Bildung charakteristischer DNA-Addukte kommen kann (Xia et al., 2018). Derartige Metaboliten verfügen im Vergleich zu den primär gebildeten Pyrrol-Estern über eine höhere Stabilität und bessere Wasserlöslichkeit und könnten daher in die Peripherie transportiert werden und dort zu vergleichbaren Schädigungen führen, wie sie auch in der Leber beobachtet werden (Xia et al., 2018). Alternativ erscheint es zudem möglich, dass die metabolische Aktivierung 1,2-ungesättigter PA in gewissem Umfang auch in bestimmten extrahepatischen Geweben stattfindet, was ebenfalls zur dort auftretenden Toxizität beitragen könnte.
Die Leber ist das primäre Zielorgan für Schädigungen durch 1,2-ungesättigte PA, was vermutlich durch die insbesondere dort ablaufende Aktivierung zu reaktiven Pyrrol-Estern bedingt ist. Jedoch können die Lunge oder andere Organe ebenfalls betroffen sein. Die Exposition gegenüber 1,2-ungesättigten PA kann sowohl zu nicht-neoplastischen Schädigungen als auch zu genotoxisch-kanzerogenen Wirkungen führen. Bei höheren Dosen wurden im Tierversuch mit 1,2-ungesättigten PA außerdem entwicklungstoxische Effekte beobachtet (Fu et al., 2004; Chen et al., 2010; Edgar et al., 2014; Allgaier und Franz, 2015).
Die nicht-neoplastischen Schädigungen äußern sich bei Mensch und Tier insbesondere in Form des sog. hepatic sinusoidal obstruction syndrom (HSOS), welches synonym auch als hepatic veno-occlusive disease (HVOD) bezeichnet wird. Dabei kommt es zu einer Schädigung sinusoidaler Endothelzellen, was sich u. a. in einem Anschwellen und Ablösen der betroffenen Zellen äußert. Dies führt zu einer Veränderung und Verlegung sinusoidaler Gefäße, was in der Folge zu haemorrhagischen Nekrosen des dahinter gelegenen Gewebes führen kann. Klinisch lassen sich bei den Betroffenen beispielsweise starke Bauchschmerzen, Schmerzen in der Leberregion, Anorexie, Fatigue, Aszites, Gelbsucht und Hepatomegalie beobachten. Schwere Vergiftungen verlaufen häufig letal, während bei leichten Vergiftungen eine vollständige Remission möglich ist (Allgaier und Franz, 2015; Zhuge et al., 2019). Während die Symptome nach Aufnahme sehr hoher Dosen bereits nach wenigen Stunden bis Tagen einsetzen können, wurden bei Aufnahme mittlerer Dosen Krankheitssymptomen erst nach längerer Zeit beobachtet (BfR, 2013). Insbesondere bei Nutztieren und Nagern wurde nach chronischer Exposition außerdem eine Vergrößerung der Hepatozyten mit Bildung großer, hyperchomatischer Zellkerne beobachtet, was der antimitotischen Wirkung 1,2-ungesättigter PA zugeschrieben wird (NTP, 2003; Fu et al., 2004; Wiedenfeld et al., 2008; Fu, 2017).
Neben den Wirkungen auf die Leber ist auch eine Schädigung pulmonaler Endothelzellen möglich. Dies kann in der Folge zu pulmonaler Hypertonie und in weiterer Konsequenz zu Rechtsherzhyperthrophie (Cor pulmonale) führen (Wiedenfeld et al., 2008; Edgar et al., 2014; Allgaier und Franz, 2015).
In tierexperimentellen Untersuchungen, bei denen Ratten bestimmte 1,2-ungesättigte PA mit dem Futter oder per Schlundsonde erhielten, wurde ein vermehrtes Auftreten von Tumoren beobachtet. Ein entsprechendes Krebsrisiko für den Menschen wird in Betracht gezogen (IARC, 1976; Danninger et al., 1983; IARC, 1983; IPCS/INCHEM, 1988; IARC, 2002). Daher wurden bisher bspw. Lasiocarpin, Monocrotalin und Riddelliin von der International Agency for Research on Cancer als „möglicherweise krebserzeugend beim Menschen“ klassifiziert (IARC, 2019). Für andere 1,2-ungesättigte PA fehlen belastbare Daten, die diesbezüglich eine Einordnung erlauben würden. Allerdings gibt es für zahlreiche weitere 1,2-ungesättigte PA Hinweise aus Tierstudien, dass diese Verbindungen ebenfalls ein krebserzeugendes Potential besitzen. Das primäre Zielorgan ist auch bei den kanzerogenen Wirkungen die Leber; durch 1,2-ungesättigte PA hervorgerufene Tumoren fanden sich aber bspw. auch in Lunge, Niere, Haut, Harnblase, Gehirn, Rückenmark, Pankreas und Nebenniere (Chen et al., 2010). Die aussagekräftigsten Daten zur Kanzerogenität 1,2-ungesättigter PA, insbesondere mit Blick auf die Dosis-Wirkungs-Beziehung nach oraler Aufnahme, liegen für die Verbindungen Lasiocarpin und Riddelliin vor. Für beide Verbindungen existiert jeweils eine Studie zur chronischen Toxizität, bei der das kanzerogene Potenzial der Substanzen nach oraler Aufnahme untersucht wurde. Als sensitivster Endpunkt wurde in beiden Studien eine erhöhte Inzidenz von Haemangiosarkomen der Leber identifiziert (NCI, 1978; NTP, 2003).
Für verschiedene 1,2-ungesättigte PA ist außerdem gut belegt, dass sie ein genotoxisches Potenzial besitzen. Die Verbindungen führen sowohl in vitro nach metabolischer Aktivierung als auch in vivo zu einer Schädigung der DNA (Chen et al., 2010). Außerdem konnte in Studien an Nagern bereits gezeigt werden, dass nach Behandlung mit Riddelliin sowohl das durch PA induzierte DNA-Addukt-Niveau als auch die Mutationsrate in hepatischen Leberzellen grundsätzlich mit der Haemangiosarkombildung in diesem Gewebe korrelieren (Chen et al., 2010).
Des Weiteren beobachteten Hong et al. (2003) in Riddelliin-induzierten Haemangiosarkomen gehäuft Mutationen im K-ras-Protoonkogen und eine verstärkte Expression des Tumorsupressors p53 in durch Riddelliin maligne transformierten Endothelzellen. Es wird daher angenommen, dass die genotoxischen Wirkungen 1,2-ungesättigter PA für deren kanzerogenen Eigenschaften verantwortlich sind. Die charakteristischen DNA-Addukte werden dabei als ein initialer Schritt bei der chemisch-induzierten Kanzerogenese angesehen (Fu, 2017). Der vollständige Mechanismus der in den tierexperimentellen Untersuchungen beobachteten kanzerogenen Wirkungen ist bisher aber nicht abschließend aufgeklärt.
Unterschiede hinsichtlich der Suszeptibilität für die toxischen Wirkungen 1,2-ungesättigter PA sind für verschiedene Spezies durchaus bekannt – insbesondere auch mit Blick auf die nicht-neoplastischen Wirkungen. So gelten bspw. Huhn, Ente, Pferd, Rind, Schwein, Ratte und Maus als deutlich empfindlicher als Schaf, Ziege, Kaninchen und Meerschweinchen. Daneben können quantitative Unterschiede hinsichtlich der Empfindlichkeit auch zwischen verschiedenen Tierstämmen und bei einigen Spezies zwischen den Geschlechtern beobachtet werden.
Das Auftreten nicht-neoplastischer Schädigungen nach kurz- bzw. mittelfristiger Aufnahme höherer Dosen an 1,2-ungesättigten PA über Lebensmittel ist durch zahlreiche Fallberichte auch für den Menschen gut belegt (Dai et al., 2007; Kakar et al., 2010; Molyneux et al., 2011; Ma et al., 2018; Zhuge et al., 2019). Epidemiologische Untersuchungen, die insbesondere über die mögliche kanzerogene Wirkung beim Menschen Aufschluss geben könnten, sind derzeit allerdings nicht verfügbar. Verschiedene experimentelle Befunde deuten aber darauf hin, dass die im Tiermodell beobachteten genotoxisch-kanzerogenen Wirkungen 1,2-ungesättigter PA grundsätzlich auch beim Menschen zu erwarten sind.
Da sowohl die nicht-neoplastischen als auch die genotoxisch-kanzerogenen Wirkungen 1,2-ungesättigter PA auf die Bildung reaktiver Pyrrol-Ester zurückgeführt werden (Fu, 2017; Ma et al., 2018), lässt bereits das beim Menschen beobachtete Auftreten der nicht-neoplastischen Schädigungen darauf schließen, dass die Toxifizierung zu genotoxisch-kanzerogenen Metaboliten zumindest qualitativ auch im Menschen erfolgt. Inzwischen wurde auch in mehreren Studien gezeigt, dass im Blut von Patienten mit schweren PA-induzierten Leberschäden Pyrrol-Protein-Addukte nachweisbar sind (Lin et al., 2011; Gao et al., 2015; Ruan et al., 2015; Ma et al., 2018). Diese können als Biomarker für die systemische Exposition gegenüber den toxischen Pyrrol-Metaboliten angesehen werden. In einer Studie an Ratten wurde außerdem gezeigt, dass das Niveau der PA-induzierten Pyrrol-Protein-Addukte und das Niveau der für die genotoxisch-kanzerogenen Wirkung verantwortlich gemachten DNA-Addukte grundsätzlich miteinander korrelieren (Xia et al., 2016).
Im Gesamtbild deuten die Befunde darauf hin, dass die reaktiven Pyrrol-Ester auch im Menschen in relevanten Mengen gebildet werden und sich die Ergebnisse sowohl zu den hepatotoxischen als auch zu den genotoxisch-kanzerogenen Wirkungen aus Versuchen an Ratten auf den Menschen übertragen lassen.
Eine kürzlich veröffentlichte Studie von Ning et al. (2019) deutet auf Grundlage von PBK-Modellierung (pysiologically based kinetic modeling) darauf hin, dass der Mensch im Vergleich mit der Ratte eine höhere Suszeptibilität gegenüber den hepatotoxischen Wirkungen 1,2-ungesättigter PA aufweisen könnte. Im Rahmen dieser Studie wurden aber verschiedene Annahmen gemacht, die noch nicht abschließend beurteilt werden können.
Wie bereits dargestellt, wird davon ausgegangen, dass die beobachteten Wirkungen 1,2-ungesättigter PA primär auf die Bildung reaktiver Pyrrol-Ester bzw. die durch diese bedingte Schädigung zellulärer Strukturen zurückzuführen sind (Fu, 2017; Ma et al., 2018). Die Bildung dieser toxischen Metaboliten ist prinzipiell für alle 1,2-ungesättigten PA denkbar und wurde auch schon für verschiedene Vertreter gezeigt (Xia et al., 2013). Es ist aber davon auszugehen, dass sich die Wirkstärke der verschiedenen Verbindungen in Abhängigkeit von der Struktur deutlich unterscheiden kann. Unterschiede in der toxischen Potenz wurden auch experimentell bereits nachgewiesen (Merz und Schrenk, 2016).
Im Rahmen aktueller Risikobewertungen werden die einzelnen 1,2-ungesättigten PA hinsichtlich ihrer krebserzeugenden Wirkung als Gruppe von äquipotenten Stoffen mit kumulativer Wirkung berücksichtigt, da nur wenige der bislang identifizierten 1,2-ungesättigten PA und deren N-Oxiden diesbezüglich gut untersucht wurden, sodass vergleichende Aussagen zur krebserzeugenden Wirkung einzelner PA derzeit nicht möglich sind.
Es wird aber diskutiert, wie mögliche unterschiedliche Wirkstärken von einzelnen 1,2-ungesättigter PA und ihren N-Oxiden künftig adäquat berücksichtigt werden könnten. In entsprechenden Untersuchungen wiesen bspw. die N-Oxide 1,2-ungesättigter PA im Vergleich zu den Muttersubstanzen i. d. R. eine geringere Potenz auf. Die Unterschiede können jedoch je nach Testsystem sehr unterschiedlich ausfallen (Xia et al., 2013; Field et al., 2015; Merz und Schrenk, 2016; He et al., 2017; Yang et al., 2017). Zudem können sie durch bakterielle Reduktasen im Darm (Mikrobiom) bzw. durch zelluläre Reduktasen in der Leber in die reduzierte Form überführt werden. Daher wird den N-Oxiden nach oraler Aufnahme aus konservativen Erwägungen gegenwärtig meist eine vergleichbare Toxizität wie den Muttersubstanzen zugeschrieben (Allgaier und Franz, 2015; Yang et al., 2017).
Auf der Grundlage von Daten zur akuten Toxizität in Nagern, zur Zytotoxizität in Zellkultur und zur Genotoxizität in der Taufliege Drosophila schlagen Merz und Schrenk (Merz und Schrenk, 2016) sogenannte „interim Relative Potency“-Faktoren für 1,2-ungesättigte PA und ihre N-Oxide vor (1,0 für zyklische und offenkettige Diester mit 7S-Konfiguration, 0,3 für Monoester mit 7S-Konfiguration, 0,1 für offenkettige Diester mit 7R-Konfiguration und 0,01 für Monoester mit 7R-Konfiguration, N-Oxide werden wie die Muttersubstanz behandelt), die bei der Risikobewertung berücksichtigt werden könnten. Chen et al. (2017) leiteten „interim relative potency“-Faktoren hingegen auf Basis von Daten zur Kanzerogenität für einige wenige 1,2-ungesättigte PA ab. Allemang et al. (2018) haben die Genotoxizität verschiedener 1,2-ungesättigter PA im Mikrokerntest an der humanen HepaRG-Zelllinie untersucht und schlagen diese Befunde als eine mögliche Grundlage für einen Potenzvergleich vor.
Das BfR kommt zu dem Schluss, dass die auf Basis der gegenwärtig verfügbaren Daten abgeleiteten Potenzfaktoren für die Bewertung möglicher gesundheitlicher Risiken durch Exposition gegenüber 1,2-ungesättigten PA in Lebensmitteln aus unterschiedlichen Gründen noch nicht sinnvoll eingesetzt werden können. Diese Einschätzung deckt sich mit der Beurteilung der Europäischen Behörde für Lebensmittelsicherheit (EFSA) (EFSA, 2017b).
Im Hinblick auf die Risikobewertung sind insbesondere die kanzerogenen Wirkungen bedeutsam. Grundsätzlich lässt sich für genotoxisch-kanzerogen wirkende Verbindungen nach derzeitigem Kenntnisstand keine Aufnahmemenge ableiten, bei dessen Einhaltung oder Unterschreitung gesundheitliche Risiken mit hinreichender Gewissheit ausgeschlossen werden könnten – selbst geringe Aufnahmemengen könnten prinzipiell mit einer Erhöhung des gesundheitlichen Risikos verbunden sein, insbesondere bei regelmäßiger Exposition. Die genotoxisch-kanzerogenen Risiken sind somit der sensitivste Endpunkt und stehen bei der Bewertung chronischer Risiken durch eine längerfristige Aufnahme 1,2-ungesättigter PA über Lebensmittel im Vordergrund der Betrachtung.
Zur Priorisierung der Dringlichkeit von Risikomanagementmaßnahmen wird bei genotoxisch-kanzerogenen Verbindungen in der Europäischen Union (EU) der Margin of Exposure (MOE)-Ansatz genutzt. Der MOE ist der Quotient aus einem geeigneten toxikologischen Referenzpunkt und der Exposition gegenüber der Substanz beim Menschen. Als Referenzpunkt für kanzerogen wirkende Substanzen wird üblicherweise das Benchmark Dose Lower Confidence Limit 10% (BMDL10) herangezogen, das durch mathematische Modellierung (BMD-Modellierung) geeigneter Daten zur Dosis-Wirkungs-Beziehung ermittelt wird. Das BMDL10 entspricht der unteren Grenze des Konfidenzintervalls der Dosis, die im Falle 1,2-ungesättigter PA in tierexperimentellen Untersuchungen mit einem zusätzlichen Krebsrisiko von 10% (Benchmark Dose 10%; BMD10) gegenüber der Kontrollgruppe assoziiert ist. Grundsätzlich wird für genotoxische Kanzerogene ein MOE von 10.000 oder größer mit Blick auf die öffentliche Gesundheit als wenig bedenklich – allerdings nicht unbedenklich! – angesehen und daher als niedrige Priorität für Maßnahmen des Risikomanagements erachtet. Die abschließende Entscheidung, ab welchem MOE im Einzelfall eine Besorgnis besteht und Maßnahmen einzuleiten sind, ist aber in erster Linie eine Entscheidung des Risikomanagements (EFSA, 2005).
Für die Ableitung des BMDL10 kommen stellvertretend für alle 1,2-ungesättigten PA insbesondere die Studien zur chronischen Toxizität mit Lasiocarpin (NCI, 1978) und Riddelliin (NTP, 2003) in Betracht, in denen das kanzerogene Potenzial der Substanzen nach oraler Aufnahme untersucht wurde. In beiden Studien wurde das vermehrte Auftreten von Haemangiosarkomen der Leber bei Ratten als sensitivster Endpunkt identifiziert. In ihren ursprünglichen Risikobewertungen leiteten sowohl EFSA als auch das BfR auf Grundlage der Daten zum Auftreten der Haemangiosarkome in der Studie mit Lasiocarpin einen BMDL10 von 70 μg/kg Körpergewicht (KG) als geeigneten Referenzpunkt für den MOE-Ansatz ab (EFSA, 2011; BfR, 2016b). Dabei wurden bei der Modellierung der Daten zur Dosis-Wirkungs-Beziehung die Empfehlungen des Leitfadens „Use oft the benchmark dose approach in risk assessment“ der EFSA aus dem Jahr 2009 berücksichtigt (EFSA, 2009). Im Jahr 2017 aktualisierte die EFSA ihre Bewertung. Dabei wurde auch eine erneute Modellierung der Tumordaten aus den bereits früher herangezogenen Studien mit Lasiocarpin und Riddelliin durchgeführt, wobei neue Erkenntnisse zur BMD-Modellierung, die im Frühjahr 2017 von der EFSA im Leitfaden „Update: use oft the benchmark dose approch in risk assessment“ veröffentlicht wurden (EFSA, 2017a), berücksichtigt wurden. Insbesondere wurde dabei die sog. Modellmittelung (model averaging) genutzt, bei der die Ergebnisse aller für die Modellierung angewandten mathematischen Modelle gewichtet in das Endergebnis einfließen, anstatt ein einzelnes Modell für die abschließende Referenzpunktableitung auszuwählen. Das Auftreten von Haemangiosarkomen wurde weiterhin als sensitivster Endpunkt angesehen. EFSA gelangte aber zu dem Schluss, dass die Studie mit Riddelliin gemäß den neuen Erkenntnissen zur BMD-Modellierung eine verlässlichere Modellierung der Dosis-Wirkungs-Beziehung ermöglicht und leitete daher auf Grundlage dieser Studie einen neuen BMDL10 in Höhe von 237 μg/kg KG ab. Die sich beim BMDL10 ergebenden Unterschiede resultieren vermutlich primär aus der begrenzten Qualität der für die Modellierung genutzten Daten. So war insbesondere in der Studie mit Lasiocarpin eine hohe Rate an früher substanzbedingter Mortalität zu verzeichnen, welche die Dosis-Wirkungs-Beziehung der Tumorbefunde deutlich beeinflusst haben könnte (EFSA, 2017b). Das BfR hat die neue Bewertung der EFSA geprüft und kam dabei zu dem Schluss, dass der BMDL10 in Höhe von 237 μg/kg KG eine bessere Interpretation der verfügbaren Daten darstellt und daher zukünftig als neuer Referenzpunkt für die Berechnung des MOE herangezogen werden sollte (BfR, 2018). Für die sich anschließende Risikobetrachtung in Form des MOE-Ansatzes werden die Gehaltsdaten der bestimmten 1,2-ungesättigten PA als Summe betrachtet und es wird aktuell weiterhin von einer Äquipotenz aller 1,2-ungesättigter PA hinsichtlich der kanzerogenen Wirkungen ausgegangen.
Beim Menschen liegen Fallbeschreibungen von Vergiftungen nach beabsichtigter oder versehentlicher Aufnahme PA-haltigen Pflanzenmaterials vor. So ist aus zwei relativ gut dokumentierten Vergiftungsfällen bei Kindern bekannt, dass eine tägliche Aufnahmemenge von 1–3 mg/kg KG bereits nach wenigen Tagen zu schwersten Leberschäden führen oder letal verlaufen kann. Dieser Dosisbereich charakterisiert somit Aufnahmemengen, bei denen mit dem Auftreten schwerster oder sogar tödlicher Effekte gerechnet werden muss. Die Daten können jedoch nicht genutzt werden, um eine Aufnahmemenge abzuleiten, bei der Wirkungen nach kurzfristiger Aufnahme 1,2-ungesättigter PA nicht mehr zu erwarten sind, da keine belastbaren Erkenntnisse zur Dosis-Wirkungs-Beziehung vorliegen. Diese wären aber erforderlich, um einen hinreichend sicheren Abstand zwischen der Aufnahmemenge, bei der die schwerwiegende gesundheitliche Wirkung eintritt, und der sicheren Aufnahmemenge definieren zu können.
In verschiedenen Risikobewertungen wurde das Auftreten von Hepatozytenvergrößerungen, die in einer Studie zur chronischen Toxizität mit Riddelliin bei Ratten beobachtet wurde, als ein relevanter Endpunkt zur Beurteilung nicht-kanzerogener (nicht-neoplastischer) Effekte herangezogen. Aus den Befunden der Studie wurde für diesen Endpunkt eine Dosis von 10 μg/kg KG als höchste getestete Dosis, bei der keine (adverse/gesundheitsschädliche) Wirkung zu beobachten ist (No-Observed-Adverse-Effect-Level; NOAEL), ermittelt. Unter Berücksichtigung eines Extrapolationsfaktors von 100 zur Berücksichtigung von Inter- und Intraspeziesunterschieden, wurde eine Aufnahmemenge von 0,1 μg/kg KG abgeleitet, bei deren Unterschreitung nicht-neoplastische Wirkungen durch 1,2-ungesättigte PA nicht mehr zu erwarten sind (COT, 2008; BfR, 2016b).
Dieser Wert kann in begründeten Einzelfällen hilfsweise zur Beurteilung nicht-kanzerogener Risiken herangezogen werden. Es sei aber an dieser Stelle betont, dass bei Einhaltung dieser Aufnahmemenge genotoxisch-kanzerogene Wirkungen durchaus möglich sind. Im Hinblick auf die Risikobewertung sind also stets die genotoxisch-kanzerogenen Wirkungen als der sensitivste Endpunkt bedeutsam.
Derzeit beraten die Europäische Kommission und die Mitgliedsstaaten über die Einführung von Höchstgehalten für das Vorkommen 1,2-ungesättigter PA in bestimmten Lebensmitteln, darunter in Tee- und Kräuterteeprodukten. Die diskutierten Höchstgehalte orientieren sich dabei an den gegenwärtig in Lebensmitteln vorkommenden Gehalten, die von EFSA publiziert wurden. Sie entsprechen dem 80. Perzentil der Rooibostee-, dem 90. Perzentil der Kräuterteedaten bzw. dem 98. Perzentil der Gehalte an 1,2-ungesättigten PA in Schwarzem und Grünen Tee.
Erste Methoden zum Nachweis von PA wurden bereits vor Jahrzehnten etabliert. Dabei fanden vor allem kolorimetrische Verfahren Anwendung, bei denen PA zur Visualisierung an ein Chromophor gekoppelt wurden. In Kombination mit der dünnschichtchromatographischen Trennung und nachfolgender photometrischer Quantifizierung konnten schon in den 60-iger Jahren sehr differenzierte Aussagen zu den Hauptalkaloiden in Pflanzen getroffen werden (Mattocks, 1967). Die Spezifität und die erzielbaren Nachweisgrenzen erwiesen sich für die moderne Spurenanalytik aber als ungenügend. Für den Nachweis und die Quantifizierung 1,2-ungesättigter PA in Lebensmitteln sind daher selektivere und empfindlichere Methoden entwickelt worden.
Als Detektionssystem erreicht hier die Massenspektrometrie die höchste Spezifität und Sensitivität. Seit ihrer kommerziellen Einführung ist sie die Methodik der Wahl. Zur quantitativen Bestimmung des Gesamtgehalts an 1,2-ungesättigten PA in einer Lebensmittelprobe werden grundsätzlich die Summenparameter-Analytik und die targeted-Analytik als methodische Ansätze unterschieden.
Summenparameter-Analytik. Bei der Summenparameter-Analytik werden die einzelnen 1,2-ungesättigten PA in der Probe chemisch in den gemeinsamen Grundkörper überführt, welcher im Anschluss quantitativ bestimmt wird. Dazu müssen die als N-Oxide vorliegenden 1,2-ungessättigten PA zunächst durch Reduktion zu ihren korrespondierenden tertiären Basen reduziert werden. In der Regel wird der beim Abbau entstehende Necinbasengrundkörper noch einer Derivatisierung unterzogen (Kempf et al., 2008; Cramer et al., 2013). Für die Quantifizierung wird ein isotopenmarkiertes Retronecinderivat synthetisiert und als interner Standard zur Korrektur von Aufarbeitungsverlusten und Responseunterschieden bei der Ionisierung verwendet. PA des Otonecin-Typs können mit der Summenmethode nicht erfasst werden.
targeted-Analytik. Bei der targeted-Analytik werden die Gehalte einzelner Verbindungen bestimmt und nachfolgend summiert (Beschränkung aufgrund der verfügbaren Referenzstandards). Dabei findet seit Ende der 90-iger Jahre die Flüssigchromatographie in Kombination mit der Massenspektrometrie (LC-MS/MS) eine immer größere Verbreitung und ist derzeit das meistangewandte Verfahren in der Analytik von unerwünschten Stoffen in Lebensmitteln. Begünstigt ist dieser Trend insbesondere durch die Möglichkeit der Multikomponentenanalyse.
In der targeted-Analytik von 1,2-ungesättigten PA werden hauptsächlich Tandem-Massenspektrometer (auch Triple-Quadrupole-Massenspektrometer genannt) im selected/multiple reaction monitoring (SRM, MRM) Modus genutzt. Diese Art der Detektion zeichnet sich durch eine hohe Empfindlichkeit und eine sehr hohe Spezifität aus. Ein Nachteil dieser Methodik ist, dass nur die Verbindungen in die Quantifizierung (Summenbildung) einfließen, auf die gezielt untersucht wird, wobei prinzipiell für jeden Analyten eine Referenzsubstanz verfügbar sein muss.
Eine targeted-Methode, basierend auf einem Extraktionsschritt mit leicht schwefelsaurem Wasser, einer Anreicherung mittels Festphasenextraktion und anschließender Quantifizierung mittels LC-MS/MS, wurde in einem internationalen Ringversuch zur Bestimmung 1,2-ungesättigter PA in Honig und Pflanzenmaterial validiert (BfR, 2015). Ein sensibler Schritt bei massenspektrometrischen Verfahren ist die Quantifizierung, welche häufig durch sogenannte Matrixeffekte beeinflusst wird. Matrixeffekte sind eine Bezeichnung für die unterschiedliche Effizienz der Ionisierung eines in reinem Lösungsmittel vorliegenden Analyten im Vergleich zu einem, der in einem matrixreichen Extrakt aus dem zu untersuchenden Lebensmittel vorliegt. Der Einfluss der Matrix auf die Quantifizierung kann auf verschiedenen Wegen kompensiert werden. Derzeit werden für Analyten wie die 1,2-ungesättigten PA, für die keine isotopenmarkierte Standards zur Verfügung stehen, drei Ansätze zur Kompensation dieser Matrixeffekte genutzt: die Standardaddition, die externe Kalibration über matrix matched standards oder die Matrixverdünnung.
Beim Standardadditionsverfahren werden einer Probe Aliquote mit definiert zunehmenden Konzentrationslevel an PA versetzt und diese dann analysiert. Dieses Verfahren liefert sehr valide Ergebnisse, erfordert aber einen hohen Messaufwand und führt zu einem hohen Verbrauch von Standards.
In der Methodenvalidierungsstudie wurde das Verfahren der externen Kalibration mittels einer sogenannten matrix matched calibration verwendet (BfR, 2015). Generell wird hier eine PA-freie Blankprobe mit denselben Analyseschritten aufgearbeitet wie die Proben und der so erhaltene Matrix-Blank wird dann anstelle eines Lösungsmittels zur Erstellung der Kalibriergeraden verwendet. Grundvoraussetzung und die größte Schwierigkeit bei solchen Verfahren ist, dass dem Labor passendes Blankmaterial zur Verfügung steht, das wirklich geeignet ist, auftretende Matrixeffekte zu kompensieren.
Das derzeit gängigste und einfachste Verfahren ist das sogenannte Verdünnen der Matrix. Hierbei wird eine Probe in so hohem Maße verdünnt, bis keine Matrixeffekte mehr auftreten und die Quantifizierung der Proben, unabhängig von der zu untersuchenden Matrix, gegen eine externe Kalibration in Lösemittel erfolgt. Dieses Vorgehen wird durch die enorm gesteigerte Sensitivität der Massenspektrometer ermöglicht.
Analytauswahl zur Bestimmung des „Gesamtgehalts“ an 1,2-ungesättigten PA. Mit Hilfe der im Rahmen der Lebensmittelüberwachung eingesetzten targeted-Analytik ist es derzeit nicht möglich, den Gesamtgehalt an 1,2-ungesättigten PA als Summe aller vorkommenden Einzelverbindungen zu bestimmen. Vielmehr fließen nur die Verbindungen in die Quantifizierung ein, auf die gezielt untersucht wird.
Zur Sicherstellung eines einheitlichen Vollzugs bei der Überwachung von Höchstgehalten ist es daher entscheidend, sich auf ein einheitliches Spektrum von Analyten festzulegen, um die Vergleichbarkeit der Befunde der Gehaltsbestimmungen verschiedener Untersuchungseinrichtungen zu ermöglichen. Das heißt, der zu überwachende Höchstgehalt an 1,2-ungesättigten PA muss die Summe der Einzelgehalte einer klar definierten Analyt-Auswahl abbilden. Gemäß Vorschlag des BfR sollten die in Tab. 1 dargestellten 21 1,2-ungesättigten PA zur Summenbildung herangezogen werden. Zwar wird in der Natur eine weitaus höhere Zahl an 1,2-ungesättigten PA gebildet, jedoch wird der Gesamt-PA-Gehalt in den jeweiligen Pflanzenarten durch einige wenige Hauptverbindungen („Markersubstanzen“) repräsentiert. Dies spiegelt sich auch im Kontaminationsprofil von Lebensmitteln wider. Als die Problematik der PA-Kontamination in Lebensmitteln in den Fokus der Überwachung rückte, umfassten die Methoden noch 28 Analyten. Auswertungen der Gehaltsdaten vieler Proben zeigten, dass bestimmte 1,2-ungesättigte PA nicht in quantitativ relevanten Mengen vorkommen, sodass die Methoden auf 21 Analyten reduziert wurden. Nach dem derzeitigen Stand des Wissens repräsentiert die empfohlene Analytauswahl (Tab. 1) die wichtigsten Markersubstanzen in PA-bildenden Pflanzen und eine Erweiterung der Methode auf zusätzliche PA-Verbindungen würde den analytischen Aufwand, nicht aber den quantifizierten „Gesamtgehalt“ an 1,2-ungesättigten PA signifikant erhöhen. Eine Sondersituation ergibt sich für bestimmte Stereoisomeren.
Tab. 1. Derzeit vom BfR vorgeschlagene Analytauswahl zur Überwachung der diskutierten Höchstgehalte für das Vorkommen von 1,2-ungesättigten PA in Lebensmitteln (Summe der Einzelgehalte) (BfR, 2016a).
PA | Art der Esterform | Necinbase | Natürliche Isomere |
Echimidin | Offenkettiger Diester | Retronecin | Heliosupin |
Echimidin-N-oxid | Offenkettiger Diester | Retronecin | Heliosupin-NO |
Europin | Monoester | Heliotridin |
|
Europin-N-oxid | Monoester | Heliotridin |
|
Heliotrin | Monoester | Heliotridin |
|
Heliotrin-N-oxid | Monoester | Heliotridin |
|
Intermedin | Monoester | Retronecin | Lycopsamin, Indicin, Echinatin, Rinderin |
Intermedine-N-oxid | Monoester | Retronecin | Lycopsamin-NO, Indicin-NO, Echinatin-NO, Rinderin-NO |
Lycopsamin | Monoester | Retronecin | Intermedin, Indicin, Echinatin, Rinderin |
Lycopsamin-N-oxid | Monoester | Retronecin | Intermedin-NO, Indicin-NO, Echinatin-NO, Rinderin-NO |
Lasiocarpin | Offenkettiger Diester | Heliotridin |
|
Lasiocarpin-N-oxid | Offenkettiger Diester | Heliotridin |
|
Retrorsin | Zyklischer Diester | Retronecin | Usaramin |
Retrorsin-N-oxid | Zyklischer Diester | Retronecin | Usaramin-NO |
Senecionin | Zyklischer Diester | Retronecin | Senecivernin, Integerrimin |
Senecionin-N-oxid | Zyklischer Diester | Retronecin | Senecivernin-NO, Integerrimin-NO |
Senecivernin | Zyklischer Diester | Retronecin | Senecionin, Integerrimin |
Senecivernin-N-oxid | Zyklischer Diester | Retronecin | Senecionin-NO, Integerrimin-NO |
Seneciphyllin | Zyklischer Diester | Retronecin | Spartioidin |
Seneciphyllin-N-oxid | Zyklischer Diester | Retronecin | Spartioidin-NO |
Senkirkin | Zyklischer Diester | Otonecin |
|
Vorkommen von Stereoisomeren. Häufig besitzen Naturstoffe, wie die PA, in ihrem strukturellen Aufbau sogenannte Stereozentren, an denen sich die räumliche Anordnung der Atome unterscheidet. Es liegen dann zwei in der räumlichen Ausprägung unterschiedliche Verbindungen vor, die stereoisomer zueinander sind. Mittels LC-MS/MS sind diese Isomere kaum zu unterscheiden, da sie ähnliche chromatographische Retentionszeiten haben (Co-Elution) und im Massenspektrometer dieselben Precursor- und Produkt-Ionen bilden, die sich häufig auch in der Intensitätsverteilung ähneln. Mit den derzeit angewandten Verfahren sind die Isomere nur schwer zu unterscheiden und Aussagen über das genaue Isomerenmuster in einer Probe können nicht eindeutig getroffen werden.
Durch die hohe Biodiversität der PA-bildenden Pflanzen ist auch die Vielfalt an gebildeten strukturell verwandten PA hoch. Für einige Verbindungen wird in der Natur auch eine hohe Anzahl an Isomeren gebildet. Dies soll am Beispiel der Intermedingruppe in Abb. 3 erläutert werden. Die hier gezeigte PA-Struktur besitzt vier Kohlenstoffatome an denen Stereozentren vorliegen können, sodass theoretisch das Vorkommen von 16 verschiedenen Isomeren möglich wäre. In der Literatur wurden bisher fünf Isomere beschrieben. Sowohl die Pflanzenfamilie der Asteraceae (vornehmlich Gattung Eupatorium) als auch die der Boraginaceae (fast alle Gattungen) ist in der Lage diese Isomeren zu bilden, was für die Überwachung von PA-Kontaminationen in Lebensmitteln bedeutet, dass alle fünf dieser Isomere von Relevanz sind. Das derzeit empfohlene Analytspektrum basiert in erster Linie auf Standards, die zum Zeitpunkt der Etablierung der Methoden verfügbar waren. Bezogen auf die in Abb. 3 dargestellten Verbindungen waren das Lycopsamin und Intermedin. Im Allgemeinen wurden etablierte Methoden nicht mehr um Standards erweitert, die zu einem späteren Zeitpunkt verfügbar wurden. Dies liegt daran, dass man die Vergleichbarkeit von alten und neuen PA-Gehaltsdaten in untersuchten Lebensmitteln und deren Änderungen über die Zeit erzielen wollte. Pragmatisch kann dies durch die Festlegung auf ein abgestimmtes Analytspektrum, das keinen Änderungen unterliegt, gewährleistet werden.
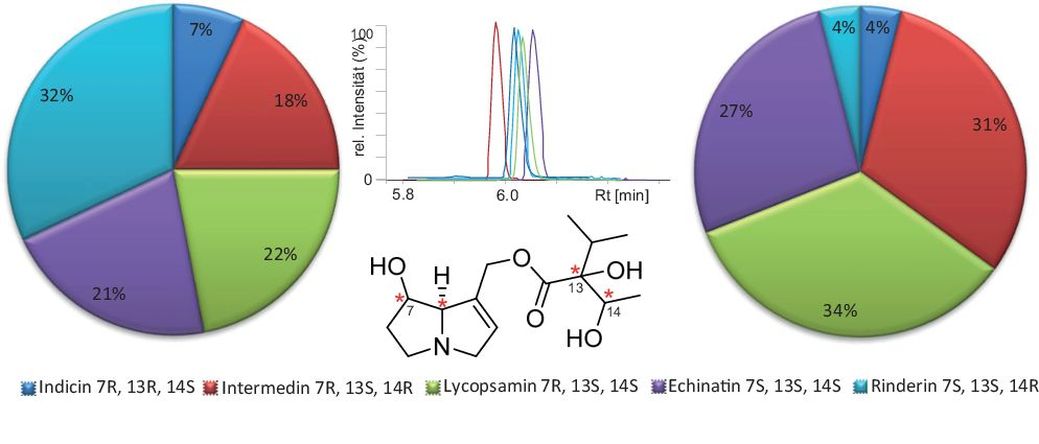
Abb. 3. Natürlich gebildete Isomere der Intermedin-Gruppe, ihr Elutionsverhalten bei reversed phase-Chromatographie sowie die Verteilung der einzelnen Isomeren in der Familie der Asteraceae (links) und Boraginaceae (rechts) (Hartmann und Witte, 1995; Dubecke et al., 2011).
Für bisher analysierte Gehaltsdaten bedeutet das aber, dass beispielsweise Proben, die mit Eupatorium kontaminiert waren, zwar hohe Anteile an Echinatin und Rinderin enthielten, diese aber als Lycopsamin und Intermedin berichtet wurden. In der Wahrnehmung und Bewertung der Häufigkeit einzelner PA-Verbindungen drückt sich dies dann so aus, dass Lycopsamin und Intermedin häufig reportiert werden, ihre Isomere aber nicht. Aus den hier dargelegten Gründen wäre für die Festlegung des Analytspektrum zur Überwachung des PA Gehaltes der pragmatischste Ansatz, die bisher ausgewählten Analyten aus Tab. 1 beizubehalten und zusätzlich die Isomere im Analytspektrum mit einzubeziehen. Dieses erweiterte Analytspektrum entspräche der bisher angewandten analytischen Praxis und würde die Vergleichbarkeit bisher erzeugter Gehaltsdaten garantieren. Außerdem wäre es der praktikabelste Weg, einen einheitlichen Vollzug in der Überwachung zu gewährleisten, da im Falle von Höchstgehaltsüberschreitungen die Labore nicht mit viel Aufwand und möglicherweise anfechtbarem Ergebnis die Abwesenheit von nicht im Analytspektrum benannten Isomeren beweisen müssen.
Als Datengrundlage hinsichtlich des Verzehrs bei Jugendlichen und Erwachsenen diente die Nationale Verzehrsstudie II (NVS II) des Max Rubner-Institutes (MRI). Die NVS II ist die aktuelle, repräsentative Studie zum Verzehr der deutschen Bevölkerung. Die Studie, bei der etwa 20.000 Personen im Alter zwischen 14 und 80 Jahren mittels drei verschiedener Erhebungsmethoden (Dietary History, 24h-Recall und Wiegeprotokoll) zu ihrem Ernährungsverhalten befragt wurden, fand zwischen 2005 und 2006 in ganz Deutschland statt (Krems et al., 2006; MRI, 2008). Die im Rahmen des vorliegenden Übersichtsartikels durchgeführten Verzehrsauswertungen beruhen auf den Daten der beiden unabhängigen 24h-Recalls der NVS II, die in einem computergestützten Interview mittels „EPIC-SOFT“ erhoben wurden. Es wurden die Daten von 13.926 Personen, von denen beide Interviews vorlagen, ausgewertet. Aufgrund des Vorliegens von Verzehrsangaben zu einzelnen Tagen ist die Methode der 24h-Recalls sowohl für Expositionsschätzungen bei akuten als auch bei chronischen Risiken geeignet. Für die Aufnahmeschätzungen wurden die individuellen Körpergewichte der Befragten zugrunde gelegt. Für die vorliegende Expositionsschätzung wurden der kurzfristige (akute) und der langfristige (chronische) Verzehr der in Tab. 2 aufgeführten Tees betrachtet. In den Daten der NVS II der 24h-Recalls wurde der Verzehr von Brennnesseltee, Fencheltee, Kamillentee und Pfefferminztee nicht explizit genannt, wobei die Vermutung nahe liegt, dass die Verzehrsmengen dieser Teesorten in denen von Kräutertee (nns) enthalten sind. Grundlage für die Expositionsschätzung waren demnach Verzehrsdaten für Früchtetee, Grünen Tee, Kräutertee (nns), Rooibostee und Schwarzen Tee, die mit den Gehaltsdaten von Früchtetee, Grünem Tee, Kräutertee (nns), Rooibostee bzw. Schwarzem Tee verknüpft wurden.
Tab. 2. Gehalte an 1,2-ungesättigten PA in Tees in μg/kg nach modifiziertem lower bound-Ansatz.
| N1 | < NWG2 (%) | Mittelwert | Median | 95. Perzentil |
Brennnesseltee | 5 | 0 | 68,00 | 42,40 | 228,45 |
Fencheltee | 71 | 59 | 2,83 | 0 | 15,27 |
Früchtetee | 22 | 77 | 0,42 | 0 | 1,74 |
Grüner Tee | 78 | 63 | 9,79 | 0 | 61,20 |
Kamillentee | 22 | 23 | 36,95 | 24,49 | 119,84 |
Kräutertee (nns3) | 135 | 21 | 143,96 | 18,50 | 535,27 |
Pfefferminztee | 58 | 57 | 21,53 | 0 | 184,79 |
Rooibostee | 93 | 8 | 98,90 | 38,00 | 476,40 |
Schwarzer Tee | 76 | 42 | 15,69 | 1,00 | 80,80 |
1Anzahl, 2Nachweisgrenze; 3nicht näher spezifiziert | |||||
Als Datengrundlage zum Verzehr für Kinder unter 5 Jahren wurden Verzehrsdaten aus der VELS-Studie (Verzehrsstudie zur Ermittlung der Lebensmittelaufnahme von Säuglingen und Kleinkindern für die Schätzung eines akuten Toxizitätsrisikos durch Rückstände von Pflanzenschutzmitteln) herangezogen (Heseker et al., 2003; Banasiak et al., 2005). Die Studie wurde zwischen 2001 und 2002 an 816 Säuglingen und Kleinkindern im Alter zwischen 6 Monaten bis unter 5 Jahren in ganz Deutschland durchgeführt. Die Eltern führten für jedes Kind zwei 3-Tage-Ernährungsprotokolle über alle verzehrten Lebensmittel. Aufgrund des Vorliegens von Verzehrsangaben zu einzelnen Tagen sind die zweimal 3-Tage-Ernährungsprotokolle sowohl für Expositionsschätzungen bei akuten als auch bei chronischen Risiken geeignet, wobei die Nutzung von wenigen Einzeltagesmessungen für die Berechnung einer lebenslangen Aufnahme mit Unsicherheiten verbunden ist, die insbesondere bei Aussagen zu detaillierten Lebensmittelgruppen oder bei Schätzungen mit einem hohen Prozentsatz Nichtverzehrer zu beachten sind. Bei der Auswertung wurde der kurzfristige (akute) und langfristige (chronische) Verzehr der Kinder, die nicht mehr gestillt wurden, betrachtet. Als Grundlage für die Expositionsschätzung standen Gehaltsdaten für Fencheltee, Früchtetee, Grünen Tee, Kamillentee, Kräutertee (nns), Pfefferminztee und Rooibostee zur Verfügung. Aufgrund der wenigen Verzehrer von Brennnesseltee wurden diese mit den Verzehrern von Kräutertee (nns) zusammengefasst und bei der Expositionsschätzung mit den Gehaltsdaten von Kräutertee (nns) verknüpft.
Für den hier vorliegenden Artikel wurden Gehaltsdaten ausgewertet, die durch die für die Lebensmittelüberwachung zuständigen Behörden der deutschen Bundesländer im Zeitraum 2015 bis 2018 erhoben worden sind.
Die Messwerte für die Einzelanalyten unter der Bestimmungs- und Nachweisgrenze (NWG) wurden mittels des modifizierten lower bound-Ansatzes angepasst. Dabei wurden jene Messwerte unter der NWG auf null und die unter der Bestimmungsgrenze auf die NWG gesetzt. Für die Summenbildung werden gemäß der oben genannten Empfehlung des BfR die Analysenergebnisse von 21 spezifischen Einzelanalyten (Tab. 1) addiert, wobei einige der Einzelanalyten bereits die Summe aus mehreren Isomeren darstellen, wie im Kapitel zur Analytik beschrieben. Die höchsten mittleren Gehalte an 1,2-ungesättigten PA wurden in Kräutertee (nns), Rooibostee und Brennnesseltee beobachtet (Tab. 2).
Um das gesundheitliche Risiko, das von der Aufnahme von mit 1,2-ungesättigten PA kontaminiertem Tee ausgeht zu beurteilen, wurde eine Expositionsschätzung entsprechend dem bei Sarvan et. al (Sarvan et al., 2017) beschriebenem Vorgehen durchgeführt.
Für die Schätzung der kurzfristigen Aufnahme 1,2-ungesättigter PA wird das 95. Perzentil der über den Befragungszeitraum individuellen höchsten Verzehrsmenge der Teeverzehrer an einem einzelnen Tag zugrunde gelegt. Diese wird mit dem 95. Perzentil der Gehalte des entsprechenden Lebensmittels multipliziert. Bei den Berechnungen wurde davon ausgegangen, dass 200 ml Teeaufguss einer Trockenmasse von 2 g entsprechen. In den Tab. 3–4 ist die kurzfristige Aufnahme 1,2-ungesättigter PA für Kinder bzw. Erwachsene durch den Verzehr der betrachteten Tees dargestellt.
Tab. 3. Kurzfristige Aufnahme 1,2-ungesättigter PA bei Kindern (0,5 bis unter 5 Jahre).
| Kurzfristige Aufnahme [μg/kg KG und Tag] (nur Verzehrer) |
Fencheltee | 0,010 |
Früchtetee | 0,001 |
Grüner Tee | 0,013 |
Kamillentee | 0,077 |
Kräutertee (nns) | 0,214 |
Pfefferminztee | 0,063 |
Rooibostee | 0,132 |
Tab. 4. Kurzfristige Aufnahme 1,2-ungesättigter PA bei Erwachsenen (Jugendliche und Erwachsene 14 bis 80 Jahre).
| Kurzfristige Aufnahme [μg/kg KG und Tag] (nur Verzehrer) |
Früchtetee | < 0,0005 |
Grüner Tee | 0,015 |
Kräutertee (nns) | 0,144 |
Rooibostee | 0,125 |
Schwarzer Tee | 0,016 |
Für alle betrachteten Tees liegt die kurzfristige Aufnahme bei Kindern und Erwachsenen (nur Verzehrer) unterhalb von 0,3 μg/kg KG und Tag (Tab. 3–4). Die höchste kurzfristige Aufnahme an PA haben Kinder über Kräutertee (nns) (0,214 μg/kg KG und Tag) gefolgt von Rooibostee (0,132 μg/kg KG und Tag). Erwachsene haben ebenfalls durch den Verzehr von Kräutertee (nns) mit 0,144 μg/kg KG und Tag sowie Rooibostee (0,125 μg/kg KG und Tag) die höchste kurzfristige Aufnahme an 1,2-ungesättigten PA.
Für die Schätzung der langfristigen Exposition wurden die mittleren Gehalte mit den Verzehrsmengen von Kindern und Erwachsenen für alle Probanden auf individueller Ebene verknüpft, wobei der Median sowie das 95. Perzentil der resultierenden Aufnahme für jede Teesorte betrachtet wurde. Ebenfalls wurde angenommen, dass 200 ml Teeaufguss einer Trockenmasse von 2 g entsprechen. Mittlere Gehalte wurden verwendet, um dem Faktor Rechnung zu tragen, dass mal höher und mal niedriger belastete Sorten der betrachteten Tees verzehrt werden. Der Median der Aufnahme bildet den Normalverzehrer und das 95. Perzentil den Vielverzehrer ab.
Die Aufnahmemengen von PA für Kinder sind in Tab. 5 und für Erwachsene in Tab. 6 auf Basis aller Befragter (95. Perzentil) sowie auf Basis der Verzehrer (Median und 95. Perzentil) für die verschiedenen Tees aufgeführt. Die Anteile von Verzehrern an der Gesamtanzahl der Befragten variieren stark sowohl zwischen den einzelnen Teesorten als z. T. auch zwischen Kindern und Erwachsenen.
Tab. 5. Mittlere Aufnahme (Monatsmittel) 1,2-ungesättigter PA über Tees bei Kindern (0,5 bis unter 5 Jahre).
Lebensmittelgruppe | Anteil Verzehrer [%] | Alle Befragte | Nur Verzehrer | |
95. Perzentil1 | Normalverzehrer | Vielverzehrer | ||
Fencheltee | 16 | < 0,0005 | < 0,0005 | 0,001 |
Früchtetee | 37 | < 0,0005 | < 0,0005 | < 0,0005 |
Grüner Tee | 1 | 0 | < 0,0005 | < 0,0005 |
Kamillentee | 4 | 0 | 0,001 | 0,008 |
Kräutertee (nns) | 9 | 0,004 | 0,005 | 0,026 |
Pfefferminztee | 9 | < 0,0005 | < 0,0005 | 0,003 |
Rooibostee | 4 | 0 | 0,002 | 0,013 |
195. Perzentil = 0, wenn Anteil Verzehrer < 5% | ||||
Tab. 6. Mittlere Aufnahme 1,2-ungesättigter PA über Tees bei Jugendlichen und Erwachsenen (14 bis 80 Jahre).
Lebensmittelgruppe | Anteil Verzehrer [%] | Alle Befragte | Nur Verzehrer | |
95. Perzentil1 | Normalverzehrer | Vielverzehrer | ||
Früchtetee | 10 | < 0,0005 | < 0,0005 | < 0,0005 |
Grüner Tee | 6 | < 0,0005 | < 0,0005 | 0,002 |
Kräutertee (nns) | 22 | 0,013 | 0,006 | 0,027 |
Rooibostee | 4 | 0 | 0,004 | 0,015 |
Schwarzer Tee | 13 | 0,001 | 0,001 | 0,002 |
195. Perzentil = 0, wenn Anteil Verzehrer < 5% | ||||
Schätzung der Aufnahme 1,2-ungesättigter PA über einzelne Tees. Der Anteil der Verzehrer der einzelnen Tees bei den Kindern liegt zwischen 1% für Grünen Tee und 37% für Früchtetee. Daraus resultiert ein Median von null bei der Betrachtung aller Befragter, weshalb dieser in Tab. 5 nicht als extra Spalte dargestellt ist. Die Aufnahmemengen für Kinder (nur Verzehrer) in der Tab. 5 zeigen, dass Kräutertee (nns) und Rooibostee bei Verzehrern des jeweiligen Tees zur höchsten Aufnahme 1,2-ungesättigter PA führen. Die Verzehreranteile der genannten Gruppen liegen dabei bei 9% bzw. 4%.
Für die Erwachsenen der NVS II kann ein Anteil der Verzehrer zwischen 4% für Rooibostee und 22% für Kräutertee (nns) verzeichnet werden. Dies resultiert ebenfalls wie bei den Kindern in einem Median von null bei der Betrachtung aller Befragter, weshalb dieser in Tab. 6 nicht als extra Spalte dargestellt ist.
Bei der Betrachtung der Aufnahme über die einzelnen Tees für Erwachsene (nur Verzehrer) führen Kräutertee (nns) und Rooibostee zur höchsten langfristigen Aufnahme 1,2-ungesättigter PA (Tab. 6). Die Verzehreranteile der genannten Lebensmittelgruppen liegen bei 22% bzw. 4%.
Schätzung der Gesamtaufnahme an 1,2-ungesättigten PA über Tee auf Basis der Verzehrer einzelner Teesorten. Werden nur die Verzehrer von Tee betrachtet, wird sichtbar, dass die Anteile an der Gesamtheit der Befragten stark variieren. Würde die Gesamtaufnahme über Tee so berechnet werden, dass als Verzehrer die Personen anzusehen sind, die irgendeinen der genannten Tees verzehren, würden Tees mit einem hohen Verzehreranteil aber niedrigen Gehalten an 1,2-ungesättigten PA zu einer Unterschätzung der Aufnahme für Verzehrer von Tees mit hohen Gehalten bei vergleichsweise geringem Verzehreranteil führen. Weiterhin ist dies problematisch, weil die Verzehreranteile in Verzehrsstudien mit wenigen Tagen systematisch unterschätzt werden. Deshalb wurden in zwei Szenarien die Verzehrer von Tee mit den höchsten Aufnahmewerten als Grundgesamtheit gewählt und für diese die Gesamtaufnahme über ihren Teeverzehr ermittelt.
Für Kinder und Erwachsene ergeben sich zwei Szenarien mit der Grundgesamtheit Verzehrer von Kräutertee (nns) bzw. Rooibostee (Tab. 7). Für die genannten Verzehrergruppen sind die jeweiligen Gesamtaufnahmen an 1,2-ungesättigten PA über Tee ermittelt worden. Der sich ergebende Median und das 95. Perzentil der resultierenden Gesamtaufnahme über Tee wurde betrachtet und dem BMDL10 (237 μg/kg KG und Tag) gegenübergestellt, um den MOE zu ermitteln (vgl. obige Ausführungen zum MOE-Konzept).
Tab. 7. Mittlere Gesamtaufnahme (Monatsmittel) 1,2-ungesättigter PA über die betrachteten Tees bei Kindern und Erwachsenen (Basis: nur Verzehrer einer Teesorte).
Basis |
| Kinder1 | Erwachsene | ||
Gesamtaufnahme | MOE2 | Gesamtaufnahme | MOE2 | ||
Verzehrer von Kräutertee (nns) | Verzehrer (%) | 9 |
| 22 |
|
Median | 0,005 | 43.841 | 0,007 | 34.901 | |
95. Perzentil | 0,026 | 9.084 | 0,028 | 8.467 | |
Verzehrer von Rooibostee | Verzehrer (%) | 4 |
| 4 |
|
Median | 0,003 | 87.840 | 0,006 | 39.673 | |
95. Perzentil | 0,014 | 16.486 | 0,026 | 9.181 | |
10,5 bis unter 5 Jahre; 2 Toxikologischer Referenzpunkt BMDL10 = 237 μg/kg KG (EFSA, 2017b), Berechnung aus tatsächlicher Aufnahme (nicht gerundet) | |||||
Verzehrer von Kräutertee (nns) weisen die höchste Gesamtaufnahme an 1,2-ungesättigten PA über Tee auf (Tab. 7). Die MOE-Werte liegen für Kinder bei 87.840 und 43.841 (Median) sowie 16.486 und 9.084 (95. Perzentil) für Rooibos- bzw. Kräutertee (nns). Für Erwachsene liegen die MOE-Werte bei 39.673 und 34.901 (Median) sowie 9.181 und 8.467 (95. Perzentil) für Rooibos- bzw. Kräutertee (nns).
Tendenziell sind die sich ergebenden MOE-Werte ähnlich, d. h. die Gesamtaufnahme an 1,2-ungesättigten PA unterscheidet sich bei Vorlieben für unterschiedliche Teesorten nicht.
Bei der vorliegenden Schätzung der Exposition wurde eine Reihe von Unsicherheiten berücksichtigt, die im Rahmen dieses Artikels nicht im Detail ausgeführt werden können. Der interessierte Leser wird daher auf die Stellungnahmen des BfR verwiesen, in denen diese ausführlich dargestellt werden.
Verunreinigungen mit 1,2-ungesättigten PA wurden in allen im Rahmen dieses Übersichtsartikels betrachteten Teesorten beobachtet (Erhebungszeitraum der Gehaltsdaten: 2015–2018). Dabei ist allerdings festzustellen, dass die Gehalte in den verschiedenen Teesorten und damit auch die Exposition im Vergleich zu den in der Stellungnahme des BfR aus dem Jahr 2016 veröffentlichten Befunden (Erhebungszeitraum der Gehaltsdaten: 2011–2015) deutlich gesunken ist. Dies zeigt, dass sich hohe Belastungen mit 1,2-ungesättigten PA durch Risikomanagementmaßnahmen und Qualitätssicherungsmaßnahmen seitens der Wirtschaftsbeteiligten vermeiden lassen.
Im Hinblick auf die chronische Exposition gegenüber 1,2-ungesättigten PA über Tee und Kräutertee zeigen die Ergebnisse der durchgeführten Expositionsschätzung, dass der Verzehr der „Sorten“ Kräutertee (nns) und Rooibostee zu einer relevanten Exposition führen kann. Schätzungen, bei denen Verzehrer von Kräutertee bzw. Rooibostee als Basis genommen, aber auch andere Teesorten anteilig in die Expositionsschätzung miteinbezogen wurden, zeigen, dass der MOE bei mittleren Verzehrsgewohnheiten sowohl bei Kindern als auch bei Erwachsenen erfreulicherweise bei deutlich über 10.000 liegt. Bei Kindern, die einen hohen Verzehr von Kräutertee (nns) haben, sinkt der MOE allerdings auf einen Wert von rund 9.100. Bei Erwachsenen Vielverzehrern ergeben sich sowohl auf Basis der Verzehrer von Kräutertee (nns) als auch von Rooibostee MOE-Werte von kleiner 10.000 (ca. 8.500 bzw. 9.200). Für Verbindungen mit genotoxisch-kanzerogenem Wirkmechanismus wird ein MOE von 10.000 oder größer mit Blick auf die öffentliche Gesundheit prinzipiell als wenig bedenklich – allerdings nicht unbedenklich! – angesehen und daher als niedrige Priorität für Maßnahmen des Risikomanagements erachtet.
Dabei sollte auch beachtet werden, dass im Rahmen dieses Artikels ausschließlich die Exposition über Tee und Kräutertee betrachtet wurde. Weitere mit 1,2-ungesättigten PA belastete Lebensmittel – z.B. Honig, NEM und Kräuter – können die Exposition erhöhen und zu entsprechend niedrigeren MOE-Werten führen. Die Gesamtaufnahme von 1,2-ungesättigten PA sollte für Verbraucherinnen und Verbraucher so gering wie möglich sein. Dazu sollten die Gehalte in Lebensmitteln gemäß dem ALARA-Prinzip (as low as reasonably achievable) so weit wie möglich gesenkt werden.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Allemang, A., C. Mahony, C. Lester, S. Pfuhler, 2018: Relative potency of fifteen pyrrolizidine alkaloids to induce DNA damage as measured by micronucleus induction in HepaRG human liver cells. Food Chemistry and Toxicology 121, 72–81, DOI: 10.1016/j.fct.2018.08.003.
Allgaier, C., S. Franz, 2015: Risk assessment on the use of herbal medicinal products containing pyrrolizidine alkaloids. Regulatory Toxicology and Pharmacology 73 (2), 494–500, DOI: 10.1016/j.yrtph.2015.09.024.
Banasiak, U., H. Heseker, C. Sieke, C. Sommerfeld, C. Vohmann, 2005: Abschätzung der Aufnahme von Pflanzenschutzmittel-Rückständen in der Nahrung mit neuen Verzehrsmengen für Kinder. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 48 (1), 84–89.
BfR, Bundesinstitut Für Risikobewertung, 2016a: Vorläufige Empfehlungen des BfR zur Analytik von Pyrrolizidinalkaloiden (PA) in Kräutertee und Tee (Analytspektrum und Probenahmeverfahren). Mitteilung Nr. 002/2016 des BfR vom 05. Januar 2016.
BfR, Bundesinstitut Für Risikobewertung, 2013: Pyrrolizidinalkaloide in Kräutertees und Tees. Stellungnahme 018/2013 des BfR vom 5. Juli 2013.
BfR, Bundesinstitut Für Risikobewertung, 2015: International collaborative study for the determination of pyrrolizidine alkaloids in honey and herbal tea by SPE-LC-MS/MS. BfR-Wissenschaft 01/2015, http://www.bfr.bund.de/cm/350/international-collaborative-study-for-the-determination-of-pyrrolizidine-alkaloids-in-honey-and-herbal-tea-by-spe-lc-ms-ms.pdf.
BfR, Bundesinstitut Für Risikobewertung, 2016b: Pyrrolizidinalkaloide: Gehalte in Lebensmitteln sollen nach wie vor so weit wie möglich gesenkt werden. Stellungnahme Nr. 030/2016 des BfR vom 28. September 2016.
BfR, Bundesinstitut Für Risikobewertung, 2018: Aktualisierte Risikobewertung zu Gehalten an 1,2-ungesättigten Pyrrolizidinalkaloiden (PA) in Lebensmitteln. Stellungnahme Nr. 020/2018 des BfR vom 14. Juni 2018.
Chen, L., P.P.J. Mulder, J. Louisse, A. Peijnenburg, S. Wesseling, I.M.C.M. Rietjens, 2017: Risk assessment for pyrrolizidine alkaloids detected in (herbal) teas and plant food supplements. Regulatory Toxicology and Pharmacology 86, 292–302.
Chen, M., L. Li, D. Zhong, S. Shen, J. Zheng, X. Chen, 2016: 9-Glutathionyl-6,7-dihydro-1-hydroxymethyl-5H-pyrrolizine Is the Major Pyrrolic Glutathione Conjugate of Retronecine-Type Pyrrolizidine Alkaloids in Liver Microsomes and in Rats. Chemical Research in Toxicology 29 (2), 180–189, DOI: 10.1021/acs.chemrestox.5b00427.
Chen, T., N. Mei, P.P. Fu, 2010: Genotoxicity of pyrrolizidine alkaloids. Journal of Applied Toxicology 30 (3), 183–196.
COT, Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment, 2008: COT Statement on Pyrrolizidine Alkaloids in Food., COT Statement 2008/06 (October 2008).
Cramer, L., H.M. Schiebel, L. Ernst, T. Beuerle, 2013: Pyrrolizidine alkaloids in the food chain: development, validation, and application of a new HPLC-ESI-MS/MS sum parameter method. Journal of Agricultural and Food Chemistry 61 (47), 11382–11391, DOI: 10.1021/jf403647u.
Dai, N., Y.C. Yu, T.H. Ren, J.G. Wu, Y. Jiang, L.G. Shen, J. Zhang, 2007: Gynura root induces hepatic veno-occlusive disease: a case report and review of the literature. World Journal of Gastroenterology 13 (10), 1628–1631, DOI: 10.3748/wjg.v13.i10.1628.
Danninger, T., U. Hagemann, V. Schmidt, P.S. Schönhöfer, 1983: Zur Toxizität pyrrolizidinalkaloidhaltiger Arzneipflanzen. Pharmazeutische Zeitung 128 (6), 289–303.
Dubecke, A., G. Beckh, C. Lullmann, 2011: Pyrrolizidine alkaloids in honey and bee pollen. Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment 28 (3), 348–358, DOI: 10.1080/19440049.2010.541594.
Edgar, J.A., R.J. Molyneux, S.M. Colegate, 2014: Pyrrolizidine alkaloids: potential role in the etiology of cancers, pulmonary hypertension, congenital anomalies, and liver disease. Chemical Research in Toxicology 28, 4–20.
EFSA, E.F.S.A.S.C., 2005: Opinion of the Scientific Committee on a request from EFSA related to a harmonised approach for risk assessment of substances which are both genotoxic and carcinogenic. Request No EFSA-Q-2004-020, adopted on 18 October 2005. The EFSA Journal, 282.
EFSA, E.F.S.A.S.C., 2009: Use of the benchmark dose approach in risk assessment: Guidance of the Scientific Committee (Question No EFSA-Q-2005-232) Adopted on 26 May 2009. EFSA Journal 1150, 1–72.
EFSA, European Food Safety Authority, 2017a: Update: use of the benchmark dose approach in risk assessment. EFSA Journal, 15(1): 4658.
EFSA, European Food Safety Authority, 2011: Scientific Opinion on Pyrrolizidine alkaloids in food and feed. EFSA Journal, 9(11): 2406.
EFSA, European Food Safety Authority, 2017b: Risks for human health related to the presence of pyrrolizidine alkaloids in honey, tea, herbal infusions and food supplements. EFSA Journal, 15(7): 4908.
Field, R.A., B.L. Stegelmeier, S.M. Colegate, A.W. Brown, B.T. Green, 2015: An in vitro comparison of the cytotoxic potential of selected dehydropyrrolizidine alkaloids and some N-oxides. Toxicon 97, 36–45, DOI: 10.1016/j.toxicon.2015.02.001.
Fu, P.P., 2017: Pyrrolizidine alkaloids: Metabolic activation pathways leading to liver tumor initiation. Chemical Research in Toxicology 30 (1), 81–93, DOI: 10.1021/acs.chemrestox.6b00297.
Fu, P.P., Q. Xia, X. He, S. Barel, N. Edery, F.A. Beland, J.A. Shimshoni, 2017: Detection of Pyrrolizidine Alkaloid DNA Adducts in Livers of Cattle Poisoned with Heliotropium europaeum. Chemical Research in Toxicology 30 (3), 851–858, DOI: 10.1021/acs.chemrestox.6b00456.
Fu, P.P., Q. Xia, G. Lin, M.W. Chou, 2004: Pyrrolizidine alkaloids – genotoxicity, metabolism enzymes, metabolic activation, and mechanisms. Drug Metabolism Reviews 36 (1), 1–55.
Gao, H., J.Q. Ruan, J. Chen, N. Li, C.Q. Ke, Y. Ye, G. Lin, J.Y. Wang, 2015: Blood pyrrole-protein adducts as a diagnostic and prognostic index in pyrrolizidine alkaloid-hepatic sinusoidal obstruction syndrome. Drug Des Devel Ther 9, 4861–4868, DOI: 10.2147/dddt.S87858.
Hartmann, T., L. Witte, 1995: Chapter 4: Chemistry, biology and chemoecology of pyrrolizidine alkaloids. In: Alkaloids: Chemical and Biological Perspectives. Ed. Pelletier, S.W., Elsevier Science, Vol. 9, S. 155–233.
He, X., Q. Xia, K. Woodling, G. Lin, P.P. Fu, 2017: Pyrrolizidine alkaloid-derived DNA adducts are common toxicological biomarkers of pyrrolizidine alkaloid N-oxides. Journal of Food and Drug Analysis 25 (4), 984–991, DOI: 10.1016/j.jfda.2017.09.001.
Heseker, H., A. Oeppining, C. Vohmann, 2003: Verzehrsstudie zur Ermittlung der Lebensmittelaufnahme von Säuglingen und Kleinkindern für die Abschätzung eines akuten Toxizitätsrisikos durch Rückstände von Pflanzenschutzmitteln (VELS). Forschungsbericht im Auftrag des Bundesministeriums für Verbraucherschutz, Ernährung und Landwirtschaft, Universität Paderborn.
Hong, H.L., T.V. Ton, T.R. Devereux, C. Moomaw, N. Clayton, P. Chan, J.K. Dunnick, R.C. Sills, 2003: Chemical-specific alterations in ras, p53, and β-catenin genes in hemangiosarcomas from B6C3F1 mice exposed to o-nitrotoluene or riddelliine for 2 years. Toxicology and Applied Pharmacology 191 (3), 227–234, DOI: 10.1016/S0041-008X(03)00165-0.
IARC, International Agency for Research on Cancer, 2019: List of Classifications. URL: https://monographs.iarc.fr/list-of-classifications.
IARC, International Agency for Research on Cancer , 1976: IARC Monographs on the evaluation of carcinogenic risk of chemicals to man. Vol. 10: Some naturally occurring substances.
IARC, International Agency for Research on Cancer , 1983: IARC Monographs on the evaluation of carcinogenic risk of chemicals to humans. Vol. 31: Some food additives, feed additives and naturally occurring substances.
IARC, International Agency for Research on Cancer, 2002: IARC Monographs on the evaluation of carcinogenic risks to humans. Vol. 82: Some traditional herbal medicines, some mycotoxins, naphthalene and styrene.
IPCS/INCHEM, WHO International Programme on Chemical Safety, 1988: Pyrrolizidine alkaloids. Environmental Health Criteria., 80.
Kakar, F., Z. Akbarian, T. Leslie, M.L. Mustafa, J. Watson, H.P. van Egmond, M.F. Omar, J. Mofleh, 2010: An outbreak of hepatic veno-occlusive disease in Western Afghanistan associated with exposure to wheat flour contaminated with pyrrolizidine alkaloids. Journal of Toxicology 2010, 1–7.
Kempf, M., T. Beuerle, M. Buhringer, M. Denner, D. Trost, K. von der Ohe, V.B. Bhavanam, P. Schreier, 2008: Pyrrolizidine alkaloids in honey: risk analysis by gas chromatography-mass spectrometry. Molecular Nutrition and Food Research 52 (10), 1193–1200, DOI: 10.1002/mnfr.200800051.
Krems, C., A. Bauch, A. Götz, T. Heuer, A. Hild, J. Möseneder, C. Brombach, 2006: Methoden der Nationalen Verzehrsstudie II. Ernährungs Umschau 53 (2), 44–50.
Lin, G., J.Y. Wang, N. Li, M. Li, H. Gao, Y. Ji, F. Zhang, H. Wang, Y. Zhou, Y. Ye, H.X. Xu, J. Zheng, 2011: Hepatic sinusoidal obstruction syndrome associated with consumption of Gynura segetum. Journal of Hepatology 54 (4), 666–673, DOI: 10.1016/j.jhep.2010.07.031.
Ma, J., Q. Xia, P.P. Fu, G. Lin, 2018: Pyrrole-protein adducts – A biomarker of pyrrolizidine alkaloid-induced hepatotoxicity. Journal of Food and Drug Analysis 26 (3), 965–972, DOI: 10.1016/j.jfda.2018.05.005.
Mattocks, A.R., 1967: Spectrophotometric determination of unsaturated pyrrolizidine alkaloids. Analytical Chemistry 39 (4), 443–447, DOI: 10.1021/ac60248a006.
Mattocks, A.R., 1982: Hydrolysis and hepatotoxicity of retronecine diesters. Toxicology Letters 14 (1–2), 111–116.
Merz, K.-H., D. Schrenk, 2016: Interim relative potency factors for the toxicological risk assessment of pyrrolizidine alkaloids in food and herbal medicines. Toxicology Letters 263, 44–57.
Molyneux, R.J., D.L. Gardner, S.M. Colegate, J.A. Edgar, 2011: Pyrrolizidine alkaloid toxicity in livestock: a paradigm for human poisoning? Additives & Contaminants. Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment 28 (3), 293–307, DOI: 10.1080/19440049.2010.547519.
Molyneux, R.J., A.E. Johnson, J.D. Olsen, D.C. Baker, 1991: Toxicity of pyrrolizidine alkaloids from Riddell groundsel (Senecio riddellii) to cattle. American Journal of Veterinary Research 52 (1), 146–151.
MRI, M.R.-I.-B.f.E.u.L., 2008: Nationale Verzehrsstudie II (NVS II). Ergebnisbericht Teil 1 und 2.
NCI, National Cancer Institute, 1978: Bioassay of lasiocarpine for possible carcinogenicity. Carcinogenesis Technical Report Series, 39 (NCI-CG-TR-39; DHEW Publication No. (NIH) 78–839).
Ning, J., L. Chen, M. Strikwold, J. Louisse, S. Wesseling, I. Rietjens, 2019: Use of an in vitro-in silico testing strategy to predict inter-species and inter-ethnic human differences in liver toxicity of the pyrrolizidine alkaloids lasiocarpine and riddelliine. Archives of Toxicology 93 (3), 801–818, DOI: 10.1007/s00204-019-02397-7.
NTP, National Toxicology Programme, 2003: NTP Technical Report on the toxicology and carcinogenesis studies of Riddelliine (CAS No. 23246-96-0) in F344/N rats and B6C3F1 mice (Gavage studies). NTP Technical Report Series, 508 (NIH Publication No. 03-4442).
Panziera, W., S.P. Pavarini, L. Sonne, C.S.L. Barros, D. Driemeier, 2018: Poisoning of cattle by Senecio spp. in Brazil: a review. Pesquisa Veterinaria Brasileira 38, 1459–1470.
Petzinger, E., 2011a: Pyrrolizidinalkaloide und die Seneciose bei Tieren Teil 1: Vorkommen, Chemie, Toxikologie. Tieraerztliche Praxis (Ausgabe Grosstiere Nutztiere) 39 (4), 221–230.
Petzinger, E., 2011b: Pyrrolizidinalkaloide und die Seneciose bei Tieren Teil 2: Klinik, Speziesunterschiede, Rückstandsverhalten, Futtermittelkontamination und Grenzwerte. Tieraerztliche Praxis (Ausgabe Grosstiere Nutztiere) 6, 363–372.
Ruan, J., H. Gao, N. Li, J. Xue, J. Chen, C. Ke, Y. Ye, P.P. Fu, J. Zheng, J. Wang, G. Lin, 2015: Blood Pyrrole-Protein Adducts--A Biomarker of Pyrrolizidine Alkaloid-Induced Liver Injury in Humans. Journal of Environmental Science and Health. Part C, Environmental Carcinogenesis & Ecotoxicology Reviews 33 (4), 404–421, DOI: 10.1080/10590501.2015.1096882.
Ruan, J., C. Liao, Y. Ye, G. Lin, 2013: Lack of metabolic activation and predominant formation of an excreted metabolite of nontoxic platynecine-type pyrrolizidine alkaloids. Chemical Research in Toxicology 27 (1), 7–16.
Ruan, J., M. Yang, P. Fu, Y. Ye, G. Lin, 2014: Metabolic activation of pyrrolizidine alkaloids: insights into the structural and enzymatic basis. Chemical Research in Toxicology 27 (6), 1030–1039, DOI: 10.1021/tx500071q.
Sarvan, I., M. Bürgelt, O. Lindtner, M. Greiner, 2017: Expositionsschätzung von Stoffen in Lebensmitteln. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 60 (7), 689–696, DOI: 10.1007/s00103-017-2566-1.
Smith, L.W., C.C.J. Culvenor, 1981: Plant sources of hepatotoxic pyrrolizidine alkaloids. Journal of Natural Products 44 (2), 129–152, DOI: 10.1021/np50014a001.
Teuscher, E., U. Lindequist, 2010: Biogene Gifte – Biologie-Chemie-Pharmakologie-Toxikologie. 3. Aufl. Stuttgart.
These, A., D. Bodi, S. Ronczka, M. Lahrssen-Wiederholt, A. Preiss-Weigert, 2013: Structural screening by multiple reaction monitoring as a new approach for tandem mass spectrometry: presented for the determination of pyrrolizidine alkaloids in plants. Analytical and Bioanalytical Chemistry 405 (29), 9375–9383.
Wiedenfeld, H., E. Roeder, T. Bouraul, J.A. Edgar, 2008: Pyrrolizidine alkaloids. Structure and toxicity. V&R Unipress, Göttingen.
Wink, M., 2019: Quinolizidine and Pyrrolizidine Alkaloid Chemical Ecology – a Mini-Review on Their Similarities and Differences. Journal of Chemical Ecology 45 (2), 109–115, DOI: 10.1007/s10886-018-1005-6.
Xia, Q., X. He, L. Ma, S. Chen, P.P. Fu, 2018: Pyrrolizidine Alkaloid Secondary Pyrrolic Metabolites Construct Multiple Activation Pathways Leading to DNA Adduct Formation and Potential Liver Tumor Initiation. Chemical Research in Toxicology 31 (7), 619–628, DOI: 10.1021/acs.chemrestox.8b00096.
Xia, Q., L. Ma, X. He, L. Cai, P.P. Fu, 2015: 7-Glutathione pyrrole adduct: A potential DNA reactive metabolite of pyrrolizidine alkaloids. Chemical Research in Toxicology 28 (4), 615–620, DOI: 10.1021/tx500417q.
Xia, Q., Y. Zhao, G. Lin, F.A. Beland, L. Cai, P.P. Fu, 2016: Pyrrolizidine alkaloid-protein adducts: potential non-invasive biomarkers of pyrrolizidine alkaloid-induced liver toxicity and exposure. Chemical Research in Toxicology 29 (8), 1282–1292.
Xia, Q., Y. Zhao, L.S. Von Tungeln, D.R. Doerge, G. Lin, L. Cai, P.P. Fu, 2013: Pyrrolizidine alkaloid-derived DNA adducts as a common biological biomarker of pyrrolizidine alkaloid-induced tumorigenicity. Chemical Research in Toxicology 26 (9), 1384–1396, DOI: 10.1021/tx400241c.
Yang, M., J. Ruan, H. Gao, N. Li, J. Ma, J. Xue, Y. Ye, P.P.C. Fu, J. Wang, G. Lin, 2017: First evidence of pyrrolizidine alkaloid N-oxide-induced hepatic sinusoidal obstruction syndrome in humans. Archives of Toxicology 91 (12), 3913–3925, Publ. online: 15 June 2017.
Zhuge, Y., Y. Liu, W. Xie, X. Zou, J. Xu, J. Wang, 2019: Expert consensus on the clinical management of pyrrolizidine alkaloid-induced hepatic sinusoidal obstruction syndrome. Journal of Gastroenterology and Hepatology 34 (4), 634–642, DOI: 10.1111/jgh.14612.