

NIRS basierte Detektion und Entfernung Pyrrolizidinalkaloid-haltiger Unkräuter aus Kulturpflanzen nach der Ernte – PA-NIRSort
NIRS-based detection and removal of pyrrolizidine alkaloid containing weeds in crop plants after harvest – PA-NIRSort
Journal für Kulturpflanzen, 72 (4). S. 88–98, 2020, ISSN 1867-0911, DOI: 10.5073/JfK.2020.04.05, Verlag Eugen Ulmer KG, Stuttgart
 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de).
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de).Pyrrolizindinalkaloide (PAs) sind lebertoxisch wirkende, sekundäre Pflanzeninhaltsstoffe, die den Pflanzen zum Schutz vor Fraßfeinden dienen. In den letzten Jahren sind PAs verstärkt in den Fokus gerückt, da sie als ungewollte Beiernte besonders in Bio- und Kindertees zu zum Teil sehr hohen Alkaloid-Belastungen führten. Inzwischen wurden strenge PA-Grenzwerte vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) publiziert, denn Arzneipflanzen können mit PA-haltigen Unkräutern wie verschiedenen Kreuzkraut-Arten, Gemeinem Natternkopf, Ackervergißmeinnicht, Gewöhnlicher Hundszunge, Wasserdost oder Borretsch verunreinigt sein und so über Arznei- oder Aroma-Tees Menschen potenziell gefährden (BfArM, 2016). Durch diese strengen Grenzwerte genügen unter Umständen vier bis fünf PA-bildende Pflanzen des Gemeinen Greiskrauts (Senecio vulgaris) je Hektar Anbaufläche, um die Verkehrsfähigkeit einer Tonne Medizinaldroge zu gefährden. Dies zu verhindern erfordert eine engmaschige regelmäßige Feldkontrolle und mechanisches Unkrautentfernen, das unter ökonomischen Aspekten kaum realisierbar ist. Daher kommt einer, der Ernte nachgelagerten Qualitätskontrolle zum Entfernen potentieller PA-Beikräuter eine besonders wichtige Rolle zu.
Ziel des im März 2019 gestarteten, von der Fachagentur für Nachwachsende Rohstoffe (FNR) geförderten Verbundprojekts des Julius Kühn-Instituts Berlin (Institut für Ökologische Chemie, Pflanzenanalytik und Vorratsschutz) und des Fraunhofer-Institut für Optronik, Systemtechnik und Bildauswertung (IOSB) ist die Entwicklung einer leistungsfähigen Detektionsmethode auf Basis von Hyperspektral-Nah-Infrarot-Spektroskopie (hyperspektral-NIRS) zur Erkennung von Verunreinigungen durch PA-haltige Pflanzen(teile) im Erntegut von Arznei- und Gewürzpflanzen. In Kombination mit einer gekoppelten Sortiereinheit (beispielsweise über Druckluftimpulse) soll so eine Abtrennung unerwünschter und potentiell toxischer Beikräuter erzielt werden. Am Ende des Projektes soll ein Prototyp zur echtzeitfähigen Reinigung der Erntechargen verschiedener Arznei- und Gewürzpflanzen vorgestellt werden. Ähnliche Systeme sind bereits in der Kunststoff-Abfallsortierung bzw. der Qualitätskontrolle von Weinbeeren auf Basis des Oechsle-Grades etabliert (Freund et al., 2015). Angestrebt wird ein Durchsatz von bis zu 1,5 t/h. Mit einer solchen automatisierten Sortiertechnik ließen sich die gesundheitlichen Risiken durch PA-verunreinigte Arzneipflanzenprodukte für die Anbauer und Verarbeiter von Arzneipflanzen ökologisch und ökonomisch effizient reduzieren. Dies würde auch eine Sicherung der qualitativ hochwertigen und konkurrenzfähigen Produktion pflanzlicher Arzneimittel in Deutschland bedeuten.
Erste Ergebnisse zeigen, dass eine Klassifizierung der Pflanzenarten mittels NIR-Spektroskopie zuverlässig möglich ist. Um solche Bildanalysen auch in Echtzeit durchführen zu können, werden die zu verarbeitenden Datenmengen mittels multifaktorieller Datenanalyse auf entscheidende spektrale Merkmale (Faktoren) reduziert.
Stichwörter: Nahinfrarotspektroskopie, Bildauswertung, Pyrrolizidinalkaloide, Arzneipflanzen, Gewürzpflanzen, Sortiertechnik, Reduktion PA-Belastung
The general objective of the project is the development of an efficient sorting system based on hyperspectral near-infrared spectroscopy (NIRS) for the detection and separation of impurities by pyrrolizidine alkaloid (PA)-containing plant-derived contaminations in cultural plants, e.g. medicinal and aromatic plants. PAs are liver-toxic secondary metabolites that protect plants from predators and have drawn more attention in recent years after harmful concentrations were found in medicinal teas. By now, the German Federal Institute for Drugs and Medical Devices (BfArM) has published strict PA limit values because medicinal plants can be contaminated with PA-containing weeds such as various types of ragwort, groundsel, common viper's head, field forget-me-not, common dog's tongue, water-east or borage and thus, potentially endanger people with medicinal or aromatic teas (BfArM, 2016). Four to five PA-containing plants e.g of Senecio vulgaris per hectare are sufficient to contaminate one ton of the drug by exceeding the critical value of maximum uptake of 0,007 μg PA/kg body weight per day published by HMPC.
The planned process will analyze fresh and dried plant material on a flat-conveyer using hyperspectral NIR spectroscopy to detect impurities in the crop. After identification, contaminants should be removed by a sorting technique, e.g. using compressed air pulses. Similar systems have already been established in plastic waste sorting and quality control, for example for grapes (Freund et al., 2015). The aim is to achieve a high throughput of up to 1.5 t/h with such an automated sorting technology, the health risks posed by PA-contaminated medicinal plant products could be reduced ecologically and economically efficient for cultivation and processing of medicinal plants. This would also mean safeguarding high-quality and competitive plant-derived drug production in Germany.
First results show that a classification of target plant species and contaminating groundsel using NIR spectroscopy succeeds for various medicinal plants. To be able to carry out such image analyses in real-time, the amount of data to be processed will be reduced to the decisive factors using multifactorial data analysis.
Key words: near infrared spectroscopy, image analysis, pyrrolizidine alkaloids, medicinal plants, aromatic plants, sorting technology, reduction of PA-contamination
Pyrrolizidinalkaloide (PAs) aus unterschiedlichen Pflanzenarten können vom Menschen mit der Nahrung (z.B. Arznei- und Gerwürzpflanzenprodukte) aufgenommen werden. Es wird angenommen, dass die PA-Abbauprodukte im Körper eine leber-toxische Wirkung entfalten und in hoher Dosierung sogar zu tödlichen Leberfunktionsstörungen führen können. Das Krankheitsbild der PA-Vergiftung wird in der Veterinärmedizin als „Seneziose“ beschrieben und wird in der Regel durch einen mehr oder weniger starken Greiskraut-/Kreuzkrautbestand auf Weiden verursacht. Im Bereich des Arznei- und Gewürzpflanzenanbaus treten PA-bildende Pflanzen als Ackerunkräuter auf und können über Mitbeerntung ungewollt in das Erntegut gelangen.
Zurzeit besteht noch kein brauchbarer Ansatz, um die PA-Kontaminations-Problematik der ungewollten Beiernte zufriedenstellend lösen zu können. Auch die im Rahmend es Code-of-Practice vorgeschlagene verstärkte analytische Kontrolle einzelner Produktionschargen wird nicht die gewünschte Sicherheit liefern können, da sich aufgrund der inhomogenen Verteilung von PA-Pflanzenbestandteilen im Erntegut die Probenahme nur begrenzt reproduzierbar durchführen lässt (BfArM und BPI, 2016). Von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) und dem BfR wurde daher empfohlen, sich behelfsmäßig an dem bestehenden Probenahmeverfahren für die amtliche Kontrolle des Mykotoxingehalts von Lebensmitteln zu orientieren (EU, 2006).
Da es momentan außer der manuellen Feldhygiene keine praktikablen Alternativen gibt, um PA-haltige Unkräuter im Feld und somit eine mögliche Mitbeerntung zu vermeiden, steht eine der Ernte nachgelagerte Reinigung im Fokus aktueller Vermeidungsstrategien. Ziel des hier vorgestellten Projekts ist es daher, ein leistungsfähiges Sortiersystem für Arzneipflanzen zu entwickeln, das PA-Unkräuter (und ggf. auch andere Fremdbestandteile) in effizienter Weise aus dem Erntegut abtrennt. Dazu soll mittels Hyperspektral-Nahinfrarotspektroskopie eine Detektionsmethode entwickelt werden, die PA-haltige Pflanzen oder Pflanzenteile im Erntegut zuverlässig erkennt. In der Literatur gibt es bereits umfassende Beispiele zum erfolgreichen Einsatz von (Nah)Infrarot- und Raman-Spektroskopie zur Unterscheidung von Pflanzenarten, Akzessionen und Chemotypen gleicher Art (Naumann et al., 2014; Gudi et al., 2014; 2015). Über Druckluftimpulse sollen die Kontaminationen dann aus dem Produkt, welches über Förderbänder zunächst die NIR-Kamera passiert, entfernt werden. Ähnliche Systeme aus optischer Detektion und druckluftgesteuerter Selektion kommen bereits für die Reinigung verschiedenster Produkt- (Weinbeerensortierung nach Grad Öchsle) und Abfallgemische (Kunststoffgemische im Recyclingprozess) zum Einsatz, so dass die technischen Voraussetzungen zur Produktion entsprechender Sortieranlagen prinzipiell gegeben sind. Durch die Vielfalt der potentiell belasteten Arzneipflanzenkulturen und kontaminierenden PA-Beikräuter, sowie unterschiedlicher Probenzustände (Frischmaterial, Drogen, unterschiedliche Materialgrößen...) sind individuelle NIRS-Modelle für die Erkennung von PA-Beikrautbesatz in den jeweiligen Zieldrogen erforderlich. Da im Rahmen dieses Projektes nicht für alle Kombinationen aus Arzneipflanzen und potentiellem PA-Bildner Sortiermethoden entwickelt werden können, werden zunächst ausgewählte Kulturen mit hohem Anbauvolumen und deren hauptsächliche PA-Kontaminanten untersucht. Dazu wurden Melisse (Melissa officinalis L.), Pfefferminze (Mentha × piperita ‘Multimentha‘) und Brennnessel (Urtica dioica) von der Industrie als wichtige Kulturen benannt. Für diese Kulturen wurde im Rahmen des ebenfalls vom BMEL und der FNR geförderten Projektes zur „Erfassung der standortabhängigen und kulturpflanzenspezifischen Beikrautflora in Arzneipflanzenbeständen unter besonderer Berücksichtigung Pyrrolizidinalkaloid-(PA-) haltiger Unkräuter und Erstellung einer PA-Unkrautdatenbank“ (FNR-Förderkennzeichen 22007914) das Gemeine Greiskraut (Senecio vulgaris) als hauptsächlicher PA-Bildner mit sehr hohen PA-Gehalten für die oben benannten Zielkulturen identifiziert (Nitzsche et al., 2018). Da Greiskraut zudem in den drei oben benannten Arzneipflanzen der häufigste PA-Bildner im Feld ist, wurde in den hier vorgestellten Untersuchungen zunächst nur dieses berücksichtigt.
Mit dem Forschungsvorhaben soll sichergestellt werden, dass der Arzneipflanzenanbau in Deutschland auch zukünftig gesundheitlich unbedenkliche und konkurrenzfähige Produkte mit hoher Qualität liefern kann, die dem Verbraucher dann in Form von Arzneitees oder pflanzlichen Arzneimitteln zur Verfügung gestellt werden können. Daher sollen mit Hilfe von Hyperspektral-NIR-Imaging (deutsch: Hyperspektrale Bildanalyse) im kurzwelligen Infrarotbereich (SWIR: 1.000 bis 2.500 nm) und entsprechender qualitativer NIR-Klassifikationen (Modelle) PA-Pflanzen schnell und zerstörungsfrei von den geernteten Arzneipflanzen bzw. Drogen diskriminiert werden. Dies bringt insgesamt eine deutliche Qualitätsverbesserung der jeweiligen pflanzlichen Drogen mit sich, da neben den PA-Kontaminanten auch andere Fremdanteile auf ein Minimum gesenkt werden könnten.
Wie sowohl die bisherigen spektroskopischen Einzelmessungen, als auch die gemischte Probenapplikation zur hyperspektralen Bildanalyse zeigen, lassen sich die jeweiligen Arzneipflanzenblätter von denen der PA-Pflanzen unterscheiden. Nun müssen relevante Spektralbereiche, die hauptsächlich zu dieser Unterscheidung führen, mittels multifaktorieller Datenanalyse identifiziert werden, um die Datenmengen auf echtzeitfähige Analyse reduzieren zu können. Erste Ergebnisse aus den Modellversuchen werden vorgestellt und diskutiert.
Die Pflanzen wurden über das JKI Quedlinburg (Dr. Frank Marthe, Institut für Züchtungsforschung an gartenbaulichen Kulturen, Erwin-Baur-Str. 27, 06484 Quedlinburg) im Gewächshaus angezogen und am 12.06.2019 auf dem Versuchsfeld des JKI Berlin (52.516181, 13.376935) ins Freiland ausgepflanzt.
Aus dem Wildbestand des JKI Berlin wurden 12 Pflanzen vereinzelt und am 12.06.2019 ebenfalls ins Versuchsfeld des JKI Berlin ausgepflanzt.
Aus dem Versuchsfeld des JKI Berlin wurde Saatgut wilder Greiskraut-Pflanzen entnommen und diese nach Aussaat und Anzucht der Pflanzen im Gewächshaus in Töpfen ins Freiland gesetzt (Aussaat 07.06.2019, Pikieren 25.06.2019, Ausbringen 09.07.2019), um möglichst gleiche Umweltbedingungen für alle Versuchspflanzen zu erzielen. Diese Maßnahme diente dazu, die Pflanzen für die Messungen in Gesamtheit und unverletzt ins Labor transportieren zu können und über die Ontogenese der Pflanzen immer wieder dasselbe, markierte Blatt zu messen. So soll die inhaltstoffliche und spektrale Varianz über die Entwicklung abgebildet werden.
Das Pflanzenmaterial für die Messungen wurde am JKI Berlin in Beeten, sowie am Fraunhofer IOSB in Karlsruhe in Containern kultiviert. Beerntet wurden die Arzneikulturen zweimalig jeweils zu Beginn der Blüte (Schnitthöhe ca. 15 cm). Die NIR-Messungen wurden jeweils am gleichen Tag im Anschluss an die Ernte durchgeführt. Um eine möglichst vergleichbare Wasserversorgung der Proben zu gewährleisten, wurden die geernteten Triebe von Melisse, Brennnessel und Pfefferminze direkt nach der Ernte in Wasser gestellt und anschließend im Verlauf einer Stunde gemessen. Für Melisse, Pfefferminze wurden jeweils 24 und für Brennnessel 12 Einzelpflanzen zu zwei verschiedenen Terminen beerntet. Je Einzelpflanze wurden 5 Blätter unterschiedlichen Alters für die Analytik ausgewählt (Melisse und Pfefferminze je N = 24/n = 240, Brennnessel N = 12/n = 120) und danach einzeln zum Trocknen ausgelegt. Die restliche Proben wurden ebenfalls getrocknet und die so erhaltenen Drogen anschließend für zukünftige Messungen in Papiertüten bei Raumtemperatur im Dunkeln gelagert. Für das Greiskraut wurde an 20 Einzelpflanzen jeweils dasselbe Blatt täglich über den Vegetationszeitraum von 2 bis 4 Wochen (erste voll ausgebildete Blätter bis Abblühen) mittels NIRS untersucht (N = 20/n = 279; 2–4 Wochen).
Die Probenblätter wurden einzeln auf das Messfenster des FT-NIR-Spektrometers (MPA, Bruker Optik GmbH, Ettlingen, Deutschland) gelegt und mit einem Edelstahlstempel leicht beschwert, um die Fläche möglichst gleichmäßig anzupressen. Vor jeder Messserie wurde ein Hintergrundspektrum aufgenommen. Die Proben wurden in Transflexion mit 32 Scans je Spektrum im Wellenzahlbereich von 12.500 – 3.600 cm–1 und einer spektralen Auflösung von 8 cm–1 gemessen. Alle Messungen fanden im Zeitraum von Juni bis August 2019 am JKI Berlin statt. Je Pflanzenart wurden insgesamt 240 bzw. 120 Blätter in einfacher Messung untersucht. Für die Untersuchung spektraler Veränderungen infolge der pflanzlichen Entwicklung wurden für die Arzneikräuter und das Greiskraut NIR-Spektren von 20 Blättern in einfacher Messung und je nach Entwicklungsstand der Pflanzen mit je 12 bis 18 Wiederholungsmessungen über den Entwicklungszeitraum von 2 bis 4 Wochen aufgenommen. Dazu wurde das Blatt nicht von der Pflanze entfernt sondern die gesamte (getopfte) Pflanze für den Transfer ins Labor und die Messungen aus dem Versuchsfeld entnommen und anschließend wieder ins Freiland verbracht.
Für die Auswertung der Spektren wurde die OPUS Spektroskopie Software Version 7.2 (Bruker Optik GmbH, Ettlingen, Deutschland) verwendet. Alle spektralen Daten wurden vor der weiteren Auswertung zentriert und die PCAn über das QUANT-Modul für PLS-Regressionen in OPUS 7.2. erstellt.
Die Hyperspektral-NIRS(HSI)-Aufnahmen wurden an einer Kamera des Typs Specim NIR über den Wellenlängenbereich von 906–2514 nm (11.037 – 3.977 cm–1) eingeteilt in 256 Kanäle (spektrale Auflösung 6,28 nm) aufgenommen. Die Proben wurden auf einem Lineartisch unter dem zeilenscannenden Sensor durchgefahren und somit eine flächige Aufnahme erzeugt. Die resultierenden Bilder haben eine Größe von 600x320 Pixeln. Parallel zu den HSI Aufnahmen wurden RGB Aufnahmen (665/525/470 nm) in der Größe von 1366x1376 ebenfalls über einen zeilenscannenden Sensor gewonnen. Die Aufnahmen werden um Meta-Informationen, z.B. Alter der Blätter, Erntezeitpunkt, enthaltene Sorten, ergänzt und in einer Datenbank archiviert. Für die Datenauswertung wurde die Programmiersprache Python und insbesondere die Bibliothek scikit-learn verwendet.
Gemeinsam mit den Projektpartnern aus der Industrie wurden Melisse (Melissa officinalis L.), Pfefferminze (Mentha × piperita ‘Multimentha‘) und Brennnessel (Urtica dioica) als erste Zielkulturen ausgewählt. Die Ergebnisse aus dem Verbundvorhaben „Erfassung der standortabhängigen und kulturpflanzenspezifischen Beikrautflora in Arzneipflanzenbeständen unter besonderer Berücksichtigung Pyrrolizidinalkaloid-haltiger Unkräuter; Teilvorhaben 1: Erfassung der Unkrautflora und Erstellung einer PA-Unkrautdatenbank“ (FKZ 22007914) zeigten die krautartigen Drogen aufgrund der Anbau- und Ernteverfahren als die Pflanzengruppe mit dem höchsten Risiko der Verunreinigung durch PA-Bildner (Nitzsche et al., 2018). Quantitativ stärkster PA-Bildner im Feldanbau war bei allen drei Kulturen jeweils das Gemeine Greiskraut (Senecio vulgaris) mit zudem höchsten PA-Gehalten. Daher wurde bei der Modellentwicklung im Rahmen dieses Projektes der Schwerpunkt zunächst auf diese Pflanzenarten gelegt und Systeme aus den Kulturen Melisse, Pfefferminze und Große Brennnessel mit dem Gemeinen Greiskraut als potentielle PA-Kontaminante ausgewählt.
Da das Gemeine Greiskraut in der Regel in allen Entwicklungsstufen als Beikraut in der Ernte auftreten kann und sich mehrfach im Jahr selbst aussät, wurde es im Topf verbleibend gemessen. So sollte ermittelt werden, ob das pflanzliche Wachstumsstadium in der Modellentwicklung berücksichtigt werden muss. Für die Zielkulturen wird zur Ernte ein entwicklungsmäßig eher einheitlicher Bestand unterstellt mit spektraler Variabilität der Blätter entlang der Sprossachse.
Der Wahl geeigneter spektraler Bereiche für die Entwicklung leistungsfähiger Klassifikationsmodelle die sich im späteren realen Einsatz auch robust gegenüber variierender Probenbeschaffenheit zeigen, kommt eine besondere Bedeutung zu.
Wie der visuelle Vergleich der Probenspektren der drei Zielkulturen und des Greiskrauts zeigt, sind die NIR-Spektren aller vier Pflanzenarten prinzipiell recht ähnlich und vorwiegend von dominanten Wasserabsorptionen um 5.200 und 7.100 cm–1 gekennzeichnet. Abbildung 1 zeigt die entsprechenden Mittelwertspektren für die vier Pflanzenarten sowie die entsprechenden Spektren der zugehörigen Standardabweichungen. Auch hier zeigen die spektralen Bereiche der Wasserbanden die höchste Variabilität. Besonders im späteren realen Verarbeitungsprozess wird es z.T. starke Schwankungen im Wassergehalt der Proben geben, da nicht immer gewährleistet werden kann, dass die Proben der Qualitätsanalytik direkt als frisches Erntegut zugeführt werden. Zudem schwankt der Wassergehalt der Pflanzen im Feld auch im Tagesverlauf und in Abhängigkeit vom Entwicklungsstadium bzw. der Witterung. Besonders für importierte getrocknete Proben mit sehr niedrigem Restfeuchtegehalt sind diese Banden von geringerem diagnostischem Wert.
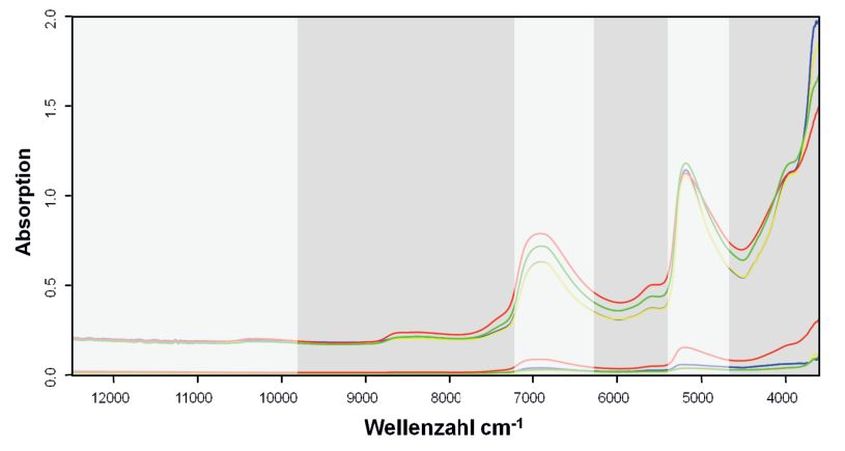
Abb. 1. Mittelwertspektren mit Standardabweichung. Je Art wurde über alle Messungen gemittelt (gelb = Melisse; grün = Pfefferminze; blau = Brennnessel; rot = Greiskraut). Die grau hinterlegten Bereiche (9.820 – 7.248 cm–1, 6.245 – 5.373 cm–1 und 4.710 – 3.822 cm–1) wurden für die weiteren Berechnungen ausgewählt.
Averaged spectra with standard deviation spectra. Average over all measurements for each species (yellow = lemon balm; green = peppermint; blue = nettle; red = groundsel). The grey areas (9,820 – 7,248 cm–1, 6,245 – 5,373 cm–1 and 4,710 – 3,822 cm–1) were selected for further calculations.
Daher wurden für die zu erstellenden Klassifizierungsmodelle die Bereiche der beiden sehr dominierenden Wasserbanden (~7.100 cm–1 und ~5.200 cm–1) herausgenommen, um eine Klassifizierung basierend auf den Wassergehalt der Proben zu vermeiden. Für die Hauptkomponentenanalyse wurden somit die Spektralbereiche von 9.820–7.248 cm–1, 6.245–5.373 cm–1 und 4.710–3.822 cm–1 zur Diskriminierung der Pflanzenarten verwendet.
Die Variabilität der verschiedenen Messreihen der Zielkulturen zeigt eine recht homogene Streuung der Einzelspektren (insgesamt 240 bzw. 120 individuelle Blätter) um das Mittelwertspektrum der individuellen Pflanzen und auch die beiden Ernten unterscheiden sich nur geringfügig in ihrer Varianz (Abb. 2, orange, grün, blau). Für die Spektren des Greiskraut hingegen zeigt sich eine deutlich breitere Streuung (Abb. 2, rot). Die Spektren mit größter Streuung sind alle Geiskrautpflanzen höheren Alters zuzuordnen, wo bereits erste Anzeichen von Welken zu beobachten war. (Messung > Tag 7). Ab Messtag 10 ließen sich bereits farbliche Veränderungen der Blätter ins Gelbliche deutlich erkennen.
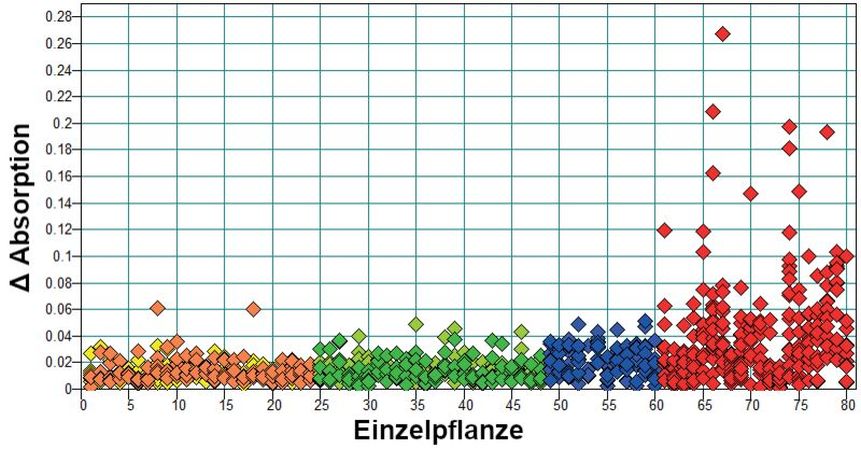
Abb. 2. Unterschied (RMS, root mean square) aller gemessenen Spektren um das jeweilige Mittelwertspektrum der Einzelpflanzen. Jede Probennummer steht für eine Einzelpflanze (EP), jeder Punkt für ein gemessenes Spektrum. Gemessen wurden je Ernte (E1 und E2) 5 Blätter pro EP bei den Zielkulturen und 12–18 Messungen pro Blatt an jeweils einer EP bei Greiskraut (gelb = Melisse E1; orange = Melisse E2; hellgrün = Pfefferminze E1; dunkelgrün = Pfefferminze E2; hellblau = Brennnessel E1; dunkelblau = Brennnessel E2; rot = Greiskraut).
Absorption differences (RMS, root mean square) of all measured spectra around the respective averaged spectrum of the individual plants. Each sample number stands for a single plant (EP), each point for a measured spectrum. The measurements per harvest (E1 and E2) were 5 leaves per EP in the target cultures and 12–18 measurements per leaf on each EP in groundsel (yellow = lemon balm E1; orange = lemon balm E2; light green = peppermint E1; dark green = peppermint E2; light blue = nettle E1; dark blue = nettle E2; red = groundsel).
In der Einzelauswertung zeigte sich, dass die spektrale Variabilität auf Ebene der Pflanzenarten den größten Beitrag zur Gesamtvariabilität liefert, selbst wenn Einzelpflanzen und unterschiedliche Ernten berücksichtigt werden. Das bedeutet, Unterschiede innerhalb der Einzelpflanzen und der beiden Ernten sind in allen untersuchten Arten geringer als die Unterschiede zwischen den Arten.
Da sich die Spektren beider Ernten der Zielkulturen nicht signifikant unterscheiden, wurde für die Berechnung der Mittelwertspektren je Arzneipflanzenart über alle Einzelmessungen gemittelt. Auch wenn sich beim Greiskraut doch eine deutlich größere Varianz der Spektren feststellen lässt, wurde auch hier über alle Messungen gemittelt (Abb. 1). Anhand der Differenzspektren von jeweils einer Zielkultur und Greiskraut kann man erkennen, dass sich außerhalb der Wasserabsorptionen in den für die PCA genutzten Bereichen spektrale Unterschiede für die Diskriminierung der Kulturen zeigen (Abb. 3).
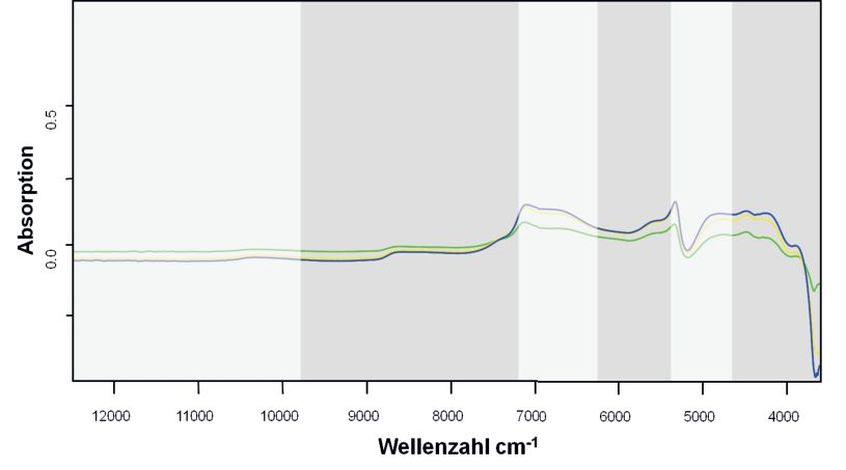
Abb. 3. Differenzen der Mittelwertspektren der drei Zielkulturen zu Greiskraut. Je Art wurde über alle Messungen gemittelt und vom Mittelwertspektrum des Greiskraut abgezogen (gelb = Melisse; grün = Pfefferminze; blau = Brennnessel). Die grau hinterlegten Bereiche (9.820 – 7.248 cm–1, 6.245 – 5.373 cm–1 und 4.710 – 3.822 cm–1) wurden für die weiteren Berechnungen ausgewählt.
Differences spectra of the average spectra of the three target cultures to groundsel. Each species was averaged over all measurements and subtracted from the mean spectrum of groundsel (yellow = lemon balm; green = peppermint; blue = nettle). The grey areas (9,820 – 7,248 cm–1, 6,245 – 5,373 cm–1 and 4,710 – 3,822 cm–1) were selected for further calculations.
Um im nächsten Schritt die Messreihen untereinander zu vergleichen, wurden zunächst alle Spektren pflanzenweise und in einem PCA-Modell betrachtet (Abb. 4). Für die Erstellung der Klassifikationsmodelle wurde dann im zweiten Schritt nur jeweils eine Zielkultur gemeinsam mit dem Greiskraut analysiert (Abb. 5).
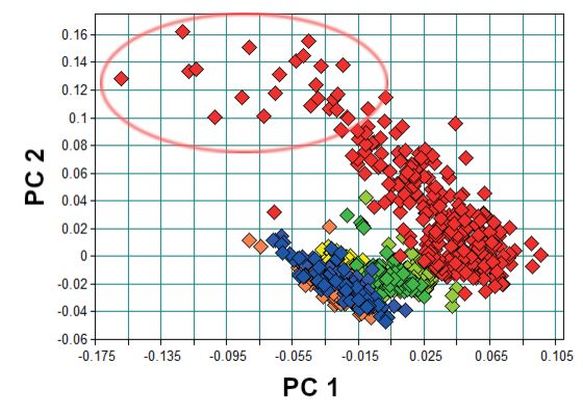
Abb. 4. PCA aller Messungen. Die Messungen im oberen Bereich (oval) sind Messungen zu einem späteren Zeitpunkt (> M7) der Ontogenese (gelb = Melisse E1; orange = Melisse E2; hellgrün = Pfefferminze E1; dunkelgrün = Pfefferminze E2; hellblau = Brennnessel E1; dunkelblau = Brennnessel E2; rot = Greiskraut, alle Altersstufen).
PCA of all measurements. The measurements in the upper area (oval) are measurements at a late developmental stage of groundsel (> M7) of ontogenesis (yellow = lemon balm E1; orange = lemon balm E2; light green = peppermint E1; dark green = peppermint E2; light blue = nettle E1; dark blue = nettle E2; red = groundsel, all ages).
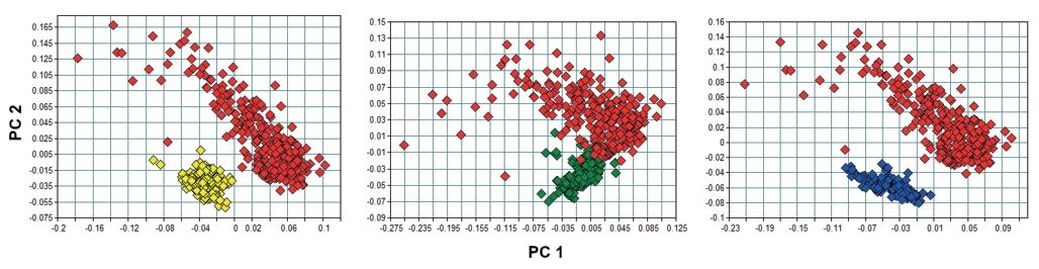
Abb. 5. PCA der drei Ziel- und Beikraut-Systeme. Links: Melisse (gelb) vs. Greiskraut (rot); Mitte: Pfefferminze (grün) vs. Greiskraut; (rot) rechts: Brennnessel (blau) vs. Greiskraut (rot).
PCA of the three target vs. weed systems. Left: lemon balm (yellow) vs. groundsel (red); centre: peppermint (green) vs. groundsel; (red) right: nettle (blue) vs. groundsel (red).
Die Hauptkomponentenanalyse der Spektren aller Pflanzenarten (Abb. 4) zeigt eine klare Trennung der Zielkulturen vom Greiskraut. Geringe Überlagerungen der Cluster von Pfefferminze (grün) und Greiskraut (rot) gibt es nur bei der frühen Ernte E1. Auch hier lässt sich die große Streuung der Greiskraut-Spektren den Messungen in der späteren Pflanzenentwicklung zuordnen (> Messung 7, kreisförmige Markierung in Abb. 4). Die hier gezeigte PCA stellt einen Extremfall in der Klassifikation dar, da insgesamt vier Pflanzenarten in annähernd gleicher Quantität in das Modell einfließen. Ein solcher Fall ist bei der realen Ernte nicht zu erwarten, dort sollte eine Kultur mengenmäßig dominieren und entsprechend den Ergebnissen der Unkrautdatenbank maximal ein PA-Beikraut in relevanter Menge auftreten. Daher werden im Folgenden binäre Systeme aus einer Zielkultur und Greiskraut betrachtet.
Im Weiteren wurden jeweils die einzelnen Zielkulturen und Greiskraut in einer Hauptkomponentenanalyse nach Zentrierung der Spektren analysiert, um die Möglichkeit einer deutlichen Diskriminierung nach Pflanzenart zu finden. Abb. 5 zeigt die entsprechenden Hauptkomponentenanalysen der drei Zielkulturen.
Wie in Abb. 5 (links) ersichtlich, trennt PC 1 die Spektren von Greiskraut (rot) klar von denen der beiden Melisse-Ernten (gelb) ab. Hauptkomponenten 2 (PC 2) trennt zudem die späten Greiskraut-Messungen (positiver Bereich von PC 2) ab. Die PCA von Brennnessel und Greiskraut (Abb. 5, rechts) zeigt eine ebenso klare Trennung der beiden Pflanzenarten, wie zuvor bei der Melisse beobachtet und legt den Erfolg einer NIR-basierten Differenzierung der Ziel- und Beikrautkulturen auf Basis der verwendeten Spektralbereiche nahe.
Anders als bei Melisse und Brennnessel zeigt die PCA bei Pfefferminze keine vollständige Clusterung beider Arten (Abb. 5, Mitte). Besonders die erste Ernte der Minze streut stärker und es finden sich Überlagerungen mit den Spektren des Greiskrauts. Hier ist eine genaue Betrachtung der Ursachen für die vergleichsweise hohe Streuung der Greiskraut-Proben nötig, um eventuell durch Eingrenzen der Spektralbereiche die Qualität der Diskriminierung zu erhöhen. Daher wird zunächst die Variabiliät der Pfefferminz- und Greiskraut-Spektren im Lauf der pflanzlichen Entwicklung näher betrachtet.
Um die spektrale Variabilität der Blätter über die pflanzliche Entwicklung abschätzen zu können, wurde exemplarisch an fünf Pfefferminzpflanzen über acht Wochen, einmal pro Woche dasselbe markierte Blatt gemessen. Jedes Blatt wurde in fünffacher Wiederholung gemessen und in der Analyse gemittelt. Die zu beobachtende Streuung um den Mittelwert des jeweils gemessenen Blattes zeigt keinen Zusammenhang mit dem Alter der Blätter (Abb. 6). In der Hauptkomponentenanalyse hingegen lässt sich ein Alterseinfluss beobachten (Abb. 7), so dass sich eine Gruppierung der Blattspektren nach Alter entlang der Hauptkomponentenachse zwei (PC 2) erkennen lässt.
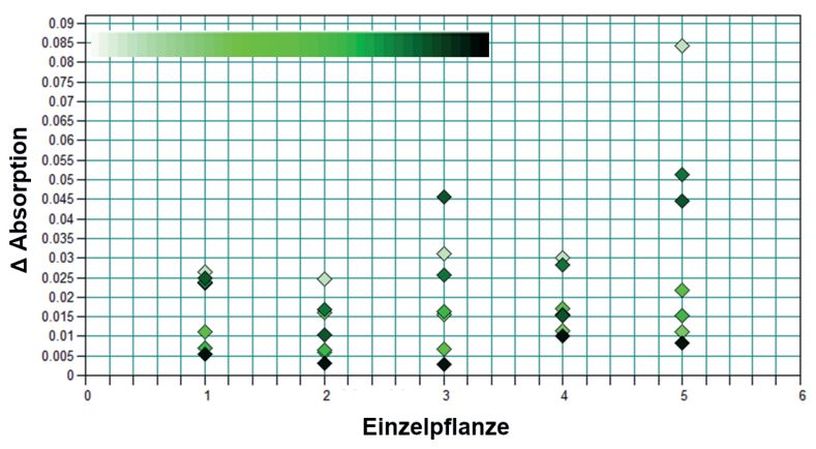
Abb. 6. RMS-Fehler (root mean square) der Spektren um das Mittelwertspektrum des jeweils gemessenen Blattes von Pfefferminze über Messreihen (M). Jeder Punkt für ein über fünf Wiederholungen gemitteltes Spektrum des jeweiligen Blattes. Der Farbcode steht für die Messreihen 1–8 (jung: hell, alt: dunkel).
Absorption differences (RMS, root mean square) of the individual spectra to the average spectrum (leaf wise) of peppermint over the entire series of measurements. Each point represents an averaged spectrum of the respective leaf over five repetitions. The color codes the measurement series 1–8 (young: light, old: dark).
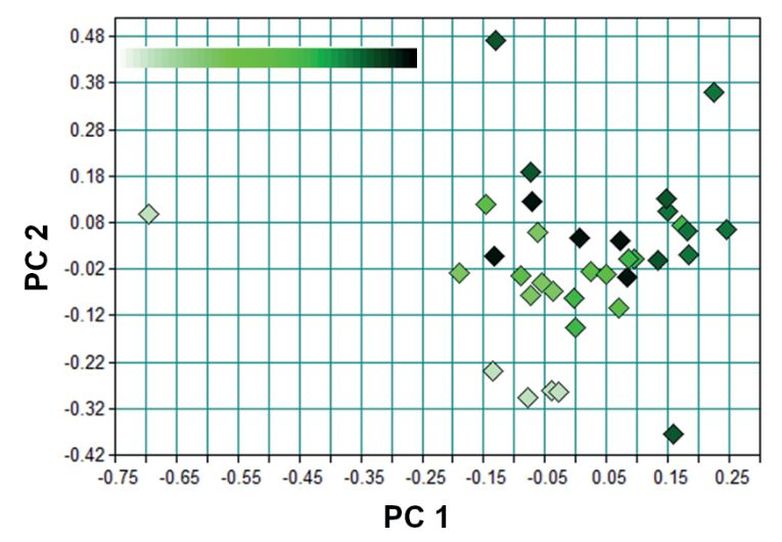
Abb. 7. PCA der Mittelwertspektren der gemessenen Blätter von Pfefferminze acht Messreihen (M). Jeder Punkt zeigt ein über fünf Messwiederholungen gemitteltes Spektrum des jeweiligen Blattes um jeweiligen Zeitpunkt 1 bis 8. Der Farbcode steht für die Messreihen 1–8 (jung: hell, alt: dunkel).
PCA of the averaged spectra of the measured leaves of peppermint for the eight measurement series. Each point represents the averaged spectrum of five repeated measures of the respective leaf. The color codes the measurement series 1–8 (young: light, old: dark).
Im Fall des Gemeinen Greiskrauts muss die Möglichkeit beachtet werden, alle Entwicklungsstadien der Pflanze (oberhalb der Erntehöhe) als Beiernte zu finden. Da sich im Laufe der Ontogenese von Pflanzen auch die Kombinationen und Konzentrationen der sekundären Pflanzenstoffe verändert (Flade et al., 2019), was auch rein optisch durch Verfärbungen sichtbar werden kann, ist zu erwarten, dass sich entwicklungsbedingte Veränderungen auf die NIR-Spektren auswirken. Daher wurden über den entsprechenden Entwicklungszeitraum Spektren derselben Blätter aufgenommen, um die damit einhergehende spektrale Variabilität zu untersuchen. Die Messungen zeigen, dass mit steigendem Alter der Pflanzen die Spektren stärker streuen (Abb. 8). Ab der zehnten Messung (05.08.2019, Tag 59 nach Aussaht) waren bereits erste gelbliche Verfärbungen der Blätter zu erkennen, die einhergehen mit steigender Streuung in den Spektren ab der siebten Messung. Diese Unterschiede bewegen sich aber in Bereichen, die nicht zu Überschneidungen mit den untersuchten Arzneipflanzen führen, sodass die messbaren Unterschiede zwischen den Arten ungeachtet des Wachstumsstadiums von Greiskraut zu finden sind. In der Hauptkomponentenanalyse (Abb. 9) ist im Gegensatz zur Pfefferminze keine klare Gruppierung nach Alter zu erkennen, da die Spektren aller Altersstufen relativ homogen im Raum von PC 1 und PC 2 verteilt sind. Ausschließlich das bereits oben diskutierte, ab Messtag 7 einsetzende Welken der Pflanzen ist in der Häufung von Spektren später Messung im negativen PC 1 und PC 2 Bereich zu beobachten.
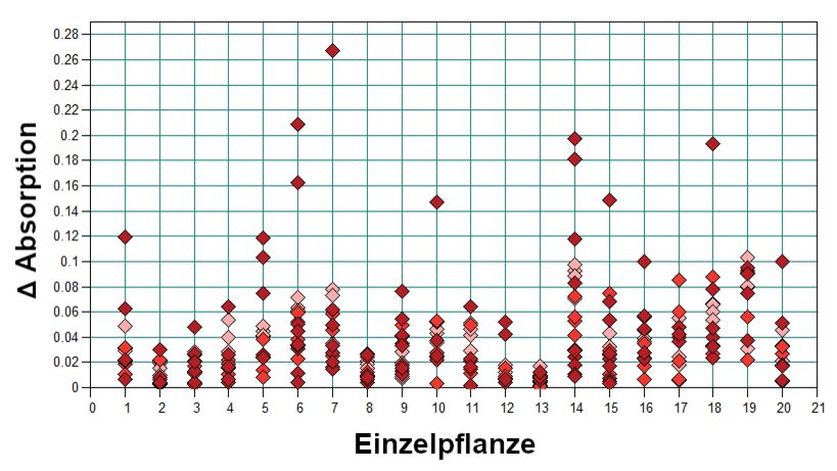
Abb. 8. RMS-Fehler (root mean square) der Spektren um das Mittelwertspektrum des jeweils gemessenen Blattes von Greiskraut über verschiedene Entwicklungsstufen (M). Jeder Punkt steht für ein gemessenes Spektrum desselben Blattes (N = 20, n = 12–18, M1-M4/jung: hellrot, M5-M8/mittel: rot, M9–18/alt: dunkelrot).
Absorption differences (RMS, root mean square) of the individual spectra to the average spectrum (leaf wise) of groundsel during plant development (M). Each point represents a measured spectrum of the same leaf (N = 20, n = 12–18, M1-M4/young: light red, M5-M8/mean: red, M9–18/old: dark red).
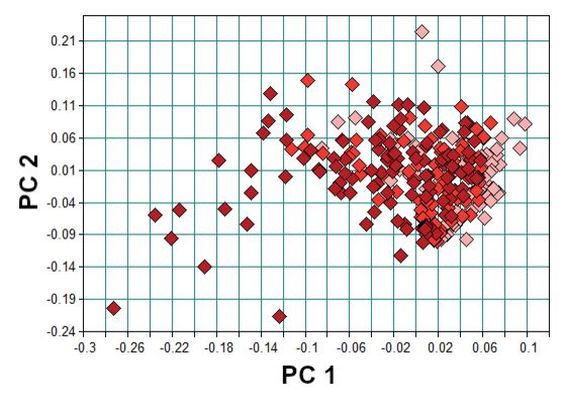
Abb. 9. PCA von Greiskraut zu verschiedenen Entwicklungsstufen (M). Jeder Punkt zeigt ein gemessenes Spektrum desselben Blattes einer Pflanze (N = 20, n = 12–18, M1-M4/jung: hellrot, M5-M8/mittel: rot, M9–18/alt: dunkelrot).
PCA of groundsel of different developmental stages (M). Each point shows a measured spectrum of the same leaf of a plant (N = 20, n = 12–18, M1-M4/young: light red, M5-M8/middle: red, M9–18/old: dark red).
Ergänzend zu den Untersuchungen auf Basis der FT-NIR Messungen wurden mittels NIR Hyperspectral Imaging (bildgebende Spektroskopie) Bilder einzelner Blätter der in Karlsruhe in Containern gezogenen Pflanzen aufgenommen und ausgewertet.
Ein exemplarisches Ergebnis ist in Abb. 10 zu sehen. Gezeigt ist eine Falschfarbendarstellung einer Mischprobe auf Basis einer pixelweisen Transformation der Spektren mittels Hauptkomponentenanalyse. Es ist deutlich zu erkennen, dass sich die PA-Beikräuter farblich von den restlichen Proben in dieser Darstellung abheben (Blautöne in Abb. 10).
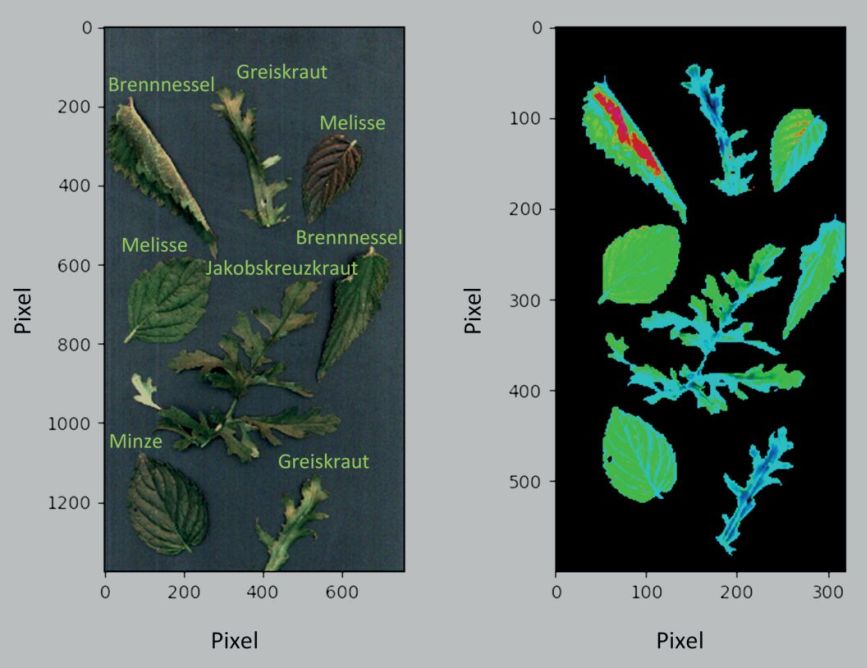
Abb. 10. Farb- und Hyperspektralbild einer Mischprobe. Links: Farbbild der Probe bestehend aus den drei Zielkulturen und zwei PA-Beikräutern. Rechts: Falschfarbendarstellung auf Basis einer pixelweisen Hauptkomponentenanalyse mit Clusterung nach Ziel- (grün) und Beikrautkultur (blaugrün).
Colour and hyperspectral image of a composite sample. Left: Color image of the sample consisting of the three target cultures and two PA weeds. Right: False color image based on a pixelwise main component analysis with clustering according to target culture (green) and weed culture (blue-green).
Alle hier vorgestellten Ergebnisse beziehen sich ausschließlich auf die Messung frischer Proben, die direkt nach der Ernte gemessen wurden und zeigen, dass die Klassifizierung mittels NIR-Spektroskopie ohne Berücksichtigung der intensivsten Wasserbanden generell möglich ist. Die gleichen Versuche müssen nun noch mit den entsprechenden Drogen durchgeführt werden um sicher zu stellen, dass dies genauso mit dem getrockneten Pflanzenmaterial möglich ist. Außerdem ist zu beachten, dass sich alle hier gezeigten Ergebnisse nicht ohne weiteres auf andere Arten übertragen lassen sondern für alle neuen Zielkulturen neue Modelle entwickelt werden müssen.
Des Weiteren besteht bei Blatt- und Blütendrogen die besondere Herausforderung, das Erntematerial zuvor in geeigneter Weise aufzubereiten (z.B. zu zerkleinern) bzw. Blätter und Blüten zu vereinzeln, während die Aufreinigung geernteter Körnerdrogen wie z.B. Fenchel- oder Kümmelfrüchte hinsichtlich des Material-Handlings geringere Probleme bereiten sollte.
Zur Risikominderung und Kostenoptimierung werden weitere optische Detektionsmethoden (z.B. Mittelinfrarot-Spektroskopie, VIS-Detektion,…) untersucht. Ebenso sollen die zur Identifikation genutzten spektralen Bereiche weiter verkleinert werden, um die zur Erkennung notwendigen Daten zu reduzieren und den Prozess auf reale Verarbeitungsströme zeitlich anzupassen.
Die nächsten Schritte beinhalten weitere Datenaufnahme von Pflanzenmaterial unterschiedlicher Trocknungsgrade und die Entwicklung individueller NIRS-basierter Kalibrationsmodelle zur qualitativen Bestimmung der einzelnen Pflanzenarten.
Zukünftig sollen erzeugte Mischproben mit definierten PA-Krautanteilen, sowie echte Ernteproben mit möglicher PA-Belastung von Arzneipflanzenanbauern und -verarbeitern beschafft und quantitativ analysiert werden. Darüber soll untersucht werden, inwieweit spezifische spektroskopische Signale mit bestimmten PA-Inhaltsstoffen korreliert werde können. Die tatsächliche Belastung mit Pyrrolizidinalkaloiden soll über konventionelle LC-MS-Analytik erfolgen und in Form von Referenzdaten für die spätere NIRS-Analytik und die Entwicklung quantitativer Modelle herangezogen werden. Hinsichtlich der Identifizierung von PA-Pflanzen ist es nicht erforderlich, dass die Pyrrolizidinalkaloide selbst diagnostische Signale geben, solange deren Quantität eindeutig mit anderen relevanten Diskriminanten korrelierbar ist.
Zudem wird geprüft, inwiefern das Schmalblättrige Greiskraut (Senecio inaequidens), welches seinen Ursprung in Südafrika hat und sich seit den 1970er Jahren rasant in Europa verbreitet hat, in weite Untersuchungen eingebunden werden kann. Es dringt als Unkraut auf Agrar- und Weideflächen und ist dort ebenfalls eine Gefahr für die Gesundheit von Mensch und Tier, sowie die Biodiversität phytophager Insekten (BfN, 2013). In der Schweiz steht sie bereits auf der schwarzen Liste invasiver Spezies und das Bundesamt für Bevölkerungsschutz stuft ihr Gefährdungspotential als „groß“ ein (BABS, 2015).
Dieses Projekt bietet die Chance auf einen kostengünstigen Lösungsansatz um den Besatz an gesundheitsschädlichen PA-Kräutern in Arzneidrogen anhand der in der Lebensmittelindustrie weit verbreiteten NIRS-Analysetechnik zu reduzieren. Es ist darüber hinaus zu erwarten, dass sich aus dem im Rahmen der Projektarbeit generierten Know-Hows später auch analoge Ansätze für Anwendungen in der Erntetechnik entwickeln lassen.
Diese Verbundprojekt „Detektion und Entfernung von Pyrrolizidinalkaloid-haltigen Unkräutern aus Kulturpflanzen nach der Ernte – PA-NIRSort“ wird gefördert über das Bundesministerium für Ernährung und Landwirtschaft und über die Fachagentur für Nachwachsende Rohstoffe e. V. (FNR) (FKZ 220132165) aufgrund eines Beschlusses des Deutschen Bundestages.
Wir bedanken uns bei unseren Industriepartnern für die finanzielle, ideelle und materielle Unterstützung (Anklam Extrakt GmbH, Bad Heilbrunner® Naturheilmittel GmbH & CO KG, Binder + Co. Aktiengesellschaft, Bombastus-Werke AG, Deutscher Teeverband e.V. (TEE) und Wirtschafts-vereinigung Kräuter- und Früchtetee e.V. (WKV), Dr. Willmar Schwabe GmbH & Co. KG, Klosterfrau Berlin GmbH, Repha GmbH Biologische Arzneimittel, PHARMAPLANT Arznei- und Gewürzpflanzen Forschungs- und Saatzucht GmbH, PhytoLab GmbH & Co. KG, SALUS Haus GmbH & Co. KG, Schaper & Brümmer GmbH & Co. KG, Steigerwald Arzneimittel GmbH).
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
BABS, 2015: „Nationale Gefährdungsanalyse - Gesundheitsdossier Massenausbreitung invasiver Arten“. Gefährdungsdossiers und Scenarien. Bundesamt für Bevölkerungsschutz (BABS).
BfArM, 2016: „Verunreinigung pflanzlicher Arzneimittel durch Pyrrolizidinalkaloide: BfArM macht der pharmazeutischen Industrie neue Vorgaben“. Pressemitteilung 4/16. Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM).
BfArM, BPI, 2016: „Code of practice to prevent and reduce pyrrolizidine alkaloid contaminations of medicinal products of plant origin“. Journal of Applied Research on Medicinal and Aromatic Plants.
BfN, 2013: „Neobiota: Senecio inaequidens“. Bundesamt für Naturschutz (BfN). Arten-Handbuch, https://neobiota.bfn.de/handbuch/gefaesspflanzen/senecio-inaequidens.html.
EU, 2006: Verordnung (EG) Nr. 401/2006 der Kommission vom 23. Februar 2006 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle des Mykotoxingehalts von Lebensmitteln. OJ L. Bd. 070..
Flade, J., B., H. Beschow, M. Wensch-Dorendorf, A. Plescher, W. Wätjen, 2019: Occurrence of Nine Pyrrolizidine Alkaloids in Senecio vulgaris L. Depending on Developmental Stage and Season. Plants 8 (3), 54.
Freund, M., M. Lafontaine, K.-U. Vieth, C. Negara, 2015: Beerensortierung bei Weißwein nach Größe und Farbe und deren Einfluss auf die Weinqualität. In 38th World Congress of Vine and Wine (Part 2), 5:06003. EDP Sciences.
Gudi, G., A. Krähmer, H. Krüger, L. Hennig, H. Schulz, 2014: Discrimination of Fennel Chemotypes Applying IR and Raman Spectroscopy: Discovery of a New γ-Asarone Chemotype. Journal of Agricultural and Food Chemistry 62 (16), 3537-47.
Gudi, G., A. Krähmer, H. Krüger, H. Schulz, 2015: Attenuated Total Reflectance–Fourier Transform Infrared Spectroscopy on Intact Dried Leaves of Sage (Salvia officinalis L.): Accelerated Chemotaxonomic Discrimination and Analysis of Essential Oil Composition. Journal of Agricultural and Food Chemistry 63 (39), 8743-50.
Naumann, A., L. Kurtze, A. Krähmer, H. Hagels, H. Schulz, 2014: Discrimination of Solanaceae Taxa and Quantification of Scopolamine and Hyoscyamine by ATR-FTIR Spectroscopy. Planta Medica 80 (15), 1315-20.
Nitzsche, J., A. Plescher, S. Wahl, 2018: Pyrrolizidinalkaloid-haltige Beikräuter in Arznei- und Gewürzpflanzenkulturen - Verbreitung und Gefahr der Kontamination von Ernteprodukten in Deutschland. Tagungsband 28. Deutsche Arbeitsbesprechung über Fragen der Unkrautbiologie und – bekämpfung: 27. Februar – 1. März 2018, Braunschweig 458, 408-18.