

Kartoffelzystennematoden (Globodera pallida/ G. rostochiensis) und Kartoffelkrebs-Erreger (Synchytrium endobioticum) belastete Resterden – Status quo und Perspektiven effektiver Diagnosemethoden und Dekontaminationsverfahren
Diagnostics and decontamination measures of potato nematode-cysts (Globodera pallida/ G. rostochiensis) – and potato wart (Synchytrium endobioticum) – loaded soil tare – Status quo and perspective
Journal für Kulturpflanzen, 72 (8). S. 421–434, 2020, ISSN 1867-0911, DOI: 10.5073/JfK.2020.08.13, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Zwei Organismengruppen gehören zu den besonders widerstandsfähigen und ertragsmindernden Schadorganismen an der Kartoffel: (1) Zystennematoden der Gattung Globodera, wie der Weiße (G. pallida) und der Goldene Kartoffelzystennematode (G. rostochiensis), sowie (2) Synchytrium endobioticum, der Erreger des Kartoffelkrebses. Ihr Status als geregelte, schwer kontrollierbare Unions-Quarantäneschadorganismen ist ihren äußerst robusten Dauerstadien (Zysten bzw. Wintersporangien) zuzuschreiben sowie dem Auftreten einzelner Populationen mit hoher Virulenz. Ihre Verbreitung ist daher unbedingt zu vermeiden. Ein hohes Risiko einer Verschleppung bergen die jährlich mehreren hunderttausend Tonnen bei der Kartoffelverarbeitung anfallenden Resterden mit nicht zuzuordnender Herkunft. Um eine unbedenkliche Rückführung der Erden auf Ackerflächen zu ermöglichen, wird im Projekt GlobRISK die Optimierung bzw. Ergänzung phytosanitärer Verfahren zur Dekontamination der Resterden von Kartoffelzystennematoden vorangetrieben. Im Drittmittelprojekt INNOKA beabsichtigen wir, innovative Nachweisverfahren für S. endobioticum aus Resterden zu entwickeln und somit Grundlagen für weitere Forschungsarbeiten zur Dekontamination S. endobioticum belasteter Resterden zu schaffen.
Stichwörter: Globodera pallida, G. rostochiensis, Synchytrium endobioticum, Quarantäneschadorganismen, Erhebungsdaten, Kartoffelresterden, Dekontamination
Potato cyst nematodes, Globodera pallida and G. rostochiensis, as well as Synchytrium endobioticum, causing potato ward disease, are severe pests of potato crops. Due to their massive yield impact, all three species are considered invasive and thus are listed as quarantine pests in Germany. Dissemination of soil tares, which derive from the industrial processing of potatoes, are considered as main path for the spread of Globodera spp and S. endobioticum to non-infected areas. Consequently, the reuse of processed soils for any agricultural purpose requires the application of adequate treatments to exclude contamination with both pests. We are seeking to develop reliable diagnostic tools for S. endobioticum (INNOKA project) and to validate and improve treatment procedures for the disinfestation of tare soil eliminating potato cyst nematodes (GlobRISK project).
Key words: Globodera pallida, G. rostochiensis, Synchytrium endobioticum quarantine pest, survey, potato soil tare, decontamination
Die Kartoffel (Solanum tuberosum L.) gehört als lagerfähiges Grundnahrungsmittel und hochwertiges Futtermittel sowie als Stärke liefernder Rohstoff zu den bedeutendsten Nahrungsmitteln weltweit. Deutschland liegt im globalen Vergleich der Kartoffelproduktion derzeit auf Platz 6 und EU-weit auf Platz 2 hinter Polen. So wurden nach Angaben des Statistischen Bundesamtes im Jahr 2019 auf 271.600 ha Ackerfläche 10,6 Millionen Tonnen Speise- und Wirtschaftskartoffeln geerntet (Statistisches Bundesamt, 2020). Einem Bericht der Bundesanstalt für Landwirtschaft und Ernährung (BLE) zufolge lagen im Jahr 2017 die Marktanteile der Kartoffelproduktion von Speisefrischkartoffeln bei 24 %, von Kartoffeln zur Stärkegewinnung bei 20 %, von Verarbeitungskartoffeln für die Nahrung bei 32 %, von Pflanzkartoffeln bei 7 %. Die restlichen 17 % setzen sich aus Kartoffeln für Eigenbedarf in der Landwirtschaft und als Futtermittel sowie aus Verlusten zusammen (BLE, 2020).
An der Kartoffel sind viele Schadorganismen bekannt, welche die Produktion teilweise massiv beeinflussen. Eine besondere Gefährdung geht dabei von den sogenannten Quarantäneschadorganismen (QSO) aus. Solche Schadorganismen sind in einem Gebiet entweder noch nicht vorkommend oder noch nicht weit verbreitet und können bei einer Einschleppung beträchtliche wirtschaftliche Schäden verursachen. Eine Bekämpfung erfolgt in der Regel über amtliche Maßnahmen wie Anbauverbote, Vernichtung der befallenen Pflanzen und Verbringungsverbote von befallenen Waren. An der Kartoffel sind hier u. a. bakterielle Krankheiten wie die Schleimfäule, ausgelöst durch Ralstonia solanacearum, und die Bakterienringfäule, hervorgerufen von Clavibacter sepedonicus, relevant, deren Ausbreitung oftmals über infizierte Kartoffelknollen erfolgt, die ausgepflanzt oder transportiert werden. Die Übertragung der Bakterien auf gesunde Knollen kann über Durchwuchskartoffeln oder kontaminiertes Verpackungsmaterial, Werkzeuge oder Maschinen erfolgen (van der Wolf et al., 2005; Elphinstone et al., 2011). Bei Ralstonia solanacearum ist zudem eine weitere Verbreitung über die Bewässerung aus kontaminierten Oberflächengewässern bekannt (Elphinstone et al., 2008). Doch auch bodenbürtige Quarantäneschadorganismen spielen bei der Kartoffelproduktion eine große Rolle. Hier sind insbesondere die Kartoffelzystennematoden aus der Gattung Globodera (G. pallida (Stone, 1973) Behrens, 1975) und G. rostochiensis ((Wollenweber, 1923) Behrens, 1975)) sowie der Erreger des Kartoffelkrebses (Synchytrium endobioticum (Schilberszky 1896) Percival 1910) zu nennen. Die Bedeutung dieser Schadorganismen liegt insbesondere in ihrer Biologie begründet und in ihrer Fähigkeit, langlebige Überdauerungsformen zu bilden.
Kartoffelzystennematoden sind obligat biotrophe Organismen mit sehr fester Bindung an ihre Wirtspflanze, die Kartoffel (S. tuberosum L.). Obwohl auch andere Pflanzenarten der Gattung Solanum als Wirte dienen können, wird in diesen oftmals der Entwicklungszyklus der Tiere nicht mit der Ausbildung lebensfähiger Nachkommen vollendet. Der erste Teil des Lebenszyklus beider Kartoffelzystennematodenarten, G. pallida und G. rostochiensis, besteht aus einer längeren Ruhephase als Ei, geschützt durch eine aus dem stark vergrößerten Ovar des weiblichen Tieres angelegten Zyste. Daran anschließend durchlaufen die im Ei bereits in ihrem ersten Juvenilstadium vorentwickelten Tiere drei weitere Juvenilstadien (Abb. 1). Innerhalb einer Zyste entwickeln sich, durch Eihüllen voneinander abgegrenzt, jeweils bis zu 400 Eier über ein erstes Stadium durch eine Häutung zu Juvenilen des zweiten Stadiums (J2). Das zweite Juvenilstadium ist dabei das einzige freibewegliche Stadium im Boden.
Diese J2 Juvenilen weisen einen Mundstachel (Stilett) auf, mit dessen Hilfe sie die Eihülle durchdringen können. Der Zeitpunkt des Schlupfes aus der Eihülle ist einerseits durch eine artspezifische Ruhepause und andererseits durch die vorherrschende Bodentemperatur, Bodenfeuchte und Tageslänge (Hominick, 1986) reguliert und bedarf zumeist der Stimulation durch Wurzelexsudate von Wirtspflanzen. Deshalb sind G. pallida und G. rostochiensis in ihrem Schlupf stark abhängig von der Präsenz von Kartoffelpflanzen. Die Ruhepause beider Arten endet in den gemäßigten Klimazonen typischerweise im späten Frühjahr, parallel mit dem Anstieg der Bodentemperaturen und dem Zeitpunkt der Kultivierung neuer Kartoffelpflanzen. Das Ausbleiben von Exsudaten kann die Dormanz (Ruhephase) der Eier von G. pallida und G. rostochiensis in der Zyste bis zu 20 Jahre verlängern (Been & Schomaker, 1996; Turner, 1996; Perry & Moens, 2013). Unter Anwesenheit der Wirtspflanze ist ein gleichzeitiger Schlupf von bis zu 50–80 % der Nematodenpopulation möglich (Turner, 1998). Interessanterweise wurde Schlupf auch in einer Entfernung bis zu 80 cm von der Wurzel beobachtet (Rawsthorne & Brodie, 1987). Auch nach der Entnahme sämtlicher Kartoffelpflanzen im Feld konnte noch nach 100 Tagen eine Schlupfaktivität für G. rostochiensis detektiert werden (Tsutsumi, 1976). In Abwesenheit von Wirtspflanzen können kontinuierlich bis zu 10–30 % an G. pallida und 20–40 % an G. rostochiensis J2 Juvenilen pro Jahr schlüpfen (Whitehead, 1995; Turner, 1998), welche im obligat biotrophen Lebenszyklus der Tiere bei Fehlen des Wirtes innerhalb weniger Tage verenden. Nach der chemotaktischen Orientierung in Richtung Wurzelspitzen der Kartoffel durchdringen die J2 Juvenilen mit ihrem Mundstachel die Zellwände einer Reihe von Epidermiszellen der Wurzel, ohne jedoch die Zytoplasmamembran zu beschädigen. Die Mundregion der Nematoden bildet sich im nächsten Entwicklungsschritt (J3) zu einem Futterschlauch um, der, angetrieben durch Verdauungsdrüsen im Oesophagus, die Funktion eines Partikelfilters für langkettige, von der Pflanze bei Verletzung abgegebene, unspezifisch wirkende Abwehrmoleküle (Phytoalexine) übernimmt. Die Juvenilen sind nun in der Lage, die Zellen ihres Wirtes mit Hilfe von Phytohormonen derart umzuprogrammieren, dass mehrere Pflanzenzellen zu einem ausgedehnten mehrkernigen Synzytium verschmelzen, das die Juvenilen ernährt. Die Herausbildung des Geschlechtes erfolgt erst nach Ende des 4. Juvenilenstadiums und kann abhängig vom vorhandenen Nahrungsangebot durch die Juvenilen selbst gesteuert werden. Beide Zystennematodenarten müssen im Gegensatz zu vielen freilebenden Nematodenarten obligat befruchtet werden, um lebensfähige Eier und Juvenile zu erzeugen (Perry & Wright, 1998). Während sich die Juvenilenstadien (J2) J3 – J4 und die adulte Phase der Weibchen an der Pflanze entwickeln, sind Zysten und damit Eier sowie J2 Juvenile und männliche adulte Tiere nach der Ernte im Boden zu finden. Die Entwicklung einer Generation bedarf bis zu 10 Wochen (Perry & Moens, 2013). Die Vermehrungsraten richten sich dabei nach der Dichte der Ausgangspopulation; hohe Vermehrungsraten gehen von geringen Dichten aus (Seinhorst, 1965). In gemäßigten Klimazonen vollenden G. pallida und G. rostochiensis bei Anwesenheit der Wirtspflanzen normalerweise einen Entwicklungszyklus pro Anbausaison. Studien aus Süditalien (Greco et al., 1988) und Venezuela (Jimenez-Perez et al., 2009) berichten jedoch, dass G. rostochiensis fähig ist, innerhalb einer Anbausaison zwei Entwicklungszyklen komplett zu durchlaufen. Diese Beobachtung zeigt die Brisanz eines Befalls mit diesen Schaderregern vor dem Hintergrund des sich abzeichnenden Klimawandels auch für Anbaustandorte in Deutschland.
Die beweglichen Juvenilenstadien J2 von G. pallida und G. rostochiensis befallen primär das Wurzelgewebe und schädigen dieses (Marks, 1998). Eine Studie aus dem Jahr 1950 beschreibt aber auch ein Auftreten in Stolonen und Knollen der Kartoffel (Oostenbrink, 1950). Typische Symptome im Feld sind ein charakteristischer Streubefall in Form Nester-artig auftretender Wachstumsstockungen. Bei stärkerem Befall bleiben Sprosse und Stängel klein, Basisblätter vertrocknen und hängen herab, und Spitzenblätter der Stauden rollen sich, vergilben und vertrocknen im weiteren Vegetationsverlauf (Radtke et al., 2000). Da diese Symptome an Pflanzen jedoch auch bei Nährstoffmangel im Boden oder Trockenheit auftreten, kann es zur Verwechselung bei der visuellen Feststellung des Befalls kommen. Ein Befall mit G. pallida kann mit Ertragsminderungen von bis zu 60 %, bei sehr hohen Abundanzen sogar bis zu 100 % einhergehen (Brodie & Mai, 1989). Europaweit sind beide Arten für bis zu 9 % der Verluste an Kartoffelknollen verantwortlich.
Kartoffelzystennematoden kommen weltweit in allen klimatischen Zonen vor, in denen Kartoffelanbau erfolgt. Die Arten G. pallida und G. rostochiensis treten in 70 bzw. 71 Ländern auf und sind sowohl in der Europäischen Union als auch in vielen Drittstaaten außerhalb ihres Ursprungsgebietes als Quarantäneschadorganismen gelistet. Ursprünglich stammen beide Globodera-Arten aus den Anden in Südamerika (Stone, 1979; Plantard et al., 2008; Anthoine et al., 2010) wobei eine geographische Nord-Süd Abgrenzung beider Arten innerhalb der Anden beschrieben wird. Beide Arten bilden Pathotypen mit unterschiedlicher Virulenz aus und das Auftreten neuer hoch virulenter Populationen birgt eine stete Gefahr (Niere et al., 2014). In Deutschland findet man zumeist G. rostochiensis Ro1 und G. pallida Pa2 and Pa3 (Pa2/3) (Kort et al., 1977; Scurrah & Saenz, 1977; Canto-Saenz et al., 1998; Phillips & Trudgill, 1998).
Der Erreger des Kartoffelkrebses S. endobioticum ist ebenfalls ein obligater Parasit. Er besitzt im Gegensatz zu den höheren Pilzen kein Myzel, sondern begeißelte Sporen (=Zoosporen), die sich im Bodenwasser bewegen können. Die Zoosporen schwimmen zu Sprossmeristemen der Kartoffelpflanze und besiedeln dort epidermale Zellen. S. endobioticum besitzt zwei jahreszeitlich voneinander getrennte Entwicklungszyklen, in denen entweder haploide oder diploide Zoosporen gebildet werden (Curtis, 1921). Im Frühling und Sommer kann sich aus jeder mit einer haploiden Zoospore infizierten pflanzlichen Epidermiszelle innerhalb von zwei Wochen ein sogenannter Sommersorus (oder auch Sommersporangium) entwickeln, der mehrere hundert bis tausend neue Zoosporen enthält. Diese Sommersori sind für die Verbreitung des Erregers innerhalb der Pflanze sowie im Bestand verantwortlich. Jeder heranreifende Sommersorus induziert eine erhöhte Teilungsrate benachbarter pflanzlicher Zellen, so dass die für den Erreger typischen Wucherungen entstehen. Verschlechtern sich die Bedingungen für S. endobioticum durch zunehmende Trockenheit oder Seneszenz der Wucherungen, verschmelzen je zwei haploide Zoosporen zu einer diploiden Zoospore (Zygote), die ebenfalls das Kartoffelgewebe befällt und die Bildung eines dickwandigen, Chitin-beschichteten Wintersorus (oder auch Wintersporangium) induziert, der wegen seiner extremen Widerstandsfähigkeit auch Dauersorus genannt wird. Wenn die an den Knollen gebildeten Wucherungen zerfallen, gelangen die Dauersori in den Boden. Die Infektion neuer Kartoffeln im Frühjahr erfolgt in der Regel über die aus den Dauersori stammenden Zoosporen. Ein Teil der Dauersori keimt jedoch nicht im folgenden Frühjahr, sondern verbleibt im Boden, wo sie jahrzehntelang überleben, um zu einem unbestimmten Zeitpunkt auszukeimen. In Polen konnten nach über 40-jähriger Ruhephase mit den von einer früheren Befallsfläche isolierten Dauersori in einem Biotest Wucherungen an Kartoffeln nachgewiesen werden (Przetakiewicz, 2015). Die Dauersori sind ausgesprochen persistent. Sie überstehen Wärme, Trockenheit und Kälte (Weiss, 1925; Esmarch, 1928) und passieren den Magen-Darm-Trakt von Rindern (Zakopal, 1970) unbeschadet. Auch Untersuchungen zur Wirkung der Kompostierung, Pasteurisierung und der Vergärung führten nicht zu einer vollständigen Abtötung der Dauersori (Steinmöller et al., 2012; Schleusner et al., 2019).
S. endobioticum befällt im Gegensatz zu den Globodera-Arten niemals das Wurzelsystem von Kartoffelpflanzen (Artschwager, 1923), sondern das teilungsaktive Gewebe (Apikalmeristeme und Korkkambien) unterirdischer Sprosse (= Stolone). Grundsätzlich können alle meristematischen Gewebe der Kartoffel durch Zoosporen des S. endobioticum befallen werden. Die Apikalmeristeme der Sprosse einschließlich ihrer Blattprimordien sind aber nach Austritt aus dem Boden aufgrund einer zunehmenden räumlichen Distanz zum Boden besser vor den Zoosporen des Pilzes geschützt, daher sind oberirdische Symptome eher selten. In der Regel wird ein Befall erst bei der Ernte sichtbar, wenn die typischen Wucherungen an den Knollen vorhanden sind. Oftmals sind diese Wucherungen jedoch nur an der Austrittsstelle des „Keimes“ mit der Knolle verbunden und fallen bei Bewegungen leicht ab, so dass ein Befall gar nicht ohne weiteres erkannt werden kann. Grundsätzlich kann eine befallene Kartoffelpflanze oberirdisch gesund erscheinen, tatsächlich aber so stark infiziert sein, dass die Wucherungen schon zerfallen sind und bereits Dauersori im Boden freigesetzt haben (Abb. 2).
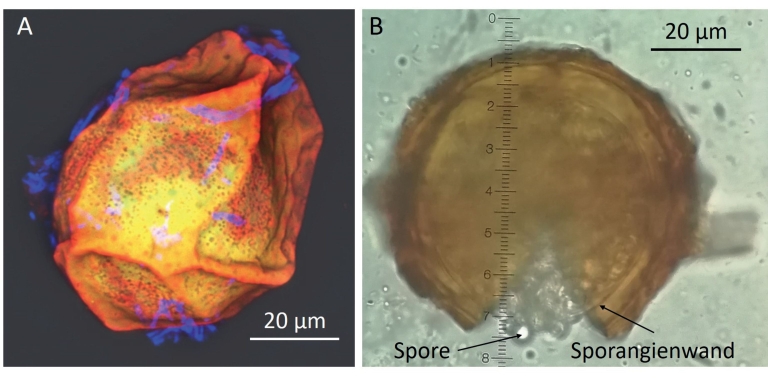
Abb. 2. Dauersori von S. endobioticum. A) Dauersorus präpariert und gefärbt nach (Becker et al., 2018) und visualisiert mittels Konfokaler Laser Scanning Mikroskopie; B) Lichtmikroskopische Aufnahme eines Dauersorus, der mit leichtem Druck auf das Deckgläschen geöffnet wurde.
Ähnlich den Globodera-Arten sind auch von S. endobioticum verschiedene Pathotypen bekannt (derzeit mehr als 40), die sich vor allem in der Sensitivität und der Befallsausprägung verschiedener Kartoffelsorten unterscheiden. Aufgrund dessen kann eine Pathotypenfeststellung über ein anerkanntes Testsortiment erfolgen (Baayen et al., 2006). In Deutschland sind in den letzten Jahren vor allem die Pathotypen 2, 6 und 18 bedeutungsvoll, während der früher am weitesten verbreitete Pathotyp 1 derzeit nicht mehr relevant ist (Flath & Steinmöller, 2018). Dies ist für den Kartoffelanbau insofern von Bedeutung, als von den derzeit zugelassenen Kartoffelsorten zwar viele eine Resistenz gegenüber Pathotyp 1 aufweisen, jedoch nur begrenzt Sorten mit Resistenz gegenüber den höheren Pathotypen existieren. Im Rahmen der aktuellen Resistenzzüchtung wird daher eine Resistenz neuer Kartoffelsorten gegen höhere Pathotypen des Erregers angestrebt.
Einzelne Pathotypenisolate sind zudem nicht zwangsläufig einem abgegrenzten Genotyp zuzuordnen. In einer Studie von van de Vossenberg et al. (2018) wurden die mitochondrialen Genome von 30 S. endobioticum Isolaten bezüglich einer möglichen Verbindung zwischen ihrem Genotyp, ihrer geographischen Herkunft und ihrem Pathotyp untersucht. Dabei wurden vier mitochondriale Linien in den Genomen identifiziert. Interessanterweise traten aber einige Pathotypen in verschiedenen mitochondrialen Linien auf, so dass die Autoren zur Charakterisierung der S. endobioticum Isolate eine zusätzliche Sequenzierung dieser empfehlen. Dabei sollten generell S. endobioticum Isolate nicht als einzelne Genotypen, sondern als Populationen verschiedener Genotypen betrachtet werden, da sie eine Bandbreite verschiedener Genotypen in sich vereinen (van de Vossenberg et al., 2018).
Sowohl der Erreger des Kartoffelkrebses, S. endobioticum als auch die Kartoffelzystennematoden G. pallida und G. rostochiensis kommen in verschiedenen kartoffelproduzierenden Ländern vor. Beide Schadorganismen präferieren jedoch gemäßigte Klimazonen, weswegen sie unter anderem insbesondere im europäischen Raum verbreitet sind. Aufgrund ihrer Bedeutung sind sie jedoch weltweit in vielen Ländern als Quarantäneschadorganismen geregelt und ihre Einschleppung ist verboten. Innerhalb der EU sind diese Schadorganismen trotz ihrer Verbreitung ebenfalls in Anhang II der Durchführungsverordnung 2019/2072, Teil B als Unions-Quarantäneschadorganismen gelistet und unterliegen somit sowohl der Meldepflicht gegenüber der zuständigen Behörde als auch einem Verbringungsverbot zwischen den und innerhalb der Mitgliedstaaten. Zudem werden diese Schadorganismen über die Bekämpfungsrichtlinien 2007/33/EG (Anonym, 2007) und 1969/464/EWG (Anonym, 1969a) geregelt, in denen weitere Maßnahmen vorgeschrieben sind. Diese beiden Richtlinien wurden in Deutschland über die Verordnung zur Bekämpfung des Kartoffelkrebs-Erregers und der Kartoffelzystennematoden (KartKrebs/KartZystV) in nationales Recht umgesetzt (Anonym, 2010). Die Maßnahmen zur Bekämpfung des Kartoffelkrebs-Erregers sind in Abschnitt 2 der Verordnung geregelt. Hier ist unter anderem vorgeschrieben, dass bei Feststellung eines Befalls an mindestens einer Pflanze oder Knolle eine Sicherheitszone abgegrenzt werden muss (§ 4). Diese besteht aus der Befallsfläche sowie aus einem zusätzlichen Sicherheitsbereich, soweit dieser zur Sicherung der umliegenden Gebiete erforderlich ist. In dieser Sicherheitszone besteht ein Anbauverbot für Kartoffeln und andere Pflanzen zum Anpflanzen (§ 5). Eine Ausnahme des Anbauverbotes in dem zusätzlichen Sicherheitsbereich besteht für Speise- und Wirtschaftskartoffeln, die gegen den auf der Befallsfläche vorkommenden Pathotyp resistent sind. Zudem ist die Behandlung von Kraut und Knollen zur Vernichtung des Erregers vorgeschrieben. In Abschnitt 3 der Verordnung werden die Maßnahmen zur Bekämpfung der Kartoffelzystennematoden genannt. Dieser Teil der Verordnung wurde im Jahr 2010 an die neu gefasste Richtlinie 2007/33/EG (Anonym, 2007) angepasst, welche die bis dahin existierende Richtlinie 69/465/EWG (Anonym, 1969b) ersetzt hat. Hier sind neben spezifischen Vorgaben für Felder für die Erzeugung von Pflanzen zum Anpflanzen (§ 7) sowie zur Untersuchung von Anbauflächen vor der Pflanzung (§ 8) auch Vorgaben zu spezifischen Erhebungen zur Verbreitung der beiden Globodera-Arten (§ 9) vorgeschrieben. Flächen, auf denen der Anbau von Pflanzkartoffeln geplant ist, müssen vor dem Anbau komplett untersucht werden und als befallsfrei in das amtliche Verzeichnis der zuständigen Behörde eingetragen sein. Die Bescheinigung über die Befallsfreiheit behält ihre Gültigkeit über einen Zeitraum von 2 Jahren, sofern es nicht zwischenzeitlich zum Anbau von Speise- und Wirtschaftskartoffeln auf der Fläche gekommen ist.
Für G. pallida und G. rostochiensis sind über die Richtlinie 2007/33/EG und die nationale Umsetzung in der KartKrebs/KartZystV Erhebungen auf Ackerflächen vorgesehen. In Richtlinie 2007/33/EG Anhang 2 werden detaillierte Vorgaben hinsichtlich der Durchführung einer Bodenprobenahme dargestellt, die für amtliche Untersuchungen von Pflanzkartoffeln bzw. amtliche Erhebungen von 0,5 % der Anbauflächen von Speise-Wirtschaftskartoffeln (SWK) herangezogen werden, um den Befallsstatus einer Feldfläche zu ermitteln. Die Probenahme erfolgt mit 100 Einstichen pro Hektar gleichmäßig über die Fläche verteilt, und in Form einer daraus resultierenden Mischprobe wird ein Probenvolumen von 1500 (1000) ml für Pflanzkartoffelanbauflächen und 400 (500 ml) für SWK zur Untersuchung auf Zysten des Schaderregers herangezogenen. Flächen, auf denen der Anbau von Pflanzkartoffeln geplant ist, müssen vor dem Anbau komplett untersucht werden und als befallsfrei in das amtliche Verzeichnis der zuständigen Behörde eingetragen sein. Die Bescheinigung über die Befallsfreiheit behält ihre Gültigkeit über einen Zeitraum von zwei Jahren, sofern es nicht zwischenzeitlich zum Anbau von Speise- und Wirtschaftskartoffeln auf der Fläche kommt.
Anhand der Erhebungsdaten der Jahre 2010–2016 ist die Brisanz der Schädigung durch Kartoffelzystennematoden an Speise- und Wirtschaftskartoffeln durch die stetige Zunahme des Befalls und die Akkumulation Nematoden-befallener Flächen auf 5387 ha zu erkennen. Eine Abnahme der befallenen Flächen wurde erst wieder in den Jahren 2017–2019 erreicht. (Abb. 3). Zwischen den Jahren 2010–2016 kam es auch zu einer Verschiebung der Anteile von G. pallida und G. rostochiensis. Es ist zu erkennen, dass der Anteil an gefundenen G. rostochiensis Zysten immer mehr abgenommen und der Anteil an Mischinfektionen von G. pallida und G. rostochiensis zugenommen hat (Abb. 4). Die Verschiebung der Anteile deutet auf eine stark variable Verteilung der Arten und damit auf eine immerwährende Quelle neuer unbekannter Populationen hin.
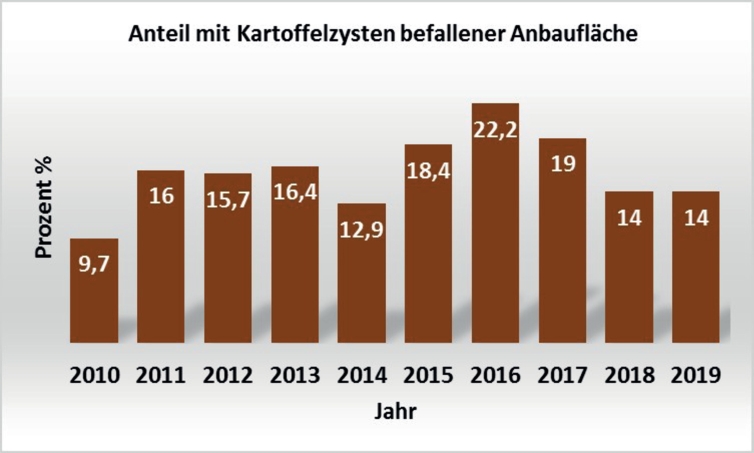
Abb. 3. Anteil an mit Kartoffelzystennematoden befallener Anbaufläche von Speise- und Wirtschaftskartoffeln in Deutschland in den Jahren 2010–2019.
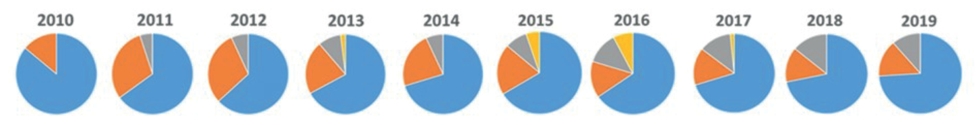
Abb. 4. Prozentualer Anteil von G. pallida (blau) und G. rostochiensis (orange) sowie G. pallida/G. rostochiensis Mischinfektion (grau) und nicht identifizierter Kartoffelzystennematoden (gelb) in Deutschland in den Jahren 2010–2019.
Für S. endobioticum existieren derzeit keine derartigen Vorgaben zu Erhebungen auf Ackerflächen. Zwar sind mit der neuen Pflanzengesundheitsverordnung 2016/2031 (Anonym, 2016) Erhebungen für alle Unions-Quarantäneschadorganismen im Rahmen von Mehrjahresplänen vorgesehen, was auch S. endobioticum einschließt; bisher existieren aber keine konkreteren Vorgaben dazu, wie diese Erhebungen durchzuführen sind. Die von der Europäischen Lebensmittelsicherheitsbehörde (EFSA) erstellte Survey Card zu S. endobioticum (Schenk et al., 2019) empfiehlt, solche Erhebungen an Knollen bei oder nach der Ernte durchzuführen, da die Feststellung des Erregers im Boden problematisch ist. Von der Pflanzenschutzorganisation Europas und des Mittelmeerraumes (EPPO) wurde der Standard PM 3/59 (3) (EPPO, 2017a) erstellt, zur Feststellung des Erregers auf ehemaligen Befallsflächen. Eine Testung dieser Flächen ist notwendig, da die Richtlinie 69/464/EWG in Artikel 6 festlegt, dass die ergriffenen Maßnahmen erst aufgehoben werden dürfen, wenn das Vorhandensein von S. endobioticum nicht mehr feststellbar ist. Das von der EPPO vorgeschlagene Testschema sieht eine Testung der Befallsflächen erstmalig nach 20 Jahren vor. Hierfür sollten pro 0,33 ha der Fläche je eine Probe genommen werden, die aus 60 Unterproben besteht. Diese sollten gleichmäßig über die Fläche verteilt werden und mit einem geeigneten Werkzeug aus 20 cm Tiefe entnommen werden. Die Aufarbeitung der Proben erfolgt entsprechend dem Diagnosestandard PM 7/28 (2) (EPPO, 2017b) über Isolierung der Dauersori aus den Erdproben und Feststellung der Lebensfähigkeit über mikroskopische Untersuchungen oder einen Biotest an sensitiven Sorten. Dieses Verfahren ist sehr arbeitsintensiv und würde im Rahmen von Routinetestungen von Flächen zu regelmäßigen Erhebungen viele Laborkapazitäten binden. Entsprechend der EFSA Survey Card führt auch die oft sehr ungleichmäßige Verteilung des Erregers auf den Flächen dazu, dass die Testung von Ackerflächen nicht als geeignetes Erhebungsverfahren angesehen wird. Ohne eine entsprechende Flächentestung besteht jedoch ein grundlegendes Risiko, dass aufgrund einer möglichen unerkannten Kontamination von Flächen mit S. endobioticum Dauersori kontaminierte Erden verbracht werden. Die Entwicklung von Verfahren zur Optimierung der Feld-Probenahme und Dauersporen-Extraktion aus Bodenmischproben um eine sichere Durchführung von Monitoringmaßnahmen zu gewährleisten, ist deshalb eines der Ziele des seit 2019 laufenden Forschungsvorhaben INNOKA am Julius Kühn-Institut. Zudem wird im Projekt an der Optimierung von Verfahren zur Vitalitätsanalyse von Dauersporen mittels Durchlicht-Mikroskopie, Biotest und DNA/RNA-Untersuchung mit anschließender qPCR, geforscht. Im Projekt arbeiten das JKI-Fachinstitut für Pflanzenschutz im Ackerbau und Grünland und das JKI-Fachinstitut für Pflanzengesundheit in Kooperation mit den Pflanzenschutzdiensten in Niedersachsen und Bayern, der Leibniz-Universität Hannover sowie Unternehmen der Kartoffelzüchtung, um gemeinsam die Kartoffelproduktion in der Bekämpfung des Erregers zu unterstützen.
Aktuell ist die potentielle Verbreitung von Zysten der beiden Globodera-Arten sowie von Dauersori von S. endobioticum über anhaftende Erden und damit in der Kartoffelproduktion anfallenden Resterden ein großes Risiko für die Anbauer in Deutschland. Diese sogenannten Resterden fallen, in Abhängigkeit der Verwendung der Kartoffel in verschiedenen Schritten, im weiteren Verarbeitungsprozess der Knollen an. Bei der industriellen Verarbeitung werden die Kartoffeln oftmals zu Beginn des Verarbeitungsprozesses über Rüttelbänder oder Waschen von den Erden befreit. Die Resterden fallen in den Betrieben entweder trocken oder schlammförmig in zum Teil erheblichen Mengen an und müssen von diesen entsorgt werden. Bei der Verarbeitung von Kartoffeln fallen im Mittel etwa 4 % der Verarbeitungsmenge der Feldfrüchte in Form von Resterde und sonstigen Verarbeitungsrückständen an (Aussage der Verbände der Kartoffelverarbeitungsbetriebe). In Deutschland entspricht dies ca. 400.000 t für das Anbaujahr 2019. Die Mengen sind dabei regional stark unterschiedlich, abhängig von Bodenart und -struktur in den landwirtschaftlichen Erzeugerbetrieben und den Witterungsbedingungen bei der Ernte.
Die hohe Menge der jährlich anfallenden Erden stellt eine besondere Herausforderung für die Umsetzung der KartKrebs/KartZystV dar und erschwert die Umsetzung der in Anlage 2 enthaltenen Beseitigungsverfahren der Erden. Grundsätzlich eignen sich solche Resterden gut für eine Rückführung auf Ackerflächen, da sie einen hohen Anteil organischen Materials aufweisen. Bei einer, oftmals unerkannten, Kontamination der Erden mit Zysten der Globodera spp. oder Dauersori von S. endobioticum wird mit einer Verbreitung der Erden auf Ackerflächen jedoch ein perfekter Verschleppungsweg geebnet, da nicht gewährleistet werden kann, dass die Erden jeweils auf die ursprünglichen Flächen zurück verbracht werden. Somit kann kontaminierte Resterde zu einer Vielzahl neu infizierter Flächen führen. Weder auf EU-Ebene noch deutschlandweit existieren derzeit einheitliche rechtliche Vorgaben zur Behandlung von Resterden, die mit S endobioticum kontaminiert sind.
Die EPPO misst der möglichen Verbreitung der Quarantäneschadorganismen mit Resterden ebenfalls eine hohe Bedeutung zu. Im Jahr 2014 wurde daher ein Workshop zum Thema „Phytosanitary risks associated with soil attached to potato tubers and potato waste“ abgehalten, um das Bewusstsein für die phytosanitären Risiken zu schärfen, die mit Resterden verbunden sein können. Derzeit wird ein EPPO Standard der Serie PM 3 entwickelt zum Management phytosanitärer Risiken für Kartoffeln, die aus der Verbringung von Erden entstehen.
Der Abschnitt 3 in § 14 der KartKrebs/KartZystV enthält Anforderungen an Verarbeitungsbetriebe für Kartoffeln, die sich auf die Behandlungs- und Beseitigungsverfahren für Resterden beziehen. Demnach dürfen industrielle Verarbeitung, Größensortierung oder Abpackung der Kartoffeln nur von solchen Betrieben übernommen werden, die über anerkannte Behandlungs- oder Beseitigungsverfahren für Resterden verfügen. Beispiele für solche Verfahren sind in Anhang 2 der Verordnung gelistet, jedoch in den meisten Fällen in der Praxis nur bedingt umsetzbar (Abb. 5).

Abb. 5. Amtliche Behandlungs- und Beseitigungsmaßnahmen von Resterden aus der Kartoffelverarbeitung nach KartKrebs/KartZystV § 14 Anlage 2.
Wie bereits erwähnt, werden derzeit von den in Anlage 2 der KartKrebs/KartZystV vorgeschlagenen Verfahren zur Behandlung von Resterden nur die Deponierung, die gründliche Befreiung der Knollen von Erde vor Abgabe, sowie die Rückgabe der Erden an den jeweiligen anliefernden Landwirt als sinnvolle Behandlungsverfahren für Erden, die mit Dauersori von S. endobioticum kontaminiert sind, eingeschätzt. Die ausreichende Reinigung der Knollen vor Abgabe ist technisch weitestgehend umsetzbar, bedeutet aber je nach Bodentyp einen großen zusätzlichen Aufwand und führt insbesondere bei der Produktion auf schweren Böden nicht immer zu einem befriedigenden Ergebnis. Die Rückgabe der Erden an den anliefernden Landwirt ist nur dann zulässig, wenn die Erden eindeutig einem Anlieferer zuzuordnen sind, was derzeit für die meisten Bearbeitungsbetriebe nicht umsetzbar ist.
Die Deponierung bzw. Entsorgung der Erden ist in zunehmendem Maße mit einem Austrag an wertvollem Boden von der Produktionsfläche verbunden. Gegen weitere Möglichkeiten der Ablagerung oder Deponierung von Resterde auf landwirtschaftlich nicht genutzten Flächen sprechen neben pflanzenschutzrechtlichen Belangen noch eine Vielzahl von gesetzlichen Regelungen in Umwelt- und Baurecht des Bundes bzw. einzelner Bundesländer. Nichts desto trotz bestehen in Einzelfällen Möglichkeiten der Unterbringung von Resterden im Straßenböschungsbau und weiteren Bereichen zur Aufschüttung von Erden unter der Maßgabe, dass an diesen Standorten Schutzmaßnahmen gegen eine Ausbreitung von Dauerstadien von G. pallida und G. rostochiensis sowie von S. endobioticum in landwirtschaftlich genutzte Bereiche getroffen wurden. Dies kann jedoch die Problematik der großen, allein in der Kartoffelverarbeitung anfallenden, Mengen an Resterde nicht lösen. Zudem ist eine Lagerung im Verarbeitungsbetrieb genehmigungspflichtig und müsste über einen Zeitraum von 15 Jahren erfolgen, bevor nach anschließender Testung gelagerter Resterden auf die Schaderreger eine Ausbringung auf Ackerflächen möglich ist, wobei die weitaus längere Resilienz von Dauersori von S. endobioticum auch dann noch ein Verbreitungspotential birgt. Andere Verfahren sind ebenfalls zulässig, wenn sie von der zuständigen Behörde genehmigt wurden und keine Gefahr der Ausbreitung oder Verschleppung der Schadorganismen besteht. Die bei der Anlieferung und Verarbeitung anfallenden Resterden dürfen nicht auf Flächen, auf denen Kartoffeln angebaut werden, aufgebracht werden. Methoden für eine Dekontamination und damit die Möglichkeit zum Recycling der Resterden sind daher dringend erforderlich.
Das Projekt GlobRISK, eine Zusammenarbeit des JKI-Fachinstituts für Pflanzenschutz im Ackerbau und Grünland und des JKI-Fachinstituts für Pflanzengesundheit, bewertet und optimiert phytosanitäre Verfahren zur Schließung von Verschleppungswegen von Kartoffelzystennematoden, denn es besteht ungebrochen hoher Forschungsbedarf, um den Kartoffel-verarbeitenden Betrieben umsetzbare und ökonomisch vertretbare Methoden zur fachgerechten Resterdenbehandlung zur Verfügung zu stellen (Abb. 6). Dabei wären insbesondere Verfahren vorzuziehen, welche eine vollständige Abtötung der Zysten und möglichst auch der Dauersori gewährleisten können (Abb. 7).
Ein in der Feuchtabscheidung der Resterde während der Zuckerverarbeitung genutztes Verfahren ist die anaerobe Lagerung des wasserüberfluteten Resterde- Schlammes in Stapelteichen oder Bruknerbecken (Abb. 8). Die anaeroben Bedingungen während der Überflutung der Resterde zeigten sich in Studien ebenfalls zu 100 % letal für Zystennematoden der Gattung Globodera, allerdings abhängig von der Lagerzeit (Stelter, 1974; Heinicke, 1989), der Temperatur (Spaull & McCormack, 1988) und dem Gehalt organischer Substanz während der Inundation (Ebrahimi et al., 2016). Dies gilt jedoch nicht für die meisten bakteriellen (z. B. Ralstonia solanacearum, (Allen, 2005) und viele pilzliche Schaderreger (z. B. S. endobioticum). Anaerobe Bedingungen (bei 35°C) bewirken bereits nach 6–9 Wochen die Abtötung aller lebensfähigen Eier, wobei G. pallida widerstandsfähiger ist als G. rostochiensis (Spaull & McCormack, 1988). Unabhängig von der Nematoden-Art, ist der Zustand feuchter bzw. getrockneter Zysten entscheidend für die Mindestverweildauer unter anaeroben Bedingungen. Dabei ist zu beachten, dass trockene, teilweise mit Luft gefüllte Zysten über viele Tage an der Oberfläche von Stapelteichen treiben und so den anaeroben Bedingungen im Sediment entgehen können (Heinicke, 1989). Die Verweildauer in diesen Teichen beträgt 120 Tage bei einer Abnahme der Lebensfähigkeit um 90 % und 6 Monate bis zu einer Abnahme um 99 % (Heinicke, 1989). Auch Stelter konnte, nach einer schnellen Abnahme der Lebensfähigkeit in den ersten vier Wochen (annähernd 90 %), noch nach fünf Monaten Verweildauer unter kalt-mesophilen (15°C) Bedingungen vereinzelt lebensfähige Eier nachweisen (Stelter, 1974). Auch hier war die Widerstandsfähigkeit von G. pallida höher (aber nicht signifikant) als die von G. rostochiensis. Da alle Resterden durch Rückstände aus der Zuckerrübenverarbeitung stark mit organischem Material angereichert waren, war die Aufrechterhaltung anaerober Bedingungen durch Fäulnis- und Gärungsprozesse unabhängig von der Bodenart der Resterden kontinuierlich gegeben. Nach der Lagerung im Bruknerbecken wurde der Schlamm über Membranfilter entwässert und dadurch eine Rückgewinnung der Erde im Stapelteich erzielt (Standardverfahren, beschrieben in (Hessler, 2016).
Aufgrund der spezifischen Unterschiede im Verarbeitungsprozess (feuchte vs. trockene Resterdeabscheidung bei Zuckerrüben- bzw. Kartoffelverarbeitung) ist die Überflutung der Resterde bisher überwiegend in der zuckerverarbeitenden Industrie angewendet worden, kann aber mit hoher Sicherheit auch in der Kartoffelverarbeitung angewendet werden. Einer der Nachteile der Methode besteht im relativ hohen Platzbedarf für die Anlegung von Stapelteichen und einem dem Stapelteich vorgeschalteten Bruknerbecken, bei allerdings geringem Energieverbrauch (Hessler, 2016).
Studien belegen, dass die Schaffung anaerober Bedingungen in Böden (anaerobic soil disinfestation ASD bzw. Inundation) (Blok et al., 2000; Stremińska et al., 2014; van Overbeek et al., 2014), Biofumigation (Matthiessen & Kirkegaard, 2006; Lord et al., 2011) sowie die Bodenbegasung (Potocek, 1991) geeignete Mittel zur Bekämpfung von Kartoffelzystennematoden und anderen Phytopathogenen darstellen. Die Schaffung anaerober Bedingungen im Rahmen der ASD erfolgt dabei durch die Einarbeitung organischer Substanz (z. B. Grasschnitt oder standardisierte, kommerziell verfügbare Produkte) mit anschließender luftdichter Abdeckung des Bodenmaterials. Ursächlich für die phytosanitäre Wirkung des Verfahrens ist die Bildung biotoxischer und nematizid wirkender Stoffe (u. a. Cyanate) als Nebenprodukte des anaeroben Metabolismus zahlreicher Bakterien (Runia et al., 2012) sowie eine Reihe von Fettsäuren, die durch die eingesetzten Mikroorganismen bei gleichzeitiger pH-Wert-Absenkung der Resterden freigesetzt werden (Stremińska et al., 2014). Für G. pallida wurden durch Anwendung dieser Methode Rückgänge der Individuendichten um 99,4 % in Mesokosmen erreicht (van Overbeek et al., 2014). Bei dem von der ASD abgeleiteten Verfahren der Biofumigation wird zerkleinertes Material von zur Gründüngung geeigneten Pflanzen in den Boden eingearbeitet. Das Prinzip basiert ebenfalls auf der Freisetzung biologisch aktiver Stoffe, z. B. Isothiocyanate, die toxisch auf bodenbürtige Pflanzenpathogene wirken (Angus et al., 1994; Buskov et al., 2002; Lazzeri et al., 2004). In diesem Zusammenhang effektiv nutzbare Pflanzen stellen Arten der Gattung Brassica dar. So wurden in einem Gewächshausversuch durch die Einarbeitung von Blattmaterial dreier Brassica juncea (Brauner Senf) Kultivare (Nemfix, Fumus und ISCI99) über 95 % der G. pallida Zysten abgetötet. Die Wirksamkeit dieses Verfahrens erhöht sich ebenfalls bei Abdeckung des Bodens mit Polyethylenfolie (Lord et al., 2011).
Kompostierung ist ebenfalls ein für die Behandlung von Resterden in Frage kommendes biologisches Verfahren. Da viele Mikroorganismen beim oxidativen Abbau von organischer Substanz relativ uneffektiv arbeiten, geben sie einen großen Teil ihrer gewonnenen Energie als Wärme an die Umwelt ab (Zibilske in (Sylvia, 1998). Zum aeroben Abbau befähigte Mikroorganismen sind primär vorhanden bzw. können künstlich in das zu behandelnde Substrat eingearbeitet werden und werden anschließend in offenen oder Folien-bedeckten Kompostmieten (windrows) über mehrere Monate gelagert. Die Kompostierung verläuft in mehreren Phasen, wobei in der mesophilen Phase (T < 40°C) andere Organismengemeinschaften vorherrschen als in der thermophilen Phase (T 40–70°C). Bei Temperaturen über 70°C werden neben Nematoden auch andere Mikroorganismen und Unkrautsamen zerstört, sodass die Resterde vom phytosanitären Standpunkt her als unbelastet gelten kann. Eine Temperaturbehandlung von 55°C über 3 Tage wird in den meisten Protokollen bereits als ausreichend empfohlen, um Schadorganismen wirksam abzutöten (LaMondia & Brodie, 1984; Evans, 1991). Eine Temperatur von 60°C für 2 d tötete G. rostochiensis ebenfalls komplett ab (Noble & Roberts, 2004; Steinmöller et al., 2012). Feuchtigkeit ist für die Wirkung der Hitzebehandlung maßgeblich. Es wird berichtet, dass trockene Zysten bis zu 1 h einer Temperatur von 100°C widerstehen können und auch eine Lagerung für 16 h bei 80°C mit einer Überlebensrate von 34 % überdauern können (Heinicke, 1989). Feuchte Zysten werden demgegenüber bereits bei Temperaturen von 70°C bzw. 3 d bei 50°C komplett abgetötet. Stallmist wirkt bei der Kompostierung gemeinsam mit Resterden wesentlich effizienter als reine Komposterde. Dabei wird die höhere Wirkung des Stallmistes stärker auf die beim Abbau des organischen Materials entstehenden Gase als auf die Temperatur selbst zurückgeführt (Heinicke, 1989). Der Nachteil der Methode sind inkonsistente Temperaturbedingungen der Miete durch v. a. kältere Bereiche am Rand, was nur durch eine Störung des Prozesses mittels nochmaliger Vermischung nach 6–7 Wochen abzustellen wäre.
Eine künstliche Temperaturerhöhung durch Sonnenbestrahlung auf mit PE-Folie abgedeckte Erde ist ein weiterer – mit Einschränkungen – effektiver Ansatz zur Resterdenbehandlung. Allerdings konnte bereits bei einer Schichtdicke der Erde von 10 und 15 cm keine vollständige Abtötung der Nematoden (am Bsp. von G. rostochiensis 96 % Letalität in einer Tiefe von 15 cm) erreicht werden, während die Letalität bei 5 cm Schichtdicke konstant 100 % betrug (LaMondia & Brodie, 1984). Die Bodentemperatur erreichte dabei in 5 cm Tiefe bis zu 47°C für eine Stunde, wobei an mehreren aufeinanderfolgen Tagen Temperaturen von 38°C erreicht wurden. In 10 und 15 cm Tiefe waren Temperaturen unter 30°C zu verzeichnen. Erstaunlicherweise war der Temperatureffekt unter transparenter PE-Folie signifikant stärker als unter schwarzer Folie. Nachteile sind eine Beschränkung der Anwendung auf die Sommermonate (in gemäßigten Breiten der Zeitraum von Mitte Juni bis Mitte August (Dong et al., 2013)) und keine kontinuierliche Planbarkeit der witterungsabhängigen Behandlung. Trotzdem kann das Verfahren als Zwischenlösung bei hohem Resterdenaufkommen nach Verarbeitungs- Kampagnen potentiell genutzt werden. Vergleichbar mit den Untersuchungen zur Kompostierung reagieren auch hier feuchte Zysten sensitiver auf die thermophile Behandlung als trockene Zysten (LaMondia & Brodie, 1984).
Eine weitere Methode zur thermischen Behandlung der Resterde ist die physikalische Bodenentseuchung mittels Einleitung von heißem Wasserdampf. (Crüger, 1983). Dabei werden innerhalb kurzer Zeit durch Dämpfungsgeräte wie dem Dämpfpflug, die auf der Basis von Niederdruckdampf (0,5 bar) bzw. Hochdruckdampf (1,5 bar) arbeiten, Temperaturen von über 70°C erreicht, die in der gartenbaulichen Praxis als ausreichend angesehen werden, um Nematoden abzutöten (Crüger, 1983). Demgegenüber werden andere bodenbürtige Schadorganismen an der Kartoffel wie Bakterien und Viren nur bei Temperaturen von 80–90°C wirksam bekämpft. Es bleibt zu untersuchen, ob durch die Einleitung heißen Wasserdampfes Unterschiede zwischen trockenen und feuchten Zysten zu beobachten sind, die bei den meisten thermischen Behandlungsverfahren einen erheblichen Einfluss auf die Wirksamkeit der Behandlung hinsichtlich der Nematodenüberlebensrate aufwiesen (Heinicke, 1989). Mit Ausnahme der Zuckerfabrik Euskirchen (nach (Hessler, 2016) wurden physikalische Bodenentseuchungsmaßnahmen mittels direkter oder indirekter Einleitung von Wasserdampf in Deutschland bisher nicht zur Entseuchung von Resterden und Verarbeitungsrückständen verwendet, da die Anwendung des Verfahrens hohe Investitionen in die Errichtung großer Heizflächen sowie hohe Energiekosten trotz weiterführender Nutzung des Dampfes für Heizschritte in der Fabrik zur Folge hat. Eine direkte Einleitung des Wasserdampfes in den Boden wird momentan bei den anfallenden großen Resterdemengen als unwirtschaftlich angesehen (Hessler, 2016).
Die Anwendung von Mikrowellen wird bereits seit den 1950er Jahren in vereinzelten Versuchen zur physikalischen Bodenentseuchung beschrieben (Nelson, 1996a). Während frühe Versuche noch mittels relativ ineffizienter dielektrischer Hochfrequenz von 27 MHz arbeiteten (Eglitis et al., 1956), haben Versuche in den 1970er Jahren mittels Haushaltsmikrowellen (Frequenz 2450 MHz) bei allerdings sehr kleinen Bodenvolumina (90 bis 400 cm3) und niedriger Eindringtiefe (1,7 cm) der magnetischen Strahlungswellen bereits nach 30 sec eine völlige Entseuchung von Eiern und juvenilen Stadien der freilebenden Nematodenart Meloidogyne incognita erzielt (O'Bannon & Good, 1971), wobei auch die Behandlung von Zystennematoden (Heterodera glycines an Soja, (Rahi & Rich, 2008) erfolgreich demonstriert werden konnte. Die Behandlungswirkung wurde bereits damals ausschließlich auf die Erhitzung des Bodens und nicht auf eine Wirkung der Mikrowellenstrahlung zurückgeführt (O'Bannon & Good, 1971; Nelson, 1996a). Demgegenüber steht allerdings eine Reihe praxisnaher Untersuchungen, die abhängig von der Eindringtiefe bei bis zu 5 cm gute Behandlungserfolge gegen Nematoden erzielten, für die jedoch bereits ab 10 cm Tiefe keine entseuchende Wirkung mehr festgestellt werden konnte (Nelson, 1996a). Die Mikrowellen-Bestrahlung muss v. a. hinsichtlich der Behandlungsdauer an Bodenart, Bodenmenge und Bodenwassergehalt angepasst werden, um eine wirksame Entseuchung der Resterde von Zystennematoden zu gewährleisten (Van Wambeke et al. 1983 in (Nelson, 1996a). Eine signifikante Abschwächung der Strahlung (attenuation) tritt v. a. bei hohem Feuchtegehalt des Bodens auf, da feuchter Boden im Gegensatz zu trockenem Boden einen hohen Teil der elektromagnetischen Energie absorbiert (Van Assche and Uytteboek 1983 in (Nelson, 1996a). Neuere Studien aus den Jahren 2007 und 2011 belegen, dass es mittels fortgeschrittener Mikrowellenanlagen und einer gezielten Schichtung der zu behandelnden Erde mit einer oberen Schicht aus 6 cm trockener Erde und einer unteren Schicht mit ca. 10 cm feuchter Erde zu einer schnelleren Temperaturerhöhung und höheren Effizienz der Behandlung von Nematoden (Rotylenchus reniformis) kommt und damit auch energieeffizienter gearbeitet werden kann (Rahi & Rich, 2008, 2011). Da der Boden zumindest kurzzeitig (30 sec bis 180 sec) auf 100°C erhitzt werden muss, werden erhebliche Mengen von Energie verbraucht (1256 J/(kg°K) (Nelson, 1996b). In praxisnahen Bestrahlungsverfahren (z. B. Lebensmittelindustrie) kommen Hochleistungs-Magnetrone für die Erzeugung der elektromagnetischen Energie zum Einsatz (Abb. 9). Diese Anlagen ermöglichen eine homogene Behandlung der Resterden bei allerdings wesentlich geringerem Energieverbrauch im Vergleich zur Dämpfung bei gleicher Resterdemenge.
Der Einsatz von ionisierender Strahlung ist, neben seiner breiten Anwendung in der Sterilisation von Verpackungen u. a. zur Aufbewahrung von Lebensmitteln, auch ein international anerkanntes physikalisches Verfahren zur Bekämpfung phytopathogener Schaderreger wie Bakterien, Pilze, Nematoden und Insekten in verschiedenen Materialien (FAO, 2003/2016). Das Verfahren wird wegen der umweltschonenden und rückstandslosen Behandlung des Materials als Alternative zu chemischen Begasungsmitteln eingesetzt (Schröder, 1999; FAO, 2003/2016; McNamara et al., 2003). Ionisierende Strahlung kann dabei entweder durch radioaktiven Zerfall (γ-Strahlung) von Cobalt 60 (Co60) oder Caesium 137 (Cs137) oder durch Beschleunigung von Elektronen in einer Hochenergiebeschleunigungsanlage von 10 MeV (Mega-Elektronen-Volt) bei maximaler Leistung von 150 KW erzeugt werden. Die Behandlung von mit Schaderregern belastetem Material ist über beide Verfahren mit keiner radioaktiven Belastung des Materials verbunden. Das Material wird also nach der Behandlung nicht selbst zur Strahlungsquelle (McNamara et al., 2003) siehe auch u. a. ISPM 18 (FAO, 2003/2016)). Die Wirkung der Bestrahlung beruht auf (i) direkten Mechanismen durch Schädigung der DNA (Strangbrüche und mutative Basenveränderung) und (ii) indirekten Prozessen einer Radiolyse des Wassers im Zytoplasma bei gleichzeitiger Freisetzung oxidativ wirksamer Radikale in der Zelle (Jackson et al. 1967 in (McNamara et al., 2003). Breite Anwendung findet eine Behandlung mit ionisierender Strahlung in der Behandlung von Verpackungsholz (siehe ISPM 15 (FAO, 2017)) zur Bekämpfung darin enthaltener Insekten (z. B. Asiatischer Laubholzbockkäfer) und Nematoden (Kiefernholznematode) und der Behandlung von Saatgut zur Bekämpfung darin enthaltener Pilze. (Schröder, 1999). Unter dem Aspekt der Behandlung von Resterden wurde es bisher noch nicht eingesetzt. Es liegen eine Reihe von Studien vor, die eine erfolgreiche Behandlung von im Boden enthaltenen Bakterien, Pilzen und Nematoden mittels ionisierender Strahlung belegen (Evans, 1970; Chinnasri et al., 1997; McNamara et al., 2003). Die Anfälligkeit richtet sich dabei nach der Komplexität des Organismus, je einfacher dieser strukturiert ist, umso widerstandsfähiger erweist er sich gegen eine Strahlenbehandlung (Chinnasri et al., 1997; McNamara et al., 2003). Zur Sterilisation von Bakterien wird daher nach (McNamara et al., 2003) mit 20–25 KGy (Kilogray) die höchste Dosis veranschlagt, gefolgt von Pilzen (10–15 KGy) und Nematoden (5–15 KGy, nach ISPM 18 empfohlene Dosis: 4 KGy). Nematodenarten zeigen eine hohe Variation in ihrer Sensitivität gegenüber einer Bestrahlung, so war G. rostochiensis wesentlich anfälliger als H. schachtii (Townshend, 1967). Chinnarsi und Kollegen konnten nachweisen, dass eine Dosis von 7,5 KGy den Tod freilebender Juveniler und adulter Nematoden der Art M. incognita innerhalb eines Tages bewirkte, während 6,25 KGy den Schlupf der Eier verhinderte und eine Dosis von 4,25 KGy nicht letal war, jedoch die weitere Infektion von Pflanzen durch die behandelten Nematoden herabsetzte (Chinnasri et al., 1997). Auch bei der Strahlenbehandlung scheinen zudem feuchte Zysten stärker sensitiv zu reagieren als trockene Zysten (Evans, 1970). Die Nematoden sind dabei zumeist auch noch über Tage und Wochen lebensfähig (~40 d) (McNamara et al., 2003), können sich aber nur noch vermindert fortpflanzen (Evans, 1970; Chinnasri et al., 1997) und sind damit in ihrer Entwicklungsfähigkeit bis hin zum Abschluss ihres Entwicklungszyklus eingeschränkt (Evans, 1970).
Die geschilderten Behandlungsverfahren stellen alle potentiell geeignete, hoch wirksame und breit anwendbare Behandlungsmöglichkeiten für Resterden zur Bekämpfung von Globodera spp. dar. Da bisher allerdings Studien zur Anwendbarkeit und Wirksamkeit dieser Methoden bei größeren Bodenmengen unter Freilandbedingungen fehlen, werden sie aktuell in der KartKrebs/KartZystV (noch) nicht berücksichtigt. Um die Verfahren hinsichtlich ihrer Wirksamkeit und einer möglichen Übertragbarkeit in die Praxis zu bewerten, stehen sie unter Begutachtung im Projekt GlobRISK. Die Verfahren werden hinsichtlich der anzuwendenden Minimaldosis für physikalische Verfahren auf Grundlage einer thermischen Behandlung, Behandlung mit Mikrowellen und ionisierender Bestrahlung geprüft. Parallel erfolgt die Erprobung von Verfahren zur Bewertung der Lebens- und Entwicklungsfähigkeit der Zystennematoden. Gegenwärtig sind, trotz 120-jähriger Forschung, noch keine geeigneten Maßnahmen zur Bekämpfung von S. endobioticum gefunden. Eine mögliche Vorgehensweise könnte die Kombination verschiedener Verfahren sein.
Eine großflächige Ausrottung der Kartoffelzystennematoden und des Kartoffelkrebs-Erregers ist nach bisherigen Erkenntnissen mit konventionellen Maßnahmen nicht mehr möglich und durch diese Schaderreger ist nach wie vor mit hohen Ertragseinbußen bei Befall zu rechnen. Umso wichtiger ist es, die Ausbreitungs- und Verschleppungsmöglichkeiten beider Organismen insbesondere über Resterden zu unterbinden. Wünschenswert ist eine Dekontaminierung von verseuchten Erden, um eine mehrjährige Deponierung in den Verarbeitungsbetrieben und damit den Austrag von Erden aus der landwirtschaftlichen Nutzung zu vermeiden. Deshalb forscht das JKI einerseits an praxistauglichen und ökonomisch sinnvollen Maßnahmen zur Dekontamination mit Zystennematoden belasteten Resterden, legt andererseits aber auch durch die Forschung an optimierten Nachweisverfahren des Kartoffelkrebserregers in Resterden Grundsteine für weitere Arbeiten. Denn neben den an Kartoffelzystennematoden zu etablierenden Dekontaminationsmaßnahmen strebt das Julius Kühn-Institut ebenfalls zukünftig eine intensivere Forschung im Bereich der Dekontaminierung von mit Dauersori des Kartoffelkrebs-Erregers belasteten Resterden an.
Wir danken der Bundesanstalt für Landwirtschaft und Ernährung (BLE) für die Finanzierung des GlobRISK und des INNOKA-Projektes. Michael Becker danken wir für seine Karikatur zur Resterde-Problematik.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Allen, C., 2005: Bacterial wilt disease and the Ralstonia solanacearum species complex.
Angus, J.F., P.A. Gardner, J.A. Kirkegaard, J.M. Desmarchelier, 1994: Biofumigation: Isothiocyanates released frombrassica roots inhibit growth of the take-all fungus. Plant and Soil 162 (1), 107–112, DOI: 10.1007/BF01416095.
Anonym, 1969a: Richtlinie 69/464/EWG des Rates vom 8. Dezember 1969 zur Bekämpfung des Kartoffelkrebses, URL: https://eur-lex.europa.eu/legal-content/DE/TXT/HTML/?uri=CELEX:31969L0464&from=EN.
Anonym, 1969b: Richtlinie 69/465/EWG des Rates vom 8. Dezember 1969 zur Bekämpfung des Kartoffelnematoden, URL: https://eur-lex.europa.eu/legal-content/DE/TXT/HTML/?uri=CELEX:31969L0465&from=DE.
Anonym, 2007: Council Directive 2007/33/EC of 11 June 2007 on the control of potato cyst nematodes and repealing Directive 69/465/EEC. Official Journal of the European Communities L. (156), 12-22.
Anonym, 2010: KartKrebs/KartZystV - Verordnung zur Bekämpfung des Kartoffelkrebses und der Kartoffelzystennematoden. Zugriff: 14. Mai 2020, URL: https://www.gesetze-im-internet.de/kartkrebs_kartzystv/BJNR138300010.html.
Anonym, 2016: Verordnung (EU) 2016/2031 des Europäischen Parlaments und des Rates vom 26. Oktober 2016 über Maßnahmen zum Schutz vor Pflanzenschädlingen, zur Änderung der Verordnungen (EU)Nr. 228/2013, (EU) Nr. 652/2014 und (EU) Nr. 1143/2014 des Europäischen Parlaments und des Rates und zur Aufhebung der Richtlinien 69/464/EWG, 74/647/EWG, 93/85/EWG, 98/57/EG,2000/29/EG, 2006/91/EG und 2007/33/EG des Rates (zuletzt geändert durch Verordnung (EU) 2017/625 und Berichtigung AB. EU 35/5 1vom 7.2.20). Amtblatt der Europäischen Union L 317/4.
Anthoine, G., E. Grenier, E. Petit, S. Fournet, 2010: A cyst nematode'species factory'called the Andes. Nematology 12 (2), 163-169.
Artschwager, E., 1923: Anatomical studies on potato-wart.
Baayen, R.P., G. Cochius, H. Hendriks, J.P. Meffert, J. Bakker, M. Bekker, P.H.J.F. van den Boogert, H. Stachewicz, G.C.M. van Leeuwen, 2006: History of potato wart disease in Europe – a proposal for harmonisation in defining pathotypes. European Journal of Plant Pathology 116 (1), 21–31, DOI: 10.1007/s10658-006-9039-y.
Becker, Y., K. Green, B. Scott, M. Becker, 2018: Artificial inoculation of Epichloë festucae into Lolium perenne, and visualization of endophytic and epiphyllous fungal growth. Bio-protocol 8, e2990.
Been, T.H., C.H. Schomaker, 1996: A new sampling method for the detection of low population densities of potato cyst nematodes (Globodera pallida and G. rostochiensis). Crop Protection 15 (4), 375–382, DOI: 10.1016/0261-2194(96)89822-X.
Behrens, E., 1975: GIobodera, eine selbständige Gattung in der Unterfamilie Heteroderinae, (Nematoda: Heteroderidae). 1. Vortragstagung zu aktuellen Problemen der Phytonematologie (Rostock, 29. Mai 1975), p. 12-26.
BLE, 2020: Bericht zur Markt- und Versorgungslage Kartoffeln, URL: https://www.ble.de/SharedDocs/Downloads/DE/BZL/Daten-Berichte/Kartoffeln/2019BerichtKartoffeln.pdf?__blob=publicationFile&v=2.
Blok, W.J., J.G. Lamers, A.J. Termorshuizen, G.J. Bollen, 2000: Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping. Phytopathology 90 (3), 253–259, DOI: 10.1094/PHYTO.2000.90.3.253.
Brodie, B.B., W.F. Mai, 1989: Control of the golden nematode in the United States. Annual Review of Phytopathology. Vol. 27, 443-461.
Buskov, S., B. Serra, E. Rosa, H. Sørensen, J.C. Sørensen, 2002: Effects of intact glucosinolates and products produced from glucosinolates in myrosinase-catalyzed hydrolysis on the potato cyst nematode (Globodera rostochiensis cv. Woll). Journal of Agricultural and Food Chemistry 50 (4), 690–695, DOI: 10.1021/jf010470 s.
Canto-Saenz, M., D. de Pomerai, I.F. Bendezu, P.R. Burrows, K. Evans, 1998: Inter and intra-specific genomic variability of the potato cyst nematodes Globodera pallida and G. rostochiensis from Europe and South America using RAPD-PCR. Nematologica 44 (1), 49-61.
Chinnasri, B., J.H. Moy, B.S. Sipes, D.P. Schmitt, 1997: Effect of gamma-irradiation and heat on root-knot nematode, Meloidogyne javanica. Journal of Nematology 29 (1), 30-34.
Crüger, G., 1983: Pflanzenschutz im Gemüsebau. Stuttgart, Ulmer.
Curtis, K.M., 1921: IX.—The life-history and cytology of Synchytrium endobioticum (Schilb.), Perc., the cause of wart disease in potato. Philosophical Transactions of the Royal Society of London. Series B, Containing Papers of a Biological Character 210 (372-381), 409-478.
Dong, Z., R. Hou, Q. Chen, Z. Ouyang, F. Ge, 2013: Response of soil nematodes to elevated temperature in conventional and no-tillage cropland systems. Plant and Soil 373 (1-2), 907–918, DOI: 10.1007/s11104-013-1846-2.
Ebrahimi, N., N. Viaene, J. Aerts, J. Debode, M. Moens, 2016: Agricultural waste amendments improve inundation treatment of soil contaminated with potato cyst nematodes, Globodera rostochiensis and G. pallida. European Journal of Plant Pathology 145 (4), 755-775.
Eglitis, M., F. Johnson, E.P. Breakey, 1956: Soil pasteurization with high frequency energy. Phytopathology 46, 635-636.
Elphinstone, J.G., H. Stanford, de Stead, 2008: Survival and transmission of Ralstonia solanacearum in aquatic plants of Solatium dulcamara and associated surface water in England. EPPO Bulletin 28 (1-2), 93-94.
Elphinstone, J.G., H.M. Stanford, D.E. Stead, 2011: Detection of Ralstonia solanacearum in potato tubers, Solanum dulcamara and associated irrigation water. In: Bacterial Wilt Disease: Molecular and Ecological Aspects. Prior, P., C. Allen, J. Elphinstone (Hrsg.), Berlin, Heidelberg, Springer Verlag, S. 133–139, DOI: 10.1007/978-3-662-03592-4.
EPPO, 2017b: Diagnostics PM 7/28 (2) Synchytrium endobioticum. Bulletin OEPP/EPPO Bulletin 47 (3), 420-440.
EPPO, 2017a: PM 3/59 (3) Synchytrium endobioticum: descheduling of previously infested plots. OEPP/EPPO Bulletin 47 (3), 366-368.
Esmarch, F., 1928: Untersuchungen zur Biologie des Kartoffelkrebses. III. Angew. Bot 10, 280-304.
Evans, K., 1970: The effects of gamma radiation on Heterodera rostochiensis. Nematologica 16 (2), 284-294.
Evans, K., 1991: Lethal temperatures for eggs of Globodera rostochiensis, determined by staining with new blue r. Nematologica 37 (1-4), 225–229, DOI: 10.1163/187529291X00204.
FAO, 2003/2016: ISPM 18 Guidelines for the use of irradiation as a phytosanitary measure. International Standards for Phytosanitary Measures. International Plant Protection Convention, 16.
FAO, 2017: ISPM15 Regulation of wood packaging material in international trade. International Standards for Phytosanitary Measures. International Plant Protection Convention.
Flath, K., S. Steinmöller, 2018: Ein altbekannter und zugleich hochaktueller Quarantäneschaderreger - Aktuelle Forschungsergebnisse zum Kartoffelkrebs. Kartoffelbau: die Fachzeitschrift für Spezialisten 69 (3), 1-4.
Greco, N., R.N. Inserra, A. Brandonisio, A. Tirro, G. de Marinis, 1988: Life-cycle of Globodera rostochiensis on potato in Italy. Nematologia Mediterranea 16, 69-73.
Heinicke, D., 1989: Spread of nematodes with sludge and sewage. Kartoffelbau 40 (6), 221-224.
Hessler, A., 2016: Möglichkeiten zur Behandlung der Rüttelerde.
Hominick, W.M., 1986: Photoperiod and diapause in the potato cyst-nematode, Globodera rostochiensis. Nematologica 32 (4), 408–418, DOI: 10.1163/187529286X00291.
Jackson, N.E., J.C. Corey, L.R. Frederick, J.C. Picken Jr., 1967: Gamma irradiation and the microbial population of soils at two water contents. Soil Sci. Soc. Am. 31, 491-494.
Jimenez-Perez, N., R. Crozzoli, N. Greco, 2009: Life-cycle and emergence of second stage juveniles from cysts of Globodera rostochiensis in Venezuela. Nematologia Mediterranea 37 (2), 155-160.
Kort, J., H. Ross, A.R. Stone, H.J. Rumpenhorst, 1977: An international scheme for identifying and classifying pathotypes of potato cyst-nematodes Globodera rostochiensis and G. pallida. Nematologica 23 (3), 333-339.
LaMondia, J.A., B.B. Brodie, 1984: Control of Globodera rostochiensis by solar heat. Plant Disease 68 (6), 474-476.
Lazzeri, L., G. Curto, O. Leoni, E. Dallavalle, 2004: Effects of glucosinolates and their enzymatic hydrolysis products via myrosinase on the root-knot nematode Meloidogyne incognita (Kofoid et White) Chitw. Journal of Agricultural and Food Chemistry 52 (22), 6703–6707, DOI: 10.1021/jf030776u.
Lord, J.S., L. Lazzeri, H.J. Atkinson, P.E. Urwin, 2011: Biofumigation for control of pale potato cyst nematodes: Activity of brassica leaf extracts and green manures on Globodera pallida in vitro and in soil. Journal of Agricultural and Food Chemistry 59 (14), 7882–7890, DOI: 10.1021/jf200925k.
Marks, R.J. (Hrsg.), 1998: Potato cyst nematodes: Biology, distribution and control, Wallingford, Oxon, CAB Internat.
Matthiessen, J.N., J.A. Kirkegaard, 2006: Biofumigation and enhanced biodegradation: opportunity and challenge in soilborne pest and disease management. Critical Reviews in Plant Sciences 25 (3), 235-265.
McNamara, N.P., H.I.J. Black, N.A. Beresford, N.R. Parekh, 2003: Effects of acute gamma irradiation on chemical, physical and biological properties of soils. Applied Soil Ecology 24 (2), 117–132, DOI: 10.1016/S0929-1393(03)00073-8.
Nelson, S.O., 1996a: A review and assessment of microwave energy for soil treatment to control pests. Transactions of the ASAE 39 (1), 281-289.
Nelson, S.O., 1996b: A review and assessment of microwave energy for soil treatment to control pests. Transactions of the American Society of Agricultural Engineers 39 (1), 281-289.
Niere, B., S. Krüssel, K. Osmers, 2014: Auftreten einer außergewöhnlich virulenten Population der Kartoffelzystennematoden. Journal für Kulturpflanzen 66 (12), 426-427.
Noble, R., S.J. Roberts, 2004: Eradication of plant pathogens and nematodes during composting: A review. Plant Pathology 53 (5), 548–568, DOI: 10.1111/j.0032-0862.2004.01059.x.
O'Bannon, J.H., J.M. Good, 1971: Applications of microwave energy to control nematodes in soil. Journal of Nematology 3 (1), 93-94.
Oostenbrink, M., 1950: Het aardappelaaltje:(Heterodera rostochiensis Wollenweber), een gevaarlijke parasiet voor de eenzijdige aardappel-cultuur, Veenman.
Percival, J., 1910: Potato “wart” disease: the life history and cytology of Synchytrium endobioticum (Schilb.) Percl. Zentralblatt für Bakteriologie, Parasitenkunde, Infektionskrankheiten 25:440–447.
Perry, R.N., M. Moens (Hrsg.), 2013: Plant Nematology, Wallingford, CABI.
Perry, R.N., D.J. Wright (Hrsg.), 1998: The physiology and biochemistry of free-living and plant-parasitic nematodes, Wallingford, CABI Publishing.
Phillips, M.S., D.L. Trudgill, 1998: Variation of virulence, in terms of quantitative reproduction of Globodera pallida populations, from Europe and South America, in relation to resistance from Solanum vernei and S. tuberosum ssp. andigena CPC 2802. Nematologica 44 (4), 409-423.
Plantard, O., D. Picard, S. Valette, M. Scurrah, E. Grenier, D. MUGNIÉRY, 2008: Origin and genetic diversity of Western European populations of the potato cyst nematode (Globodera pallida) inferred from mitochondrial sequences and microsatellite loci. Molecular Ecology 17 (9), 2208-2218.
Potocek, J., 1991: Methods of direct protection against potato cyst nematode (Globodera rostochiensis). Rostlinna Vyroba-UVTIZ (CSFR).
Przetakiewicz, J., 2015: The viability of winter sporangia of Synchytrium endobioticum (Schilb.) Perc. from Poland. American Journal of Potato Research 92 (6), 704-708.
Radtke, W., W. Rieckmann, F. Brendler, 2000: Kartoffel: Krankheiten - Schädlinge - Unkräuter. Gelsenkirchen, Mann.
Rahi, G.S., J.R. Rich, 2008: Potential of microwaves to control plant-parasitic nematodes in soil. The Journal of microwave power and electromagnetic energy: a publication of the International Microwave Power Institute 42 (1), 5-12.
Rahi, G.S., J.R. Rich, 2011: Effect of Moisture on efficiency of microwaves to control plant - Parasitic nematodes in soil. The Journal of microwave power and electromagnetic energy: a publication of the International Microwave Power Institute 45 (2), 86–93, DOI: 10.1080/08327823.2011.11689802.
Rawsthorne, D., B.B. Brodie, 1987: Movement of potato root diffusate through soil. Journal of Nematology 19 (1), 119-122.
Runia, W.T., L.P. Molendirk, D.J. Ludeking, C.H. Schomaker, 2012: Improvement of anaerobic soil disinfestation. Communications in Agricultural and Applied Biological Sciences 77 (4), 753-762.
Schenk, M., M. Camilleri, M. Diakaki, G. Schrader, S. Vos, 2019: Pest survey card on Synchytrium endobioticum. EFSA Supporting Publications 16 (4), DOI: 10.2903/sp.efsa.2019.EN-1591.
Schilberszky, K., 1896: A new parasite causing potato wart disease (in German). Berichte der Deutschen Botanischen Gesellschaft, 14:36–37.
Schleusner, Y., P. Müller, M. Bandte, M. Heiermann, C. Büttner, 2019: Synchytrium endobioticum–risk from biogas plants? EPPO Bulletin 49 (1), 92-103.
Schröder, T., 1999: Über die Eignung verschiedener physikalisch-technischer Verfahren zur phytosanitären Behandlung und zur Lagerung von Forstsaatgut unter besonderer Berücksichtigung der Stiel- und Traubeneiche. Zugl.: Göttingen, Univ., Diss., 1998, Parey.
Scurrah, M.M. de, M.C. Saenz, 1977: Races of the potato cyst nematode in the Andean region and a new system of classification. Nematologica 23 (3), 340-349.
Seinhorst, J.W., 1965: The relation between nematode density and damage to plants. Nematologica 11 (1), 137-154.
Spaull, A.M., D.M. McCormack, 1988: The incidence and survival of potato cyst nematodes (Globodera spp.) in various sewage sludge treatment processes. Nematologica 34 (4), 452-461.
Statistisches Bundesamt, 2020: Feldfrüchte und Grünland, URL: https://www.destatis.de/DE/Home/_inhalt.html.
Steinmöller, S., M. Bandte, C. Büttner, P. Müller, 2012: Effects of sanitation processes on survival of Synchytrium endobioticum and Globodera rostochiensis. European Journal of Plant Pathology 133 (3), 753-763.
Stelter, H., 1974: Die Verschleppung von Heterodera- und Globodera-Arten mit dem Abwasser aus einer Zuckerfabrik. Nachrichtenbl Pflanzenschutz DDR 35 (2), 36-38.
Stone, A.R., 1973: Heterodera pallida n. sp. (Nematoda: Heteroderidae), a second species of potato cyst nematode. Nematologica 18, 591-606.
Stone, A.R., 1979: Co-evolution of nematodes and plants. Symbolae Botanicae Uppsala (22), 46-61.
Stremińska, M.A., W.T. Runia, A.J. Termorshuizen, H. Feil, A.W.G. Van Der Wurff, 2014: Anaerobic soil disinfestation in microcosms of two sandy soils. Communications in Agricultural and Applied Biological Sciences 79 (2), 15-19.
Sylvia, D.M. (Hrsg.), 1998: Principles and applications of soil microbiology: Composting of organic wastes, Upper Saddle River, NJ, Prentice Hall.
Townshend, J.L., 1967: Gamma irradiation of Heterodera schachtii 1. Nematologica 13 (4), 586-592.
Tsutsumi, M., 1976: Conditions for collecting the potato root-diffusate and the influence on the hatching of potato cyst nematode. Japanese Journal of Nematology 6, 10-13.
Turner, S.J., 1996: Population decline of potato cyst nematodes (Globodera rostochiensis, G. pallida) in field soils in Northern Ireland. Annals of Applied Biology 129 (2), 315–322, DOI: 10.1111/j.1744-7348.1996.tb05754.x.
Turner, S.J., 1998: Sample preparation, soil extraction and laboratory facilities for the detection of potato cyst nematodes. Potato cyst nematodes. Biology, distribution and control, 75-90.
van Assche, C., P. Uytebroek, 1983: Possibilities of microwaves on soil disinfestation. EPPO Bulletin/Bulletin OEPP 13 (3), 491–497.
van de Vossenberg, B.T.L.H., B. Brankovics, H.D.T. Nguyen, M.P.E. van Gent-Pelzer, D. Smith, K. Dadej, J. Przetakiewicz, J.F. Kreuze, M. Boerma, G.C.M. van Leeuwen, C. André Lévesque, T.A.J. van der Lee, 2018: The linear mitochondrial genome of the quarantine chytrid Synchytrium endobioticum; insights into the evolution and recent history of an obligate biotrophic plant pathogen. BMC Evolutionary Biology 18 (1), 136, DOI: 10.1186/s12862-018-1246-6.
van der Wolf, J.M., J.G. Elphinstone, de Stead, M. Metzler, P. Müller, A. Hukkanen, R. Karjalainen, 2005: Epidemiology of Clavibacter michiganensis subsp. sepedonicus in relation to control of bacterial ring rot, PRI Bioscience.
van Overbeek, L., W. Runia, P. Kastelein, L. Molendijk, 2014: Anaerobic disinfestation of tare soils contaminated with Ralstonia solanacearum biovar 2 and Globodera pallida. European Journal of Plant Pathology 138 (2), 323-330.
van Wambeke, E., J. Wijsmans und P. d´Hertefelt, 1983: Possibillities in microwave application for growing substrate disinfestation. Acta Horticulturae (152), 209–217.
Weiss, F., 1925: The conditions of infection in potato wart. American Journal of Botany, 413-443.
Whitehead, A.G., 1995: Decline of potato cyst nematodes, Globodera rostochiensis and G. pallida, in spring barley microplots. Plant Pathology 44 (1), 191–195, DOI: 10.1111/j.1365-3059.1995.tb02728.x.
Wollenweber, H.W., 1923: Krankheiten und Beschädigungen der Kartoffel. Arbeiten des Forschungsinstitutes für Kartoffelbau 7, 52.
Zakopal, J., 1970: Neue Moglichkeiten zur Inaktivierung der Dauersporangien des Kartoffelkrebserregers Synchytrium endobioticum (Schilb.) Perc. Zentralb Bakteriol Parasitenk Infektionskr Hyg Abt 2 Naturw.