

Innovative Diagnosemethoden zum Nachweis holzzerstörender Insekten
Innovative diagnostic methods to detect harmful wood-inhabiting insects
Journal für Kulturpflanzen, 72 (9). S. 453–465, 2020, ISSN 1867-0911, DOI: 10.5073/JfK.2020.09.01, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Eine nicht-invasive Diagnose holzzerstörender Schadorganismen ist von großer Bedeutung um Eingriffe in kostbare Holzprodukte und lebende Bäume auf ein Minimum zu beschränken. Hier stellen wir zwei ganz unterschiedliche Methoden vor, eine physikalische und eine molekularbiologische, die einen schonenden Nachweis von Insektenlarven im Holz ermöglichen. Beide Methoden sind bereits zum Teil erfolgreich zur Analyse des Asiatischen Laubholzbockkäfers (Anoplophora glabripennis, ALB) eingesetzt worden und eignen sich als Frühwarnsysteme in der Bekämpfung von Quarantäneschadinsekten.
Stichwörter: Quarantäneschadorganismen, Anoplophora glabripennis, Frühwarnsysteme, moderne Diagnoseverfahren
Non-invasive diagnosis of harmful wood-inhabiting organisms is of great importance in order to minimize interventions in valuable wood products and living trees. Here we present two methods, an acoustical and a molecular one, which enable gentle detection of insect larvae in wood and wood products. In parts, both methods have been successfully applied for the analysis of the Asian longhorn beetle (Anoplophora glabripennis, ALB) and appear suitable as early warning systems in the control of quarantine insect pests.
Key words: Quarantine pests, Anoplophora glabripennis, Early warning system, Modern diagnostic tools, Acoustic emission
Der Klimawandel und globalisierte Märkte fördern die Verbreitung invasiver Arten wie z. B. des Asiatischen Laubholzbockkäfers (Anoplophora glabripennis MOTSCHULSKY; kurz ALB). Trotz internationaler phytosanitärer Standards zur Behandlung von Holzverpackungsmaterialien (IPPC Standard ISPM 15) kommt es bei Missachtung der Standards regelmäßig zur Verschleppung und damit zu einem ungewollten Import xylophager Insekten (zumeist im Larvenstadium). Bei klimatischer Kompatibilität der Insekten im Importland und geeigneter Wirtspflanzen stellt dies ein hohes wirtschaftliches Risiko dar (Wu et al., 2017). So ist in Mitteleuropa der ALB bereits vielfach aufgetreten, was über die Jahre in der Einrichtung von über 30 Quarantänezonen resultierte (EFSA et al., 2019; Hölling, 2015; Lemme, 2017).
Die in Ostasien heimische Bockkäferart steht symbolisch für eine Reihe gefährlicher Quarantäneschadorganismen, die in den letzten beiden Jahrzenten transkontinental verschleppt wurden. Sein immenses Schadpotenzial resultiert aus der großen Breite potentieller Wirtsbäume, und aus der Tatsache, dass der Käfer in der Lage ist, vitale Bäume zu besiedeln (EFSA et al., 2019). Der ALB ist daher seit Verabschiedung einer Delegierten-Verordnung (EU) 2019/1702 der Kommission vom 1. August 2019 auf einer Liste sogenannter Prioritärer Schädlinge veröffentlicht, die dadurch charakterisiert sind, dass
a) | sie nicht auf dem Gebiet der Europäischen Union oder nur in einem begrenzten Teil dieses Gebiets, oder nur selten, unregelmäßig, isoliert und sporadisch auftreten und |
b) | ihre potenziellen wirtschaftlichen, ökologischen oder sozialen Folgen für das Gebiet der Union am schwerwiegendsten sind. |
Ein amtlich bestätigter Befall dieser Käferart erfordert daher das Einschreiten des zuständigen Pflanzenschutzdienstes. Die dann einzuleitenden phytosanitären Maßnahmen sind im Durchführungsbeschluss (EU) 2015/893 geregelt. Das betrifft zum einen, die Einrichtung eines sogenannten abgegrenzten Gebietes (Quarantänezone), zum anderen auch die präventive Fällung spezifizierter Baumarten. Dies sind die Gehölze, in denen der Käfer nachweislich in der Lage ist, seinen kompletten Entwicklungszyklus zu vollziehen. Diese Entwicklung vom abgelegten Ei, über mehrere Larvenstadien und Verpuppung, bis zum adulten Käfer erstreckt sich unter hiesigen Klimabedingungen auf bis zu zwei Jahre. Diese vergleichsweise langen Entwicklungszeiträume erklären auch die Gefahren, die entstehen, wenn beispielsweise phytosanitär unbehandelte Holzprodukte Bestandteil des globalisierten Warenhandels sind, in denen sich der Käfer entwickeln und diese in neuen Lebensräumen unbemerkt verlassen kann.
Um den Import Insekten-befallener Holzgüter zu unterbinden und die Fällung potentieller Wirtsbäume in ALB-Befallsregionen auf ein Minimum zu beschränken, werden daher Methoden benötigt, die einen zweifelsfreien ALB Befund ermöglichen. Ein häufig angewandtes Standard-Diagnoseverfahren beruht auf dem PCR- und Sequenzier-gestützten Nachweis von DNA aus Larven oder anderen Entwicklungsstadien des Insekts (EPPO PM7/129) (EPPO, 2016). Sind jedoch nur Nagespäne oder Fraß des ALB an Holzgütern oder Bäumen auffindbar, liefert die Methode nach EPPO PM7/129 keine verwertbaren Ergebnisse.
In zwei Drittmittel-geförderten Projekten (ANOPLO-diag und InsectDetect) werden deshalb Methoden entwickelt und geprüft, die eine Diagnose von Schadorganismen in Abwesenheit sichtbarer Insektenstadien gewährleisten sollen (Abb. 1). Beiden Methoden ist gemeinsam, dass sie nicht-invasiv sind, also keine größeren Eingriffe in den Holzkörper (sowohl Möbelstücke und Verpackungsmaterial, als auch lebende Bäume) erfordern. Ziel des Forschungsvorhabens InsectDetect ist die Entwicklung eines praktikablen Begutachtungs- und Kontrollverfahrens, insbesondere für Verpackungs- und Nutzholz: Es soll ermöglicht werden, aktiven Befall durch Larven holzzerstörender Insekten festzustellen. Dazu werden zunächst sichtbare Befallsmerkmale (z. B. Bohrmehl und Ausfluglöcher) abgeprüft und Verdachtsfälle dann durch eine akustische Messung verifiziert oder ausgeschlossen. Ein Prüfergebnis soll idealerweise bereits nach einigen Stunden feststehen. Damit könnten Unsicherheiten in der Begutachtung eines Verdachtsfalls minimiert werden, wenn nicht feststellbar ist, ob Schadinsekten aktiv sind bzw. welcher Anteil einer Probe aktiv befallen ist. Zur Feststellung von Befallsmerkmalen kann auf gutachterliches Fachwissen zurückgegriffen werden. Für die Erkennung von ALB-Befall an stehenden Bäumen im Freiland gibt es bereits Schulungsmaterial (Lemme, 2015; Schröder, 2015; EFSA et al., 2019). Zudem sind Autoren des hier vorliegenden Artikels im Rahmen des ANOPLO-diag-Projektes gegenwärtig an der Verfassung eines morphologischen und molekularbiologischen Diagnosestandards der EPPO (Europäische und Mediterrane Pflanzenschutzorganisation) der Reihe PM7 beteiligt.
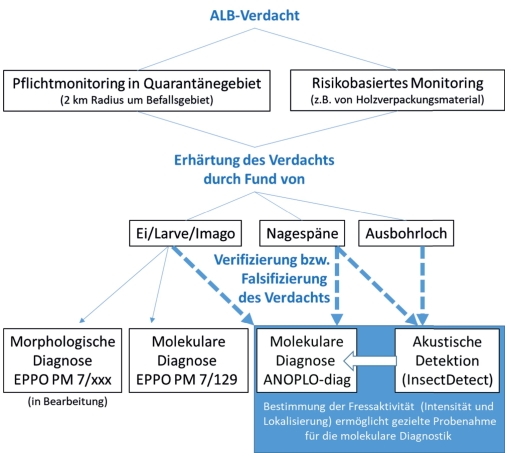
Abb. 1. Schematische Darstellung der Anwendung morphologischer und molekularer Methoden zur Diagnose von ALB und physikalischer Messungen zur Bestimmung der Fressaktivität von holzbewohnenden Insekten.
Schallemissionen fressender Insektenlarven, z. B. des Hausbockkäfers (Hylotrupes bajulus L.), können am Holz unter günstigen Umständen auch mit dem Ohr in einer Entfernung von einigen Dezimetern als Luftschall wahrgenommen werden. Um diese auszuwerten, wären allerdings eine ruhige kontrollierte Umgebung, mehrere Sensoren und eine Messdauer von einigen Stunden erforderlich. Daher ist die Messung von Körperschall mit an einer Probe fixierten Sensoren und eine automatische Aufzeichnung über einige Stunden wesentlich aussichtsreicher. Dazu eignet sich die Schallemissionsanalyse – gebräuchliche Abkürzung ist AE für acoustic emission. Es handelt sich um eine vielfach anwendbare akustische Mess- und Prüftechnik (Vallen, 2003). Körperschallemissionen von verschiedenartigen Bauteilen (z. B. Rohrleitungen, Behälter, tragende Konstruktionen) werden mit Beschleunigungsaufnehmern gemessen und im Zusammenhang z. B. mit mechanischen oder thermischen Belastungen analysiert. In diesem Artikel werden AE-Messungen an Insekten in Holz präsentiert.
Der Zusammenhang zwischen dem Fraßverhalten von Hausbockkäferlarven und messbaren Körperschallemissionen an Holzproben ist schon länger nachgewiesen (Pallaske, 1984). Typisch für diese Spezies sind eine gewisse Periodizität bei der Schallemissionsrate sowie Pausen, wenn das Material bewegt wird, und ein Zusammenhang zwischen Materialtemperatur und -feuchte. Auch im Fraunhofer Institut für Holzforschung (WKI) wurde das Messprinzip bereits vor einigen Jahren erprobt (Plinke, 1998). Messungen über einige Stunden mit Larven verschiedener Spezies (Creemers, 2015) zeigen, dass bei Trockenholzinsekten mit Ruheperioden der Larven in der Größenordnung von einigen Minuten bis Stunden zu rechnen ist. Es besteht auch ein deutlicher Zusammenhang zwischen der Holztemperatur und der messbaren Aktivität – je nach Spezies beginnt diese erst oberhalb von etwa 5°C oder 10°C (Nowakowska et al., 2017). Dieses Vorwissen kann für das akustische Prüfverfahren genutzt werden.
Für die Analyse und Bewertung einer unbeaufsichtigten Messung ist es wichtig, möglichst nur für Larvenaktivitäten signifikante Signale aufzunehmen. Danach müssen diese registrierten Einzelimpulse (Hits) gefiltert und auf der Zeitskala dargestellt werden, um übergeordnete Muster, zeitliche Häufung, Korrelationen zu Randbedingungen etc. zu erkennen. Einzelheiten des hier eingesetzten Verfahrens, exemplarische Messdaten und Bewertungskriterien sind im Anhang dargestellt. Zur Demonstration dient die Probenzusammenstellung in Abb. 2 mit bekannten, d.h. künstlich eingebrachten oder verifizierten Larven. Sie umfasst ein Kantholz mit zwei verschieden und in unterschiedlicher Entfernung von der Geräuschquelle (Hausbocklarve, Hylotrupes bajulus) angekoppelten Sensoren, eine Kleinprobe mit einer Splintholzkäferlarve (Lyctus brunneus) – beide zur Verfügung gestellt durch die MPA Eberswalde – und ein Baumscheibensegment mit Hausbockbefall (Probe von D. Lukowsky, WKI).

Abb. 2. Probenzusammenstellung zur Verifikation des Messverfahrens. Kanal 1 (grün): Sensor seitlich am linken Ende des Kantholzes in der Nähe der Larve (Hausbock) angeklemmt; Kanal 2 (rot): Sensor in Faserrichtung am Kantholz ca. 40 cm entfernt mit Magnethalter gekoppelt; Kanal 3 (gelb): Sensor axial an der Kleinprobe mit Larve (Splintholzkäfer) angeklemmt; Kanal 4 (blau): Sensor in Faserrichtung an einer Baumscheibe mit Larve (Hausbock) angeklemmt.
Die Messung über ca. 28 Stunden ergab in allen Proben deutliche Aktivitäten. Im Einzelnen ergab die qualitative Bewertung:
• | Aktivität im Kantholz mit einer Hausbocklarve erst nach ca. 3,5 Stunden; Kanal 2 erfasste aufgrund der Dämpfung durch den Abstand zur Quelle und die indirekte Kopplung deutlich weniger Hits |
• | Aktivität in der Kleinprobe mit einer Splintholzkäferlarve in den ersten 1,5 Stunden und in der letzten Stunde der Messung |
• | Aktivität in der Baumscheibe mit vermutlich mehreren Hausbocklarven, kontinuierliche Signale |
Mit gleicher Sensorik und Auswertemethodik wurden Freilandproben mit vermutetem ALB-Befall im Labor des JKI, Braunschweig untersucht. Im Juni 2019 wurden sie hierzu in einem Klimaschrank (konstant ca. 23°C/65 % r.F.) über einen Zeitraum von 148 Stunden gemessen (Abb. 3).

Abb. 3. Messaufbau im Klimaschrank. Freilandprobe aus Ahorn, Sensoren indirekt mit verschraubten Platten und Magnethaltern angekoppelt; Kanäle 1 (grün), 2 (rot) und 3 (gelb) radial seitlich, Kanal 4 (blau) in Faserrichtung; die hier gemessene Impulsrate ist in Abbildung 4 dargestellt.
Aktivitäten lassen sich für einen längeren Zeitraum sinnvoll darstellen als Verlauf der über die Versuchszeit gemessenen Impulsrate: Aus der Signalfilterung ergeben sich für eine Einzelaktivität (Biss der Larve durch eine unter Spannung stehende Holzfaser) signifikante Einzelimpulse. In Abb. 4 ist der Verlauf (Anzahl dieser „Hits“ über ein Zeitintervall von 10 sec) wiedergegeben. Auf allen vier Kanälen zeigten sich kontinuierliche Aktivitäten. Am stärksten waren diese in der Größenordnung von 100 Hits pro 10 sec in Kanal 2 (rot markiert, mittig auf der Probe), am schwächsten, aber immer noch deutlich in Kanal 4 (blau markiert, axial am Aststumpf) mit einer Impulsrate um 5 Hits pro 10 sec.
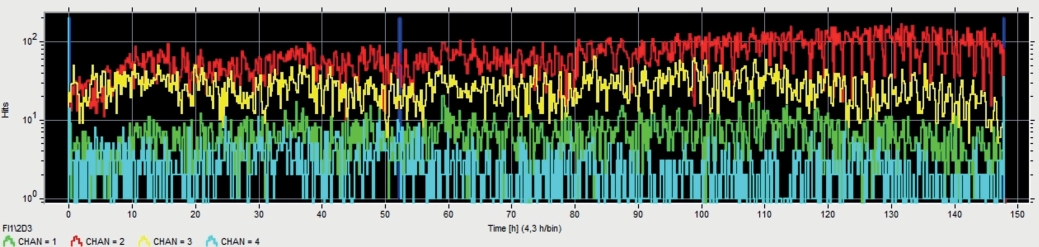
Abb. 4. Verlauf der Impulsrate bei einer 148 Stunden dauernden Messung im Klimaschrank. X-Achse: Zeitskala linear, 0 … 150 Stunden; y-Achse: Impulsrate (hits pro 10 s), Skalierung logarithmisch 0 … 200; Kanäle 1 (grün), 2 (rot) und 3 (gelb) radial seitlich, Kanal 4 (blau) in Faserrichtung.
Unter der Annahme, dass die Ankopplung der Sensoren ungefähr gleich gut war, legt der Vergleich der Kanäle die Schlussfolgerung nahe, dass sich eine oder mehrere Larven in der Nähe dieser Sensoren befanden und bei den übrigen Kanälen aufgrund der Schalldämpfung im Holz geringere Aktivitäten registriert wurden. Aber die Lokalisierung von Schallquellen in einer Freilandprobe ist schwierig.
Die bisherigen Testergebnisse und Erfahrungen aus Versuchen mit Kleinproben, Kanthölzern, Freilandproben (Ankopplung vorzugsweise mit Zwinge, bei rauer Oberfläche oder zu großer Probe indirekt mit Magnethalter) lassen sich wie folgt zusammenfassen:
• | Mit der beschriebenen Sensorkonfiguration kann an Laborproben mit verifiziertem Besatz durch eine Larve aktiver Befall sicher erkannt werden. Störungen durch Umgebungsgeräusche werden durch den gewählten Frequenzgang der Sensoren weitgehend unterdrückt. |
• | An Verdachtsproben, die Befallsmerkmale zeigen, ergeben sich ähnliche Signale, so dass ebenfalls sicher auf aktiven Befall geschlossen werden kann. |
• | Die Reichweite von Signalen kann auf Distanzen (Abstand Larve – Sensor) von bis zu 50 cm abgeschätzt werden. Dies gilt für größere Larven (Masse einige 100 mg) und eine Übertragung in Faserrichtung des Holzes. Bei radialem oder tangentialem Schallweg ist die Reichweite geringer und schwerer abschätzbar. Auch kleinere Larven (z. B. des Splintholzkäfers) sind bei geringeren Reichweiten noch gut nachweisbar. |
• | Signale sind oft erst mehrere Stunden nach dem Anbringen des Sensors messbar, so dass es sich empfiehlt, mindestens 24 Stunden zu messen, um Aktivitäten ausschließen zu können, bevor eine Probe als befallsfrei eingestuft wird. |
• | Die Messung ist zerstörungsfrei, wenn die Proben ebene Flächen aufweisen, an die die Sensoren mit Einhandzwingen angekoppelt werden können. Für eine vollständig zerstörungsfreie Prüfung wie z. B. von Kunstgegenständen ist das von großem Interesse. Anderenfalls hat sich die Ankopplung über eine eingeschraubte Stahlplatte und einen magnetischen Sensorhalter bewährt. |
• | Aus den aufgezeichneten Signalformen sind vermutlich keine Rückschlüsse auf die Spezies möglich, aber wahrscheinlich auf die Größe der Larven. Sehr häufig zeigen sich Larvenaktivitäten nicht als kontinuierliche Folgen von Hits, sondern mit Häufungen, die einige Minuten andauern und nach längerer Pause (bis zu einigen Stunden) wieder beginnen. Dies gilt besonders, wenn der Befall aus einzelnen oder wenigen großen Larven besteht. |
Ein direkter Vergleich mit dem Woodworm Detector (Creemers, 2012), zeitgleich und an denselben Proben, ist noch im Rahmen weiterer Praxistests vorgesehen. Außerdem ist geplant, die Bewertung der aufgezeichneten Hits im Hinblick auf eine Entscheidung, auf welchem Kanal Larvenaktivitäten registriert wurden, zu automatisieren. Der Hersteller des AE-Sensorsystems arbeitet an einer mobilen Version. Damit wäre dann ein Einsatz der Messanlage durch eingewiesenes Personal auch für gutachterliche Untersuchungen, Messungen im Gebäude und Überwachungsbehörden möglich.
Es gibt zwei molekularbiologische Ansätze um einen ALB-Verdacht mittels Polymerase-Kettenreaktion (PCR) zu bestätigen (Abb. 5). Beiden Ansätzen gemeinsam ist, dass eine bestimmte Region der zu untersuchenden DNA amplifiziert wird. Im Fall des ALB verwendet man ein im Mitochondrien-Genom lokalisiertes Gen, welches die Untereinheit 1 der Cytochrom-c-Oxidase (COI) codiert. Beide Ansätze unterscheiden sich aber in der Analyse dieses amplifizierten DNA-Abschnitts und der Spezifität der verwendeten Primer (Folmer et al., 1994; Becker et al., 2020). Im ersten Ansatz, dem „DNA-Barcoding“ wird weniger Wert auf die Spezifität der Primer gelegt, da das PCR-Produkt sequenziert wird und sich die Identität des Organismus somit über seine artspezifische DNA-Sequenz bestimmen lässt (EPPO PM7/129). Der zweite Ansatz, die quantitative real-time PCR (qPCR), verzichtet auf eine Sequenzierung der DNA und interpretiert stattdessen die Anwesenheit des PCR-Produktes als Nachweis des Organismus. Das kann allerdings nur mit Hilfe eines sehr spezifischen Primerpaares und einer Taqman-Sonde funktionieren, die eine Amplifikation von DNA anderer Organismen ausschließen. Dies ist Gegenstand der Entwicklung eines EPPO Diagnose Standards im ANOPLO-diag-Projekt.
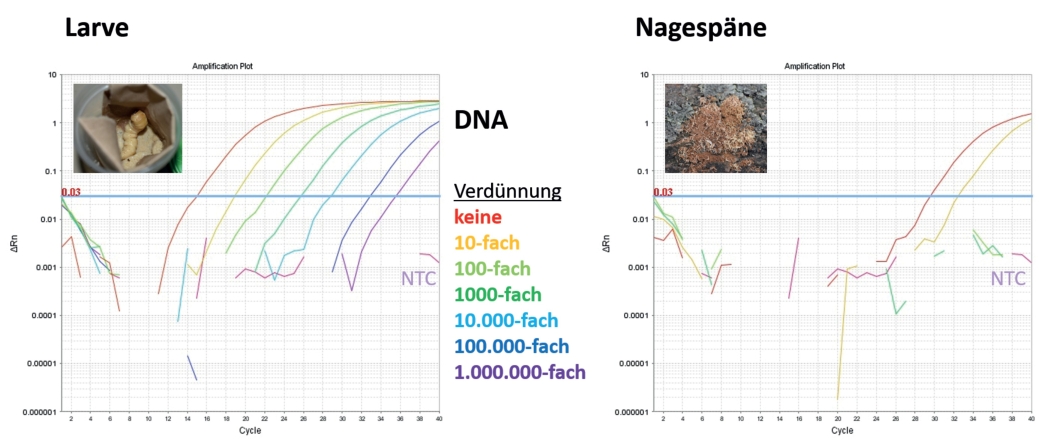
Abb. 5. qPCR-Plot mit ALB-spezifischen Primern und TaqMan-Sonde. Bei den Larven und den Nagespänen handelt es sich um Material, das aus befallenen Bäumen der Magdeburger Quarantänezone gewonnen wurde.
Soll ein Schadorganismus wie der ALB mittels PCR-Produktes eindeutig identifiziert werden, müssen die Primer ohne Fehlpaarungen zur Ziel-DNA Vorlage passen. Gleichzeitig sollten sich die Primerbindestellen anderer Organismen deutlich von denen des Zielorganismus unterscheiden, um falsch positive Ergebnisse zu vermeiden. Darüber hinaus ist es wichtig eine Hybridisierungstemperatur zu wählen, die so hoch ist, dass der Primer nur bei perfekter Komplementarität an die DNA Vorlage bindet. Werden diese Voraussetzungen erfüllt, ist es möglich auch mittels konventioneller PCR und über den simplen Nachweis einer DNA-Bande im Agarosegel einen Schadorganismus zu diagnostizieren. Die quantitative PCR eröffnet allerdings die Möglichkeit, Spezifität und Sensitivität der Diagnose ohne große Mehraufwand zu steigern, so dass die millionenfach verdünnte DNA einer ALB-Larve noch detektiert werden kann (Abb. 5 links). Das Projekt ANOPLO-diag hat sich zum Ziel gesetzt, DNA aus Nagespänen des Insekts zu extrahieren und nachzuweisen, um eine nicht-invasive Diagnostik zu gewährleisten. Unter Verwendung der aus den Nagespänen extrahierten Gesamt-DNA (inklusive Matrix-DNA, d.h. Baum- und potentielle Fremd-DNA) konnte der ALB in zwei Stufen der Verdünnungsreihe (unverdünnt und zehnfach verdünnt) nachgewiesen werden (Abb. 5 rechts).
Das hier vorgestellte, neu entwickelte qPCR-Protokoll ist nicht nur sehr sensitiv und spezifisch, sondern darüber hinaus auch sehr robust. Die in Abb. 5 auf der linken Seite gezeigte Verdünnungsreihe der Larven-DNA wurde nach zweitägiger Lagerung im Kühlschrank erneut untersucht (Abb. 6 links). Von vier technischen Replikaten der millionenfachen Verdünnungsstufe konnten immerhin drei erneut nachgewiesen werden.
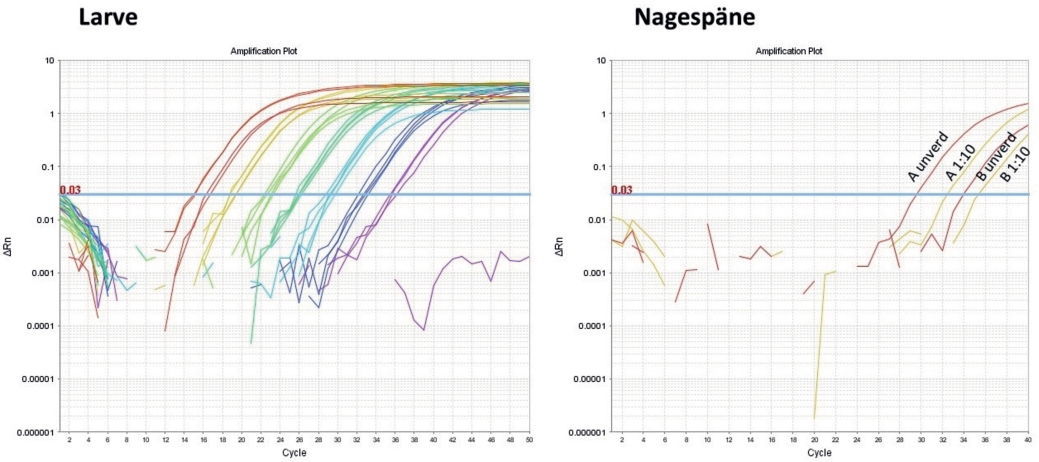
Abb. 6. qPCR-Plot mit ALB-spezifischen Primern und TaqMan-Sonde. Links: Beleg der Reproduzierbarkeit der in Abb. 5 (linke Seite) gezeigten Ergebnisse unter Verwendung der ALB-DNA aus Larvenmaterial. Lediglich eines von vier Replikaten der millionenfachen Verdünnung konnte nicht mehr detektiert werden. Rechts: Nachweis von ALB-DNA aus Nagespänen/Fraß zweier Proben (A und B) in unterschiedlichen Konzentrationen.
Die Qualität der ALB-DNA aus Nagespänen und Fraß schwankt mit dem Alter und dem witterungsbedingten Zersetzungsgrad der Probe. Die Proben A und B in Abb. 6 rechts stammen aus zwei verschiedenen Fraßgängen desselben Ahornbaumes. Eine 10-fache Verdünnung des Probe A enthielt noch immer mehr Ziel-DNA als die unverdünnte Probe B.
Charakteristisch für eine bestimmte Form der qPCR ist die bereits erwähnte Zielorganismus-spezifische TaqMan-Sonde, ein Oligonukleotid, das an einem Ende einen Reporter (ein Donor-Fluorochrom) und am anderen Ende einen Quencher (ein Akzeptor-Fluorochrom) trägt. Die Fluoreszenz des Reporters wird während der PCR gemessen. Sie ist zu Beginn sehr gering, weil der Quencher durch seine räumliche Nähe zum Reporter dessen Fluoreszenz unterdrückt. In jedem Zyklus der PCR nimmt die Fluoreszenz zu, weil die Polymerase den Reporter freisetzt. Da die Fluoreszenz in jedem Zyklus gemessen wird, spricht man auch von Echtzeit (real-time)-PCR. Das Ergebnis einer real-time qPCR ist ein proportional mit dem PCR-Produkt zunehmendes Fluoreszenzsignal. Anders als bei der Sequenzierung von DNA (Barcoding-Ansatz) ist dieses Fluoreszenzsignal kein absolutes (jederzeit überprüfbares) Ergebnis, d.h. um die Zuverlässigkeit der Methode gewährleisten zu können, müssen zusätzlich zu den zu untersuchenden Proben Positiv- und Negativkontrollen analysiert werden.
Falls bei der Etablierung der Diagnose-Parameter für den Zielorganismus (Primersequenz, Hybridisierungstemperatur etc.) keine ausreichende Abgrenzung gegen andere Organismen möglich ist, kann es passieren, dass die qPCR zu falsch positiven Ergebnissen führt, wenn eine Amplifikation von Nicht-Zielorganismus-DNA in späten PCR-Zyklen (bei hohem Ct) erfolgt. In solch einem Fall kann zwar für den Ct-Wert eine Grenze definiert werden (bspw. 35), bis zu der das Ergebnis noch zuverlässig (ausreichend spezifisch) ist, aber dann verringert sich zwangsläufig die Sensitivität. Ein simples Beispiel soll dieses Problem veranschaulichen: Es gilt eine Probe zu diagnostizieren, die aus den Nagespänen von ALB besteht. Eine qPCR mehrerer Replikate der Probe wird durchgeführt und liefert für alle Replikate einen Ct-Wert von 36. Nun ist es anhand dieses Ct-Wertes unklar, ob die ALB-DNA in der Probe gering konzentriert bzw. schon degradiert ist oder es sich um eine falsch positive Amplifikation der DNA eines anderen Insektes handelt.
Unter solchen Umständen kann es hilfreich sein, einen SYBR Green-Ansatz zu verfolgen und anhand von Schmelzkurven zu bestimmen, ob es sich um den Zielorganismus handelt. Es kann sogar von Vorteil sein, die Hybridisierungstemperatur so niedrig zu wählen, dass eine Amplifikation der DNA-Region trotz Fehlpaarungen zwischen Primer und Primerbindestelle des Template ermöglicht und somit die DNA anderer Insekten amplifiziert wird (Abb. 7).
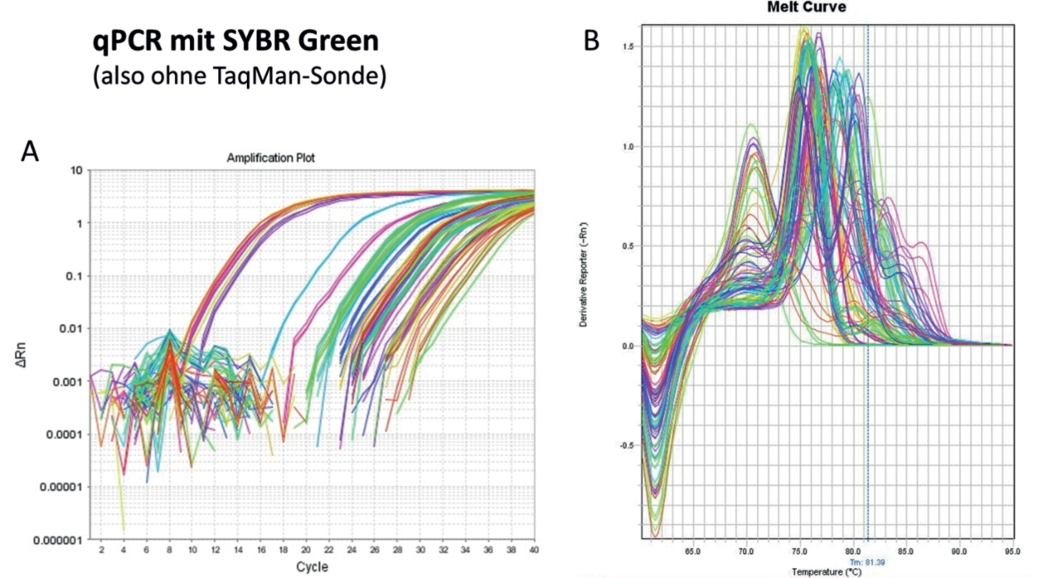
Abb. 7. DNA-Amplifikation von 20 verschiedenen Insektenarten mit demselben Primerpaar durch eine ausreichend geringe Annealing-Temperatur. A) Amplifikation der DNA während der PCR (ganz links in rot: ALB); B) Schmelzkurven-Analyse nach der PCR
In diesem Fall wird keine spezifische TaqMan-Sonde verwendet, sondern ein unspezifisch in alle doppelsträngigen DNA-Moleküle interkalierender Farbstoff (z. B. SYBR Green). Die Schmelzkurve wird anschließend generiert, indem die Temperatur im PCR-Thermocycler langsam und kontinuierlich erhöht wird, bis die doppelsträngige DNA denaturiert wird und den Farbstoff freigibt (Abb. 7B). Der Schmelzpunkt (Tm), der Peak der Kurve, ist abhängig von der Länge und Basenpaarzusammensetzung des PCR-Fragments. Unter Verwendung eines definierten Primerpaars kann der Schmelzpunkt für verschiedene Organismen bestimmt werden (Referenzwerte). Eigene Analysen haben gezeigt, dass der ALB-spezifische Tm für ein ausgewähltes Primerpaar sehr robust und in Larvenmaterial und Nagespänen (aus verschiedenen Baumarten) identisch ist (Manuskript in Vorbereitung). Bei der späteren Analyse einer zu diagnostizierenden DNA-Probe kann auf diesen zuvor bestimmten Referenzwert zurückgegriffen werden (Abb. 8).
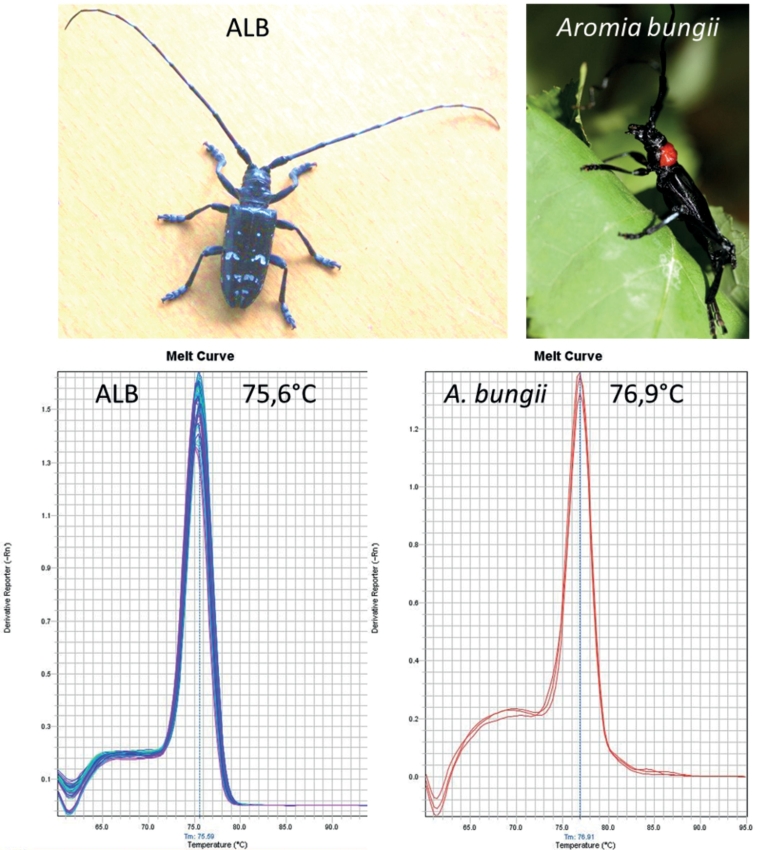
Abb. 8. Definierte Schmelzpunkte von ALB- und Aromia bungii–DNA-Fragmenten aus Larven-Material unter Einsatz des neu designten Primerpaares. Beide Arten sind Quarantäneschadorganismen in Deutschland.
Die beiden qPCR-Verfahren haben individuelle Vorteile. Wird der TaqMan-Ansatz verwendet um ALB nachzuweisen, kann eine ALB-Probe in der Regel eindeutig und hochsensitiv nachgewiesen werden (Abb. 5 und 6). Unterbleibt das Fluoreszenzsignal, gibt es zwei verschiedene Ursachen: Es könnte sich entweder um einen anderen Organismus oder um stark degradierte ALB-DNA handeln. Im ersteren Fall könnte Entwarnung gegeben werden, natürlich nur solange es sich nicht um einen anderen Quarantäneschadorganismus handelt, im letzteren Fall jedoch nicht. Nur die Diagnose des tatsächlichen Organismus würde Gewissheit verschaffen. Leider kommen in einigen Teilen Europas bis zu 20 verschiedene Insektenarten als Verursacher ALB-ähnlicher Symptome an Bäumen in Frage. Eine Überprüfung der Probe auf alle 20 Kandidaten mittels 20 verschiedener Taxon-spezifischer Primerpaare wäre teuer und aufwendig. Hier könnte der SYBR Green-Ansatz und die Kenntnis der verschiedenen Schmelztemperaturen für diese 20 Insektenarten Abhilfe schaffen (Abb. 7B). Der dadurch bestimmte wahrscheinlichste Kandidat könnte dann in einer weiteren qPCR mit einer spezifischen TaqMan-Sonde verifiziert werden (Abb. 9).
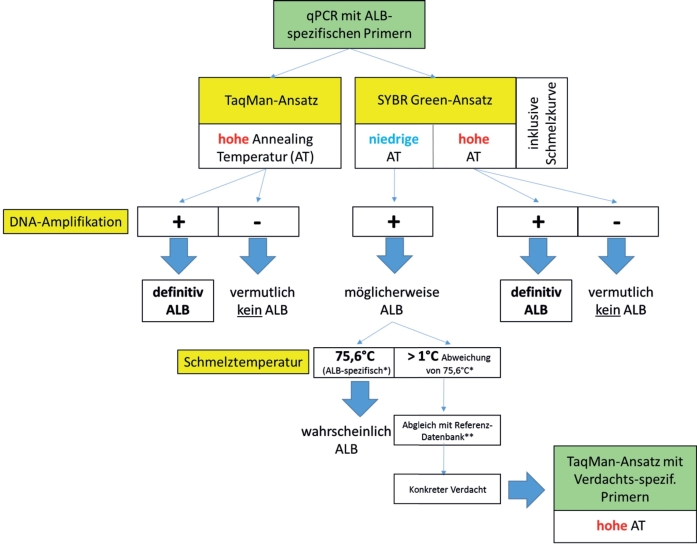
Abb. 9. Schema zum Output verschiedener qPCR-Ansätze zur eindeutigen Diagnose von ALB und anderer holzbewohnender Insektenarten. *experimentell ermittelte Schmelztemperatur für ALB-DNA unter Verwendung des neu designten Primerpaares; **experimentell ermittelte Schmelztemperaturen für andere holzbewohnende Insekten.
Sowohl das auf akustischen Messungen als auch das auf der Identifizierung von ALB spezifischen DNA-Abschnitten beruhende Nachweisverfahren, bieten die Möglichkeit einer zerstörungsfreien und zügigen Analyse. Je nach zu untersuchendem Objekt bietet sich entweder die akustische oder die molekularbiologische Methode, aber auch eine kombinierte Analyse aus beiden Methoden an (Tab. 1).
Tab. 1. Anwendungsgebiete und Aussagen der in ANOPLO-diag und InsectDetect entwickelten Methoden zur Überprüfung eines ALB-Verdachts
| molekularbiologisch | physikalisch |
Unterschiede | ||
Methode | DNA-Analyse | Akustische Messung (Körperschall) |
Primäres Anwendungsgebiet | Lebende Bäume | Verpackungs- und Nutzholz, Freilandproben |
Weiteres Anwendungsgebiet | Nagespäne oder befallene Holzpartien toter Bäume | lebende Bäume |
Unbedingte Voraussetzung | Nagespäne/Fraß | Hinweis auf befallene Stelle |
Diagnose der Insektenart | JA | NEIN |
Bestimmung aktiven Befalls | Vitalität des Insekts kann nicht beurteilt werden | JA (bei Fraßaktivität) |
Jahreszeiten | unabhängig | Fraßaktivität erforderlich |
Möglicher Nachweis nach Zeitpunkt | Monate bis Jahre | Nur aktuell |
Gemeinsamkeiten | ||
Nachweisgrenze | einzelnes Insekt | |
Eingriff in das Testobjekt | nicht-invasiv | |
Dauer bis zur Diagnose | wenige Stunden | |
Die akustische Messung hat den Vorteil eine Aussage zur Vitalität des Insektes in der untersuchten Holzmatrix treffen zu können; dies ist mittels DNA-Analyse unmöglich. Die spezifische Bestimmung der Insektenart ist wiederum mittels akustischer Messungen, gemessen an dem aktuell noch geringen Kenntnisstand von den temporären Fressmustern der Insektenlarven, ausgeschlossen. Werden jedoch die Vorteile beider Methoden miteinander kombiniert, ist es möglich einen aktuellen Befall mit lebenden Larven zu verifizieren und die Spezies eindeutig zu bestimmen.
Beide hier vorgestellten Drittmittelprojekte werden durch die Fachagentur für Nachwachsende Rohstoffe (FNR) im Rahmen des Waldklimafonds gefördert: Das Projekt „InsectDetect – Detektion aktiver Schadinsekten im Holzhandel“ (http://www.wki.fraunhofer.de/InsectDetect) unter dem Förderkennzeichen 22WK412101 und das Projekt „ANOPLO-diag – Diagnose von holzbewohnenden Quarantäneschadorganismen am Beispiel des Asiatischen Laubholz-bockkäfers (Anoplophora glabripennis) anhand von Fraß- und Nagerückständen“ unter dem Förderkennzeichen 22010316.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Becker, M., B. Berger, A. Taddei, B. Hoppe, S. König, 2020: Eine neue Methode zum nicht-invasiven Nachweis des Asiatischen Laubholzbockkäfers (ALB): ANOPLO-diag. In: Dujesiefken, D. (Hrsg.): Jahrbuch der Baumpflege 24: 63-70.
Creemers, J.G.M, 2012: Holzwurm aktiv... oder nicht? In: Holz-Zentralblatt 39, 993.
Creemers, J.G.M, 2015: Use of Acoustic Emission (AE) to Detect Activity of Common European Dry-Woodboring Insects: Practical Considerations. In: International Symposium Non-Destructive Testing in Civil Engineering (NDT-CE), S. 573-580. Berlin.
EFSA (European Food Safety Authority), B. Hoppe, G. Schrader, M. Kinkar, S. Vos, 2019: Pest survey card on Anoplophora glabripennis. EFSA Supporting Publications, 16 (12).
EPPO, 2016: PM 7/129 (1) DNA barcoding as an identification tool for a number of regulated pests. EPPO Bulletin, 46 (3), 501-537.
Folmer, O., M. Black, W. Hoeh, R. Lutz, R. Vrijenhoek, 1994: DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates. Molecular Marine Biology and Biotechnology 3 (5), 294-299.
Hölling, D, 2015: Der Asiatische Laubholzbockkäfer in Europa. CH-Birmersdorf: Eidg. Forschungsanstalt WSL. abgerufen am 26.06.20, URL: http://www.waldwissen.net/waldwirtschaft/schaden/invasive/wsl_alb_europa/index_DE.
Hoppe, B., A. Wilstermann, M. Becker, E. Fornefeld, G. Schrader, T. Schröder, 2020: Quarantäneschadorganismen in Gehölzen – was hat sich verändert, was kommt auf uns zu? In: Dujesiefken, D. (Hrsg.): Jahrbuch der Baumpflege 24: 34-45.
Lemme, H., 2015: Praxishilfe Asiatischer Laubholzbockkäfer. Bayerische Landesanstalt für Wald und Forstwirtschaft (LWF). Freising.
Lemme, H., 2017: Situation des Asiatischen Laubholzbockkäfers in Bayern. AFZ - Der Wald 12, 46-47.
Krajewski, A., P. Bilski, P. Witomski, P. Bobiński, J. Guz, 2020: The progress in the research of AE detection method of old house borer larvae (Hylotrupes bajulus L.) in wooden structures. Construction and Building Materials 256, 119387, DOI: 10.1016/j.conbuildmat.2020.119387.
Nowakowska, M., A. Krajewski, P. Witomski, P. Bobiński, 2017: Thermic limitation of AE detection method of old house borer larvae (Hylotrupes bajulus L.) in wooden structures. Construction and Building Materials 136, 446-449, DOI: 10.1016/j.conbuildmat.2017.01.012.
Pallaske, M., 1984: Aktivität, Orientierung und Fraßverhalten der Larven des Hausbockkäfers Hylotrupes bajulus L. im Holz. Dissertation. Ulm: Universität Ulm, Abteilung für Ökologie und Morphologie der Tiere.
Plinke, B., 1998: Zur akustischen Erkennung holzzerstörender Insekten. In: P. Böttcher and L. Mehlhorn: Fachwerkforschung: Beiträge zur Erhaltung, S. 22-29. Stuttgart: Fraunhofer IRB Verlag.
Schröder, T., 2015: Asiatischer Laubholzbockkäfer Anoplophora glabripennis Motschulsky. Informationsblatt des JKI. Braunschweig: Julius-Kühn-Institut.
Vallen, H., 2003: Die Schallemissionsprüfung. Informationsschriften zur zerstörungsfreien Prüfung, Band 6. Wuppertal: Castell-Verlag, 2003.
Wu, Y., N.F. Trepanowski, J.J. Molongoski, P.F. Reagel, S.W. Lingafelter, H. Nadel, S.W. Myers, A.M. Ray, 2017: Identification of wood-boring beetles (Cerambycidae and Buprestidae) intercepted in trade-associated solid wood packaging material using DNA barcoding and morphology. Scientific Reports 7, 40316, DOI: 10.1038/srep40316.
Prinzip der Schallemissionsanalyse (AE). Wichtige Parameter von AE-Signalen sind Amplitude, Impulsrate, Frequenzspektrum und Korrelationen zwischen diesen Parametern und weiteren Randbedingungen, z. B. einer mechanischen Last bei der zerstörenden Prüfung oder auch der Materialtemperatur.
AE-Signale können durch die in Abb. S1 angegebenen Parameter charakterisiert werden: Das Signal, d.h. die vom Sensor gelieferte Spannung, wird registriert, sobald eine bestimmte Amplitude („threshold“) überschritten wird. Ab diesem Zeitpunkt wird der Spannungsverlauf des „Hits“ durch einen Transientenrecorder aufgezeichnet, bis es die Schwelle wieder unterschreitet („end of hit“).
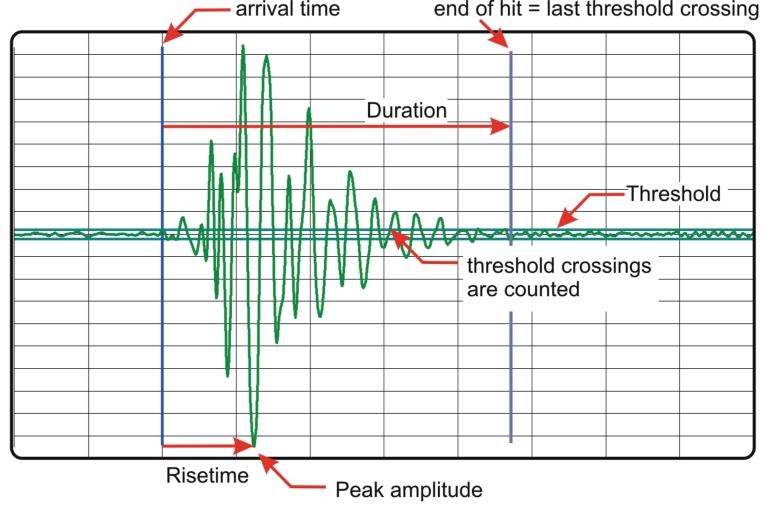
Abb. S1. Schema und charakterisierende Merkmale eines Impulsverlaufes (Grafik: Vallen Instruments).
Das Frequenzspektrum innerhalb des Messintervalls war bei unseren Tests unabhängig von der Signalquelle immer sehr ähnlich. Für die spätere Auswertung haben sich deshalb vorerst die Merkmale „peak amplitude“ (Maximum des Signals) und „counts“ (Anzahl der Schwellwertüberschreitungen im jeweiligen Messintervall) als ausreichend und sinnvoll erwiesen.
Sind die Materialeigenschaften wie z. B. die richtungsabhängige Schallgeschwindigkeit gut bekannt, so können mit mehreren Sensoren aufgrund der Laufzeitdifferenzen auch Fehlstellen geortet werden. Damit sind vielfältige Materialanalysen möglich.
Das Ergebnis einer AE-Messung über einen längeren Zeitraum (Minuten bis Tage) sind zunächst nur die hier dargestellten Merkmale der registrierten Hits in Form eines Datensatzes je Hit, der zusammen mit einem Zeitstempel in einer SQL-Datenbank gespeichert ist. Mit heute verfügbarer Messtechnik werden ausreichende Datenraten erzielt, um nicht nur die Impulsrate, sondern auch den Verlauf transienter Signale aufzuzeichnen, Frequenzspektren zu bestimmen und Laufzeitdifferenzen zu messen. Eine bekannte Einschränkung bei Holzpartikelwerkstoffen und Massivholz ist aber, dass die Schallausbreitung je nach Zusammensetzung mit unterschiedlicher Dämpfung und meistens anisotrop, d. h. mit richtungsabhängigen Geschwindigkeiten verläuft, so dass auch die Geometrie und Beschaffenheit der Probe bei der Datenauswertung zu berücksichtigen ist und möglichst viele Messkanäle vorhanden sein sollten. Eine Ortung von Schallquellen in Holz ist daher nur unter günstigen Bedingungen möglich, z. B. in homogenem Massivholz mit bekannter Geometrie bei Schallausbreitung in Faserrichtung. Die AE-Messtechnik kann aber gut zur Materialprüfung an Holz und Holzwerkstoffen eingesetzt werden und eignet sich auch grundsätzlich dazu, Bauteile unter Last oder Trocknungsprozesse zu überwachen. Die Impulsrate steigt bei mechanischer Belastung bzw. Feuchteänderungen lange vor erkennbarer Rissbildung deutlich an.
Beschreibung der Messanlage.
Für unsere Messungen wurde eine vierkanalige Messanlage für Schallemissionssignale des Typs AMSY-6 (Vallen Instruments, Icking) eingesetzt (Abb. S2). Sie besteht aus
• | vier Sensoren Typ VS45H (zylindrisches Gehäuse, Länge und Durchmesser jeweils ca. 22 mm, nutzbarer Frequenzbereich > 20 kHz, volle Empfindlichkeit ab ca. 95 KHz), jeweils mit Vorverstärker Typ AEP5 |
• | einem Tischgehäuse mit zwei Einschüben für Signalaufbereitung und Transientenrecordern für je zwei Sensoren und Anschluss an einen Laptop unter Windows mit USB3-Schnittstelle sowie |
• | einem Softwarepaket u. a. mit dem Modul VisualAE zur Datenaufnahme und interaktiven grafischen Auswertung |
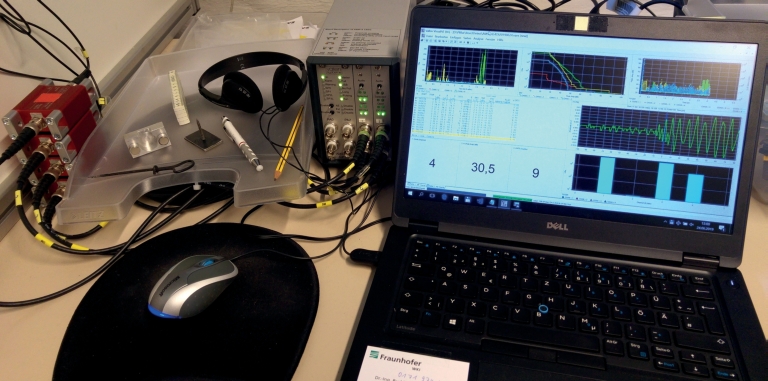
Abb. S2. Messanlage. Von links nach rechts: Vorverstärker mit Kabelverbindungen zu den Sensoren (nicht im Bild); Magnethalter, Bleistift für Hsu-Nielsen-Test, Kopfhörer; Gehäuse für Signalverarbeitung; Laptop mit Auswertesoftware.
Mit der Software werden die Daten als Hits mit Merkmalsvektor und Zeitstempel in einer SQL-Datenbank aufgezeichnet und können schon während der Messung grafisch aufbereitet und gefiltert werden. Die Bewertung – z. B. ob Larvenaktivitäten registriert wurden – muss aber vom Benutzer vorgenommen werden. Zwischen den Vorverstärkern in der Nähe der Sensoren einerseits und der übrigen Hardware (Tischgehäuse, Laptop, Stromversorgung) andererseits kann eine lange Kabelverbindung von mindestens 5 m liegen. Damit sind Messungen auch unter Quarantänebedingungen (in Insektenkäfigen mit wiederverschließbaren und passgenauen Aussparungen für die Kabel) möglich, indem Proben, Sensoren und Vorverstärker innerhalb und das übrige Equipment außerhalb der Kammer platziert werden.
Die Sensoren sind robuste Stahlzylinder mit einer Keramikplatte an der empfindlichen Stirnfläche. Es hat sich erwiesen, dass sie in den meisten Fällen mit handelsüblichen verstellbaren Einhandzwingen passender Größe (Abb. S3 links) an eine ebene Fläche auf der Probe angeklemmt werden können. Bei Freilandproben (z. B. Stammabschnitte mit Rinde) ist eine indirekte Kopplung mit einem selbst entwickelten Magnethalter (Abb. S3 rechts) eine mögliche Alternative: Mit einer Stahlplatte ist eine Holzschraube verschweißt, die nach einer Vorbohrung ins Material eingeschraubt werden kann. Der Sensor wird mit der Stirnfläche über ein magnetisches Joch an die Platte angekoppelt. Die Schallleitung verläuft vom Material über die Schraube, die Stahlplatte und die Stirnfläche des Sensors, allerdings erfahrungsgemäß mit einem Verlust von ca. 30 dB. Beide Methoden der Kopplung bleiben auch bei einer mehrtägigen Messung kraftschlüssig. Aufgrund dieser Erfahrungen kann auch auf ein Koppelmedium (z. B. Vaseline) verzichtet werden.
Um eine Messkette zur Erfassung von AE-Signalen zu prüfen, wird üblicherweise ein Hsu-Nielsen-Test eingesetzt: Eine Bleistiftmine wird auf die Probenoberfläche aufgesetzt und durch Kippen des Stiftes zerbrochen. Das beim Bruch der Mine entstehende Signal ähnelt physikalisch dem Riss einer Holzfaser bzw. dem Biss einer Larve, es hat aber eine ca. 30 dB höhere Amplitude und kann gut von Nutz- und Störsignalen unterschieden sowie dem jeweiligen Messkanal zugeordnet werden. Der HNS-Test sollte zu Beginn und vor Abschluss einer jeden Messung ausgeführt werden, um sicherzustellen, dass der Sensor richtig angebracht war.
Die Sensoren wurden gezielt im Hinblick auf eine gute Trennung von Nutz- und Störsignalen ausgewählt. Ihr Frequenzgang umfasst einen Bereich von ca. 50 kHz bis ca. 300 kHz. Für den Menschen hörbare Frequenzen liegen unterhalb von 20 kHz, ebenso störender Luftschall wie z. B. Sprache, Klopfen oder Türenschlagen. Körperschall, der von fressenden Larven herrührt, wird vom menschlichen Ohr als feines Knistern oder Knacken wahrgenommen. Dabei handelt es sich um Impulse mit einem großen Anteil höherer Frequenzen, die von den eingesetzten Sensoren im Gegensatz zu niederfrequenten Störsignalen noch gut erfasst werden. Daher liefert die hier eingesetzte Sensorik ohne nachträgliche Signalverarbeitung und -filterung praktisch nur für Larvenaktivitäten typische Nutzsignale und unterscheidet sich von anderen Ansätzen zur akustischen Detektion von Larvenaktivitäten, z. B. (Krajewski et al., 2020).
Datenauswertung. Grundlage der Datenauswertungen sind jeweils die Merkmale der detektierten Hits. Bei dieser Anwendung der AE-Messtechnik ist es sinnvoll, je Hit die Amplitude und den Zeitpunkt zu registrieren. In einer Live-Darstellung der Hits (Abb. S4) als Amplitude über einer kontinuierlichen Zeitskala können die Messwerte direkt beobachtet werden.
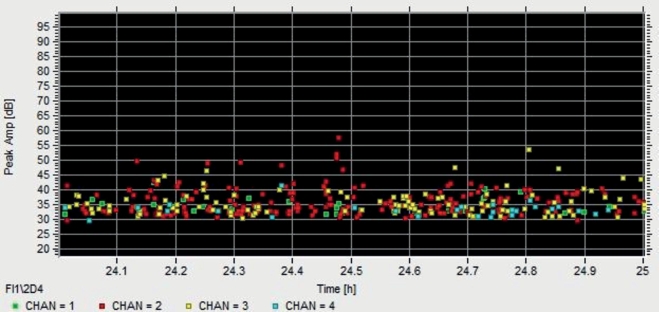
Abb. S4. Live-Darstellung der Hits während einer Messung an einer Freilandprobe. Probe und Zuordnung der Sensoren wie in Abb. 3; Zeitintervall eine Stunde, 24 h nach Beginn der Messung.
Abbildung S5 zeigt eine mit VisualAE erstellte Aufbereitung der Messung für die vier Messkanäle: Darin sind nur noch die Hits mit einer Mindestzahl von (in diesem Beispiel) fünf Schwellwertdurchgängen (Counts) berücksichtigt und zusätzlich dargestellt als Verlauf der Impulsrate über der Achse der Messdauer und als Balkendiagramm zum Vergleich der Aktivitäten mehrerer Kanäle über die gesamte Messdauer.
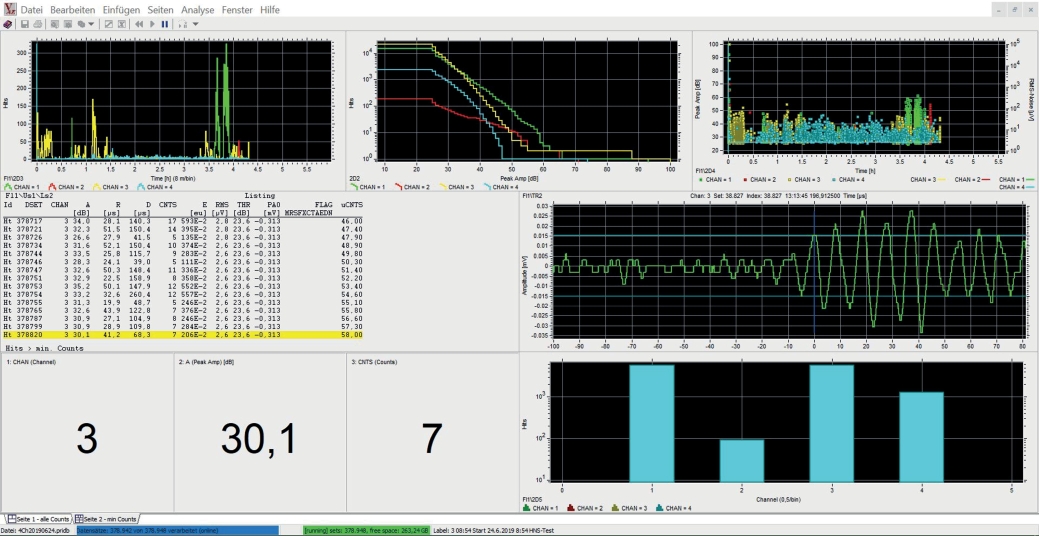
Abb. S5. Aufbereitetes Messergebnis für die drei Proben aus Abb. 4 (vgl. farbliche Zuordnung). Oben links: Impulsrate (Hits pro 10 s, linear)/Messdauer; oben Mitte: Anzahl der Hits (log.)/Peak-Amplitude; oben rechts: Peak-Amplitude (in dB)/Messdauer; Mitte links: Listing der Merkmale aller Hits mit mind. fünf Counts; Mitte rechts: Signalverlauf des letzten Hits; unten links: Kanalnummer, Peak-Amplitude, Anzahl der Counts des letzten Hits; unten rechts: Gesamtzahlen (logarithmisch) der registrierten Hits im Vergleich aller Kanäle.
Da praktisch nur für Larvenaktivitäten typische Hits registriert werden, ist ihre Anzahl das wichtigste Bewertungskriterium, um die Aktivität der Probe zu beurteilen: Eine Impulsrate, die über die Messzeit dauerhaft oder auch zeitweise über einem Hit pro 10 sec liegt, deutet bereits auf Aktivität hin. Allerdings sind Larven nicht ständig aktiv – wenn Aktivität ausgeschlossen werden soll, sollte die Messzeit möglichst 24 h betragen.