

Erhaltungskonzept der Wildartensammlungen der Obstgenbank Dresden-Pillnitz – Aktivsammlung, Kryokonservierung, Global Seed Vault
Conservation strategy of the wild species collections of the Fruit Gene Bank in Dresden-Pillnitz – Active Collection, Cryopreservation, Global Seed Vault
Journal für Kulturpflanzen, 72 (9). S. 466–472, 2020, ISSN 1867-0911, DOI: 10.5073/JfK.2020.09.02, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Die Erhaltung obstgenetischer Ressourcen ist eine wichtige Voraussetzung für die langfristige Sicherung des Obstbaus. Das Nationale Fachprogramm zur Erhaltung und nachhaltigen Nutzung pflanzengenetischer Ressourcen landwirtschaftlicher und gartenbaulicher Kulturpflanzen in Deutschland ist die Arbeitsgrundlage aller Aktivitäten zur Erhaltung obstgenetischer Ressourcen. Die Obstgenbank in Dresden-Pillnitz hat sich seit ihrer Übernahme durch das Julius Kühn-Institut (JKI), Institut für Züchtungsforschung an Obst, am 01. Januar 2003 zu einem Partner für Wissenschaft und Praxis auf nationaler und internationaler Ebene entwickelt. Sie besitzt neben den Sortensammlungen von allen in Mitteleuropa heimischen Obstarten umfangreiche Wildartensammlungen, die bei Malus und Fragaria die größten öffentlich zugänglichen Sammlungen ihrer Art in Europa darstellen. Die Erhaltungsstrategien in der Obstgenbank sind vielfältig und umfassen bei den Wildarten neben der klassischen Aktivsammlung auch die Kryokonservierung und die Einlagerung von Samen im Svalbard Global Seed Vault im Permafrost in Norwegen. Ziel ist es, durch die Kombination von verschiedenen Erhaltungsmethoden die genetischen Ressourcen bei Obst nachhaltig und effektiv zu sichern.
Stichwörter: Genbank, Global Seed Vault, Kryokonservierung, obstgenetische Ressourcen
The preservation of fruit genetic resources is the basis for ensuring a sustainable fruit production. All activities of long-term preservation, utilization, research and development of fruit genetic resources are based on the German National Program for Genetic Resources of Agricultural and Horticultural Plants. The Fruit Gene Bank at the Julius Kühn-Institute (JKI), Institute for Breeding Research on Fruit Crops has been established as a partner for science and practice at the national and international level since its integration into JKI at January 1st, 2003. In addition to the cultivar collections for all fruit species native to Central Europe, it also has comprehensive wild species collections, which are the largest public collections of their type in Europe for the genera Malus and Fragaria. The conservation strategies in the fruit gene bank, especially under the special aspect of wild species, will be summarized in this paper and the combination of different conservation methods will be highlighted as a potential to secure the genetic resources of fruits sustainably and effectively.
Key words: Cryopreservation, fruit genetic resources, genebank, Global Seed Vault
Die systematische Obstzüchtung auf Basis wissenschaftlicher Erkenntnisse begann in Deutschland vor etwa 100 Jahren und ist eng mit den Namen Otto Schindler in Pillnitz und Erwin Baur in Müncheberg verbunden (Schmidt, 1948; Murawski, 1968). Da eine erfolgreiche Züchtung auch eine umfangreiche Sortimentsarbeit voraussetzt, wurde zur gleichen Zeit mit dem Aufbau von Sammlungen von Sorten sowie Wildartenmustern begonnen. Eine der ersten Sammlungen dieser Art entstand im Erwin-Baur-Institut in Müncheberg. Die großen Bestände des Müncheberger Institutes wurden stetig durch wertvolle Formen aus dem Ausland und die Teilnahme an Sammelreisen erweitert (Kuckuck und Schmidt, 1948). Sie waren die Grundlage für umfangreiche morphologisch-systematische und genetische Untersuchungen an Arten und Artbastarden der Gattung Malus (Henning, 1947 postum). Im Jahre 1921 begann mit der Gründung der Außenstelle der Biologischen Reichsanstalt für Land- und Forstwirtschaft in Naumburg der Aufbau eines Arboretums. In diesem konnten gezielte Artbastardierungen bei Malus und nachfolgend morphologische Beschreibungen der einzelnen Formen realisiert werden (Seelinger, 1934; Gollmick, 1958; Mildenberger, 1963).
Ab 1971 kam es in der ehemaligen Deutschen Demokratischen Republik zur Zusammenlegung aller Aktivitäten im Bereich der Obstzüchtung in Pillnitz. In der Folge wurden die Müncheberger und Naumburger Sammlungen als integrierte Bestandteile der Obstzüchtung betrachtet und als Ausgangsmaterial für die Sammlungen der heutigen Obstgenbank an den Standort Dresden-Pillnitz transferiert. In der Abteilung Obstzüchtung wurden die Arbeiten zur Beschreibung des Materials fortgesetzt und ausgewählte Genbankakzessionen zielgerichtet im Zuchtprozess eingesetzt (Fischer & Büttner, 1986).
1991 wurde auf der Basis des Einigungsvertrages (Vertrag zwischen der Bundesrepublik Deutschland und der Deutschen Demokratischen Republik über die Herstellung der Einheit Deutschlands) zunächst die Arbeitsgruppe ‚Genbank Obst‘ des ehemaligen Institutes für Obstforschung Dresden-Pillnitz – als eine Außenstelle (‚Genbank Süd‘) der Arbeitsgruppe ‚Genbank‘ des damaligen Instituts für Pflanzengenetik und Kulturpflanzenforschung (IPK) – etabliert. Die Pillnitzer Sammlungen wurden durch Manfred Fischer und Mitarbeiter in den folgenden Jahren kontinuierlich erweitert und die Charakterisierungsarbeiten fortgesetzt (Büttner et al., 2000; Fischer & Fischer, 1999; Geibel, 2002; Luby et al., 2001).
Auf Empfehlung des Wissenschaftsrates und auf gemeinsamen Beschluss der damaligen Bundesministerien für Wissenschaft und Technologie sowie Verbraucherschutz, Ernährung und Landwirtschaft vereinbarten das IPK und die damalige Bundesforschungsanstalt für Züchtungsforschung an Kulturpflanzen (BAZ) im Jahr 2001 eine institutionelle Aufgabenteilung bei der Erhaltung genetischer Ressourcen in Deutschland. Das IPK konzentriert sich seither auf die Ex-situ-Erhaltung, während die BAZ die Verantwortung für die Bereiche In-situ- und On-farm-Erhaltung übernahm. In der Folge wurden im Jahr 2003 die beiden großen Ex-situ-Sammlungen des IPK und der Forschungsanstalt für Landwirtschaft (FAL) in Braunschweig am Standort Gatersleben zusammengeführt. Das IPK wurde damit Sitz der Bundeszentralen Ex-situ-Genbank landwirtschaftlicher und gärtnerischer Kulturpflanzen (Müntz & Wobus, 2012). Die umfangreichen genetischen Ressourcen der Obstgenbank wurden in diesem Zusammenhang zum 1. Januar 2003 an das Züchtungsinstitut der BAZ in Dresden-Pillnitz überführt, welches heute als Institut für Züchtungsforschung an Obst zum Julius Kühn-Institut (JKI) gehört.
Zum gegenwärtigen Zeitpunkt werden in der Obstgenbank Dresden-Pillnitz 2.387 Sorten bzw. Wildarten-Akzessionen in permanenten Feldsammlungen als Aktivsammlung erhalten (Abb. 1). Diese Art der Ex-situ-Erhaltung ist bei obstgenetischen Ressourcen aufgrund des hohen Maßes an Heterozygotie notwendig, um die Integrität der Sorten bzw. Akzessionen zu erhalten. Obwohl die Erhaltung aufgrund der vegetativen Vermehrung sehr arbeitsaufwendig ist, bieten Aktivsammlungen viele Vorteile. Sie stellen u. a. ständig verfügbares Ausgangsmaterial für die Charakterisierung und Evaluierung, die Obstzüchtung und den Materialaustausch zur Verfügung. Die in Aktivsammlungen erhaltenen genetischen Ressourcen sind allerdings ständig dem Risiko des Verlustes durch Pflanzenkrankheiten (biotische Schaderreger) und negative Umwelteinflüsse (abiotische Schadfaktoren) ausgesetzt.
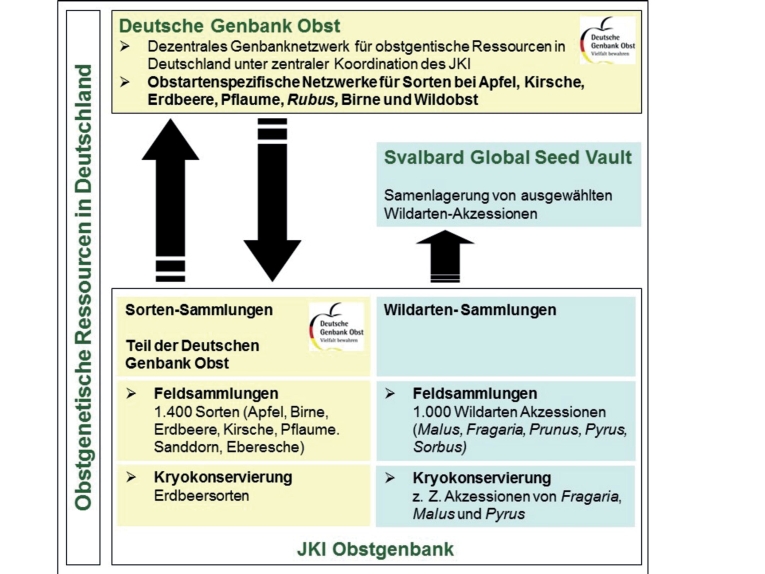
Abb. 1. Erhaltung obstgenetischer Ressourcen in Deutschland – Konzept unter Nutzung von Ex-situ-Erhaltung (Aktivsammlungen im Feldbereich der Obstgenbank Dresden-Pillnitz und Sammlungen der Partner der Deutschen Genbank Obst), der Kryokonservierung und der Einlagerung von Samenproben im Svalbard Global Seed Vault. Wildarten – hellblau; Sorten – gelb.
Um solchen Verlusten vorzubeugen, ist der Aufbau von Duplikatsammlungen für Feldsammlungen obligatorisch (Engels & Visser, 2003). Dabei befindet sich das Duplikat zu Sicherungszwecken an einem anderen Standort und kann dabei entweder in einer anderen Feldsammlung, als In-vitro-Kultur oder in der Kryolagerung erhalten werden.
Für die Sortensammlungen der Obstgenbank wurde mit der Gründung der Deutschen Genbank Obst (DGO) im Jahr 2009 die Möglichkeit geschaffen, in einem nationalen dezentralen Genbanknetzwerk in einer neuen innovativen Weise die Erhaltungsarbeit in Deutschland zu koordinieren (Höfer et al., 2019; https://www.deutsche-genbank-obst.de/). Die DGO bietet darüber hinaus die Möglichkeit, Sammlungen an mehreren Standorten in Deutschland zu duplizieren. Die zentrale Koordinierung der DGO wurde vom Bundesministerium für Landwirtschaft und Ernährung dem Institut für Züchtungsforschung an Obst übertragen. Die DGO verfolgt das Ziel, die Erhaltung gemeinsam ausgewählter Sorten (Sorten mit DGO-Mandat) an mindestens zwei Standorten in Deutschland langfristig zu realisieren.
Neben den Obstsortensammlungen von allen in Mitteleuropa heimischen Obstarten (z. Z. ca. 1.400 Sorten), besitzt die Obstgenbank mehr als 1.000 verschiedene Wildarten-Akzessionen von vier Gattungen Malus (Apfel), Fragaria (Erdbeere), Pyrus (Birne) und Prunus (in der Hauptsache Kirsche) sowie einzelne Arten anderer Gattungen (z. B. Sorbus (Eberesche) u. a.).
Sowohl die Malus-Sammlung als auch die Fragaria-Sammlung stellen die größten öffentlichen Sammlungen ihrer Art in Europa dar. Gegenwärtig umfasst die permanente Malus-Sammlung 516 Akzessionen von 26 Primärarten sowie von 21 Arthybriden der Gattung. Damit sind alle Sektionen und Serien dieser Gattung vertreten (Forsline et al., 2003). 215 Malus-Akzessionen aus der oben beschriebenen Naumburger Sammlung befinden sich noch heute in der Sammlung der Obstgenbank. Ihr Anteil entspricht dabei fast 50 % der ehemaligen Sammlung (Büttner, 1994). Der Bestand des Malus-Sortimentes wurde durch Akzessionen aus dem Nikolai I. Vavilov Forschungsinstitutes für Pflanzenbau St. Petersburg (Russland) und dem USDA-ARS Plant Genetic Resources Unit, der Cornell Universität in Geneva (USA) schrittweise ergänzt. Gegenwärtig befinden sich zusätzlich ca. 2.100 Sämlinge von Sammelexpeditionen nach China und in den Kaukasus (Russland, Georgien, Aserbaidschan) in den Evaluierungsquartieren. Ziel ist es, Kernsammlungen (‚Core-collectionen‘) für die einzelnen Arten zu erarbeiten, die bei begrenztem Materialumfang die genetische Diversität der kompletten Sammlung einer Art repräsentieren.
Die Fragaria-Sammlung umfasst 297 Akzessionen von 24 verschiedenen Arten und Arthybriden. Sie ist in drei Hauptkomplexe gegliedert: (I) die in Europa heimischen Arten F. vesca L., F. moschata Weston und F. viridis Weston, (II) den großen Komplex der asiatischen Arten sowie (III) die amerikanischen Arten F. chiloensis (L.) Miller und F. virginiana Miller, welche die beiden Ursprungsarten der Kulturerdbeere Fragaria × ananassa Duch. sind. Damit beinhaltet die Genbank Akzessionen von allen bei Fragaria existierenden Fertilitätsgruppen. Die Fragaria-Sammlung wurde seit 2002 durch die Übernahme von Material aus der Privatsammlung von Günter Staudt, Freiburg (u. a. Staudt, 2005, 2006; Staudt et al., 2009) und Abgaben durch Brigitte Wachsmuth, Bielefeld (Wachsmuth, 2010) beträchtlich erweitert.
Demgegenüber stellen die Pyrus-, Prunus sowie Sorbus-Sammlungen kleinere Sammlungen dar. Bei der Pyrus-Sammlung kommen 37 der 64 Wildarten-Akzessionen (68 % der Pyrus-Akzessionen) ebenfalls aus der Naumburger Sammlung. Die Prunus-Sammlung umfasst 84 Akzessionen, die u. a. aus dem East Malling Forschungsinstitut für Obstbau (Großbritannien), dem Vavilov Forschungsinstitutes für Pflanzenbau St. Petersburg (Russland) und dem Forstbotanischen Garten in Tharandt (Deutschland) kommen. Die 17 Akzessionen der Sorbus-Sammlung stammen aus Sammlungen unterschiedlicher Einrichtungen.
Auf Grund der Tatsache, dass sich die DGO als Genbanknetzwerk ausschließlich auf die Erhaltung von Sorten der einzelnen Obstarten konzentriert, bestand für die Obstgenbank des JKI die Notwendigkeit, alternative Formen für den Aufbau von Duplikatsammlungen für die einzelnen Wildarten-Sammlungen zu finden und zu etablieren. Dabei sind die Anforderungen der einzelnen Wildarten zum Teil sehr unterschiedlich. Das spiegelt sich auch in Methoden wieder, die für deren Erhaltung etabliert werden mussten, bzw. zukünftig noch etabliert werden sollen. Diese werden im Folgenden kurz vorgestellt
Die Kryokonservierung ist eine effiziente Methode zum Aufbau einer Duplikatsammlung und eine Möglichkeit der Langzeitlagerung für Pflanzen, die vegetativ (klonal) vermehrt werden (Engelmann, 2000). Sie wird inzwischen bei einer Vielzahl von Pflanzenarten angewandt (Reed, 2008). Unter Kryokonservierung (von griechisch κρύος, krýos „Kälte“ und lateinisch conservare „erhalten, bewahren“) versteht man das Aufbewahren von Zellen oder Gewebe durch Einfrieren in flüssigem Stickstoff, wobei die Vitalität der Zellen nahezu unbegrenzt aufrechterhalten werden soll.
Für die Erhaltung genetischer Ressourcen der Gattung Fragaria wurden verschiedene Methoden der Kryokonservierung von isolierten Sprossspitzen in flüssigem Stickstoff bei –196°C verglichen (Höfer & Reed, 2010). Die besten Ergebnisse wurden dabei mit der Methode der PVS2-Vitrifikation in Kombination mit einer 14-tägigen Kälte-Akklimatisierung der In-vitro-Sprosse und einer anschließenden 2-tägigen DMSO-Vorkultur der isolierten Sprossspitzen unter den gleichen Kältebedingungen erzielt (Abb. 2). Dieses Verfahren wurde im Anschluss für ein Genotypen-Screening eingesetzt. Die in der Literatur angestrebte Mindestregenerationsrate von 40 % (Reed, 2001) wurde bei allen getesteten Genotypen, sowohl bei Erdbeersorten (Fragaria × ananassa Duch.) als auch bei Akzessionen von 21 verschiedenen Fragaria-Arten mit einem Durchschnitt von 86 % erreicht (Höfer, 2016). Damit stellt die Kryokonservierung eine effektive Methode zur Sicherungsverwahrung für die genetischen Ressourcen von Fragaria in Deutschland dar. Gegenwärtig befinden sich 158 Sorten und 66 Wildarten-Akzessionen in der Kryokonservierung. Damit ist die Kryokultursammlung des JKI nach den vorliegenden Kenntnissen die größte bei Fragaria weltweit.
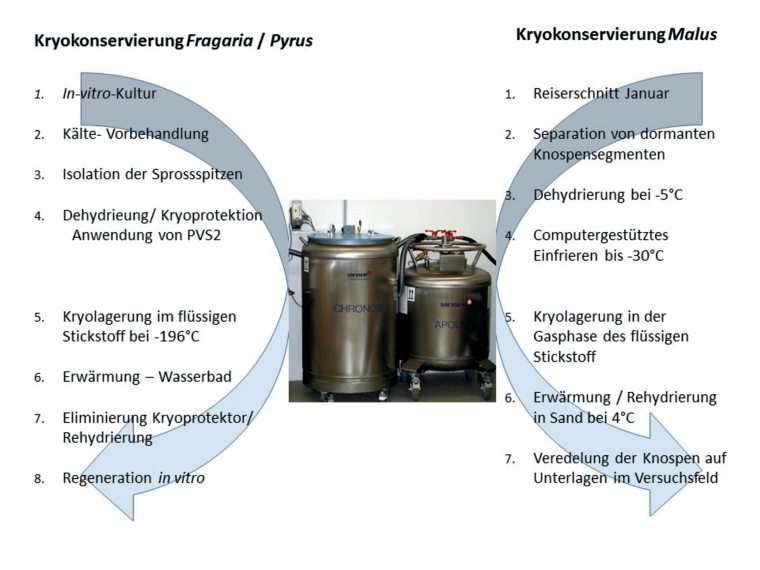
Abb. 2. Vergleichende Darstellung der Methoden der Kryokonservierung bei Fragaria und Pyrus unter der Anwendung der PVS2 Vitrifikation sowie bei Malus unter Einsatz von dormanten Knospen.
In der Wertigkeit der weiteren Bearbeitung zum Aufbau einer Duplikatsammlung hatten die Malus- und die Pyrus-Sammlungen Vorrang. Arten dieser Gattungen sind in Feldsammlungen besonders gefährdet. Ein möglicher Befall mit den geregelten Quarantäneschaderregern Erwinia amylovora (Feuerbrand), Candidatus Phytoplasma mali (Apfeltriebsucht) und Candidatus Phytoplasma pyri (Birnenverfall) würde eine Rodung der Bäume nach sich ziehen.
Bei Malus wurde ein Verfahren etabliert, welches auf der Methode der Kryokonservierung von dormanten Apfelknospen, die von Forsline et al. (1998a, b) entwickelt wurde, aufbaut und auf die Bedingungen der Obstgenbank Dresden-Pillnitz angepasst und optimiert wurde (Höfer, 2007; Höfer, 2010). Dabei werden dormante Apfelknospen nach gezielter Dehydrierung bei –5°C in einem zweistufigen Gefrierprozess in der gasförmigen Phase des flüssigen Stickstoffs gelagert und nach Rehydrierung direkt ohne Anwendung der In-vitro-Kultur auf eine Unterlage veredelt (Abb. 2). Nach der Etablierung dieser Methode erfolgte auch hier ein Genotypen-Screening. Die Ergebnisse waren stark abhängig vom Genotyp. Die Anwachsraten nach Veredelung schwankten zwischen 0 % und 100 %. Im Durchschnitt aller getesteten Malus-Akzessionen werden jedoch Anwachsraten von 40 % der veredelten Knospen erreicht (Höfer, 2015). 142 Malus-Akzessionen befinden sich zurzeit in der permanenten Kryolagerung. Aus arbeitstechnischen Gründen können jährlich ca. 40 neue Akzessionen in die Sammlung aufgenommen werden. Damit wird der Aufbau der Malus-Kryolagerung noch einige Jahre in Anspruch nehmen.
Aufgrund ihrer Bedeutung und dem hohen Aufwand der für die Etablierung von Kryokultursammlungen betrieben werden muss, wird der Ausbau der Sammlungen bei den Fragaria- und Malus-Sammlungen am JKI als separater Handlungsbedarf im Nationalen Fachprogramm zur Erhaltung und nachhaltigen Nutzung pflanzengenetischer Ressourcen landwirtschaftlicher und gartenbaulicher Kulturpflanzen (https://www.genres.de/fachportale/kultur-und-wildpflanzen/nationales-fachprogramm) genannt.
Bei Pyrus wurde ebenfalls mit der Etablierung der Methode der Kryokonservierung begonnen. Hier konnte auf bereits etablierte In-vitro-Kulturen aufgebaut werden. Für die Inkulturnahme von Sprossspitzen und die In-vitro-Vermehrung werden in Abhängigkeit vom Genotyp unterschiedliche Medien verwendet (Reed, 1999; Hanke, unveröff.). Im ersten Versuchsjahr kam ausschließlich eine modifizierte Methode der PVS2-Vitrification, wie bei Höfer (2016) beschrieben, zum Einsatz. Erste In-vitro-Sprosse wurden erfolgreich regeneriert und diese Akzessionen in die Kryo-Dauerlagerung überführt. Unabhängig von der Methode sind auch bei Pyrus auf Grund arbeitstechnischer und jahreszeitlicher Abhängigkeiten Begrenzungen gesetzt. Dadurch wird der Aufbau einer kompletten Duplikatsammlung noch mehrere Jahre dauern.
Das Global Seed Vault auf Spitzbergen (Svalbard-Archipel, Norwegen) stellt ein internationales Saatgutlager zur Erhaltung der weltweit wichtigsten pflanzengenetischen Ressourcen für Ernährung und Landwirtschaft dar (https://www.seedvault.no/). Basierend auf dem Internationalen Vertrag über pflanzengenetische Ressourcen für Ernährung und Landwirtschaft (http://www.fao.org/3/I0510DE/i0510de.pdf) schloss das norwegische Ministerium für Landwirtschaft und Ernährung 2007 ein langfristiges Partnerschaftsabkommen mit dem Nordic Genetic Resource Center* und dem Global Crop Diversity Trust** ab, um die Finanzierung, das Management und den Betrieb des Seed Vault zu gewährleisten. Die nach Svalbard eingesandten Saatgutproben verbleiben im Besitz des jeweiligen Entsendungslandes bzw. der Genbanken, die das Saatgut geliefert haben.
Das Svalbard Global Seed Vault ist in das Gebirgsmassiv von Longyearbyen, 130 m über dem Meeresspiegel, in Fels gehauen. Der Samenlagerbereich selbst befindet sich mehr als 100 m im Inneren des Berges unter 40 bis 60 m dicken Gesteinsschichten. Zusätzlich zu dem das Seed Vault umgebenden Permafrost mit einer stabilen Temperatur zwischen –3 und –4°C verfügt das Samenlager über ein zusätzliches Kühlsystem, um eine konstante Lagertemperatur von –18°C zu gewährleisten. Das Saatgutlager besteht aus drei Hallen, jede mit einer Grundfläche von etwa 9,5 × 27 m und einer Lagerkapazität von etwa 1,5 Millionen Samenproben. Das Global Seed Vault wurde am 26. Februar 2008 eröffnet.
Entsprechend den Regularien des Global Seed Vault hat das JKI, Institut für Züchtungsforschung an Obst, mit dem Königlichen Ministerium für Landwirtschaft und Ernährung in Norwegen im Jahr 2019 ein Agreement zur Einlagerung von Samen von Wildartenmustern aus der Obstgenbank Dresden-Pillnitz geschlossen. Dazu sollen Samen vor allem von Akzessionen einheimischer Wildarten durch gezielte Kreuzungen erzeugt und in Svalbard eingelagert werden. Ziel ist es, die Diversität der einheimischen Arten zu erhalten, auch wenn dabei durch die Art und Weise der Konservierung die genetische Integrität der einzelnen Muster verlorengeht. Damit wird die Erhaltung der genetischen Information, die in den Wildartensammlungen der Obstgenbank vorhanden ist vielschichtiger und eine sichere und dauerhafte Erhaltung kann gewährleistet werden.
Für die erste Einlagerung durch das JKI, Institut für Züchtungsforschung an Obst, im Februar 2020 wurden zunächst nur zwei Proben des einheimischen Wildapfels Malus sylvestris (L.) Mill. und der einheimischen Wildbirne Pyrus pyraster L. übergeben (Abb. 3). Für die Zukunft ist außerdem die Einlagerung von Samen der Erdbeerwildarten geplant.

Abb. 3. Einlagerung von Samenproben im Svalbard Global Seed Vault im Februar 2020. A) Svalbard Global Seed Vault, Norway (Quelle: Crop Trust); B) Dr. Monika Höfer bei der Übergabe der Samenproben (Quelle: Crop Trust); C) Premierministerin von Norwegen, Erna Solberg, überreicht die Urkunde an das JKI (Quelle: Global Seed Vault Ragnhild Utne); D) Probenbox des JKI im Global Seed Vault (Quelle: NordGen Asmund Asdal)
Gegenwärtig werden die obstgenetischen Ressourcen in Deutschland vor allem im Freiland erhalten, als Aktivsammlungen von Topfpflanzen für Fragaria und in Form von Bäumen für die Kern- und Steinobstarten. Um Verlusten auf Grund von Pflanzenkrankheiten und abiotischen Stressfaktoren vorzubeugen, ist der Aufbau von Duplikatsammlungen für Feldsammlungen obligatorisch.
Für die sichere Erhaltung obstgenetischer Ressourcen geht die Obstgenbank am JKI unterschiedliche Wege. Das betrifft sowohl die Obstsortensammlungen als auch die Wildartensammlungen. Dabei stellt sich das Erhaltungskonzept vielschichtig dar, wobei die international durch die FAO 1994 anerkannten ‚categories of collection’, wie Aktivsammlung, Basissammlung und Sicherheitsduplikatsammlung, Berücksichtigung finden.
Die Etablierung von Duplikatsammlungen an einem anderen Standort kommt dabei im Wesentlichen für die Obstsorten in den obstartenspezifischen Netzwerken der DGO zum Tragen. Die Kryokonservierung soll schrittweise bei allen Wildartensammlungen der Obstgenbank Dresden-Pillnitz zum Einsatz kommen sowie bei den Erdbeersorten. Parallel dazu wird die Sendung von Samenproben an das Global Seed Vault für ausgewählte Wildarten ein zusätzliches Duplikat darstellen.
Ausschließlich die Kombination von verschiedenen Erhaltungsmethoden hat das Potenzial, die genetischen Ressourcen bei Obst nachhaltig und effektiv für die Zukunft zu sichern und für die unterschiedlichsten Nutzungsmöglichkeiten bereitzustellen.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Büttner, R., 1994: Das Wildapfelsortiment der Genbank Obst und seine Evaluierung. Vortr. Pflanzenzüchtung 27, 21-24.
Büttner, R., M. Fischer, M. Geibel, P.L. Forsline, V.V. Ponomarenko, 2000: Genebank work for preservation of the genetic diversity of wild apples. Acta Horticulturae 538, 39-42.
Deutsche Genbank Obst, 2020: Zugriff: 18. März 2020, URL: https://www.deutsche-genbank-obst.de/.
Engelmann, F., 2000: Importance of cryopreservation for the conservation of plant genetic Resources In: Cryopreservation of tropical germplasm. Current research progress and application. Engelmann, F., H. Takagi (Hrsg.) Japan International Research Center for Agricultural Sciences, Japan; International Plant Genetic Resources Institute, Rome, Italy, 8-20.
Engels, J.M.M., L. Visser (Hrsg.), 2003: A guide to effective management of germplasm collections. International Plant Genetic Resources Institute, ISBN: 92-9043-582-8.
Fao/Ipgri, 1994: Genbankstandards. Rome. FAO/IPGR.
Fischer, M., R. Büttner, 1986: Die Bedeutung der Pillnitzer Malusarten-Kollektion für die Apfelzüchtung und als internationaler Genfonds. Archiv für Gartenbau 34, 137-145.
Fischer, M., C. Fischer, 1999: Evaluation of Malus species and cultivars at the Fruit Genebank Dresden-Pillnitz and its use for apple resistance breeding. Genetic Resources and Crop Evolution 46, 235-241.
Flachowsky, H., M. Höfer, 2010: Die Deutsche Genbank Obst, ein dezentrales Netzwerk zur nachhaltigen Erhaltung genetischer Ressourcen bei Obst. Journal für Kulturpflanzen 62, 9-16, DOI: 10.5073/JfK.2010.01.02.
Forsline, P.L., L.E. Towill, J.W. Waddell, C. Stushnoff, W.F. Lamboy, J.R.McFerson, 1998a: Recovery and longevity of cryopreserved dormant apple buds. Journal of the American Society for Horticultural Science 123, 365-370.
Forsline, P.L., J.R. McFerson, L.E. Towill, 1998b: Development of base and active collections of Malus germplasm with cryopreserved dormant buds. Acta Horticulturae 484, 75-78.
Forsline, P.L., H.S. Aldwinckle, E.E. Dickson, J.J. Luby, S.C. Hokanson, 2003: Collection, maintenance, characterization, and utilization of wild apples of central Asia. In: Horticultural reviews wild apple and fruit trees of Central Asia. Janick, J., P.L. Forsline, E.E. Dickson, M. Thompson, R.D. Way (Hrsg.), Wiley, New York, 29, S. 1-61.
Geibel, M., 2002: Genetische Ressourcen – Schatzkammer für die Zukunft. Obstbau. 1, 6-7.
Global Seed Vault, 2020: Zugriff: 18. März 2020, URL: https://www.seedvault.no/.
Gollmick, F., 1958: Beobachtungen an Malus-Artbastarden I. Archiv für Gartenbau 6, 357-382.
Henning, W., 1947: postum: Morphologisch-systematische und genetische Untersuchungen an Arten und Artbastarden der Gattung Malus. Der Züchter 17/18, 289-349.
Höfer, M., 2007: Preliminary results of cryopreservation of Malus germplasm from the gene bank collection of the Institute of Fruit Breeding Dresden. Advances in Horticultural Science 21, 251-254.
Höfer, M., 2010: Cryoconservation strategy of fruit genetic resources in Germany. CryoLetters 31, 83-84.
Höfer, M., 2015: Cryopreservation of winter-dormant apple buds: establishment of a duplicate collection of Malus germplasm. Plant Cell, Tissue and Organ Culture (PCTOC) 121, 647–656, DOI: 10.1007/s11240-015-0735-1.
Höfer, M., 2016: Cryopreservation of in vitro shoot tips of strawberry by the vitrification method – Establishment of a duplicate collection of Fragaria germplasm. CryoLetters 37, 163-172.
Höfer, M., Reed, B.M., 2010: Cryopreservation of Strawberry Genetic Resources in Germany. Acta Horticulturae 918, 139–146, DOI: 10.17660/ActaHortic.2011.918.16.
Höfer, M., Flachwosky, H., Hanke, M.-V., 2019: German Fruit Genebank – looking back 10 years after launching a national network for sustainable preservation of fruit genetic resources. Journal für Kulturpflanzen 71, 41–51, DOI: 10.5073/JfK.2019.02-03.01.
Luby, J., Ph. Forsline, H. Aldwinckle, V. Bus, M. Geibel, 2001: Silk road apples – Collection, evaluation, and utilization of Malus sieversii from Central Asia. HortScience 36, 225-231, DOI: 10.21273/HORTSCI.36.2.225.
Kuckuck, H., M. Schmidt, 1948: Zwanzig Jahre Pflanzenzüchtung in Müncheberg. Der Züchter 19, 130-135.
Mildenberger, G., 1963: Studien zur Taxonomie der Gattung Malus I. Morphologisch-genetische Untersuchungen. Archiv für Gartenbau. 3, 191-207.
Müntz, K., U. Wobus, 2012: Das Institut Gatersleben und seine Geschichte. Springer, Berlin und Heidelberg, ISBN 978-3-642-28648-3, 170-172.
Murawski, H., 1968: 40 Jahre Obstzüchtung in Müncheberg. Archiv für Gartenbau. 16, 400-430.
Nationales Fachprogramm pflanzengenetische Ressourcen, 2020: Zugriff: 18. März 2020, URL https://www.ble.de/DE/Themen/Landwirtschaft/Biologische-Vielfalt/Nationales-Fachprogramm-Pflanzen/nationales-fachprogramm-pflanzen_node.html.
Reed, B.M., 1999: Lab Manual. USDA-ARS National Clonal Germplasm Respository. Corvallis, Oregon.
Reed, B.M., 2001: Implementing cryogenic storage of clonally propagated plants. CryoLetters 22, 97-104.
Reed, B.M., 2008: Cryopreservation ¬ Practical considerations In: Plant Cryopreservation: A practical guide. Reed, B.M. (Hrsg.) Springer, New York, 3-13.
Schmidt, M., 1948: Erreichtes und Erstrebtes in der Obstzüchtung. Der Züchter. 19, 135-153.
Seelinger, R., 1934: Beobachtungen an Malus-Arten I. Mitteilungen der Deutschen Dendrologischen Gesellschaft. 46, 1-22.
Staudt, G., 2005: Notes on Asiatic Fragaria species: IV: Fragaria iinumae. Bot. Jahrb. Syst. 126, 163-175.
Staudt, G., 2006: Himalayan species of Fragaria (Rosaceae). Bot. Jahrb. Syst. 126, 483-508.
Staudt, G., D. Ulrich, S. Schneider, P. Scheewe, K. Olbricht, 2009: Fragaria iturupensis: a New Source for Strawberry Improvement. Acta Horticulturae 842, 479-482, DOI: 10.17660/ActaHortic.2009.842.97.
Wachsmuth, B., 2010: Wild, alpine and musk strawberries. The Plantsman 12, 245-249.
Fußnoten:
Nordic Genetic Resource Center – gemeinsame Genbank und Wissenszentrum für genetische Ressourcen in den nordischen Län | |
Global Crop Diversity Trust – internationale gemeinnützige Organisation, die sich für den Erhalt der Nutzpflanzenvielfalt einsetzt, um die globale Ernährungssicherheit zu schützen |