

Bestimmung der in Deutschland vorkommenden Pathotypen des Erregers der Samtfleckenkrankheit an Tomate, Fulvia fulva
Determination of pathotypes of tomato leaf mold, Fulvia fulva, occurring in Germany
Journal für Kulturpflanzen, 73 (1-2). S. 32–40, 2021, ISSN 1867-0911, DOI: 10.5073/JfK.2021.01-02.04, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Ein zunehmendes Problem im ökologischen, aber durch die Reduktion anwendbarer Pflanzenschutzmittel auch vermehrt im konventionellen sowie integrierten, Tomatenanbau ist die Samtfleckenkrankheit, verursacht durch den pilzlichen Erreger Fulvia fulva (syn. Passalora fulva, Cladosporium fulvum). Zur Vermeidung von Schäden durch den Erreger mit zum Teil erheblichen Ertragsausfällen wird der Anbau resistenter Sorten empfohlen. In den vergangenen Jahren wurden die monogen bedingten Resistenzen durch die Anpassung und die Bildung offensichtlich neuer Pathotypen des Erregers immer häufiger durchbrochen. Bislang liegen zum Vorkommen von Pathotypen in Deutschland keine Kenntnisse vor. Das Wissen darüber ist essentiell für eine effektive Züchtungsarbeit an neuen Tomatensorten.
Das Julius Kühn-Institut hat zusammen mit dem gemeinnützigen Züchterverein Kultursaat e. V. ein im Bundesprogramm Ökologischer Landbau und andere Formen nachhaltiger Landwirtschaft (BÖLN) gefördertes Projekt konzipiert mit dem Ziel, im Pathosystem Tomate-Fulvia fulva eine neue Züchtungsstrategie zu erproben und neue Resistenzquellen zu erschließen. Ein Teilbereich der Arbeiten befasste sich mit dem aktuellen Auftreten der Pathotypen von F. fulva in Deutschland. Es wurden diverse Isolate aus Einsendungen in eine Pathogenbank aufgenommen und die Pathotypen mit Hilfe eines Differentialsortimentes Tomate (MATREF) in Klimakammerversuchen identifiziert. Daraus wurde eine Übersicht über das momentane räumliche Vorkommen der Pathotypen in Deutschland erstellt, die für die Züchtungsarbeit im Projekt richtungsweisend ist sowie für den Anbau in der Praxis wichtige Hinweise gibt.
Stichwörter: Tomate, Samtfleckenkrankheit, Fulvia fulva, Pathotypen, Vorkommen, Deutschland
Tomato leaf mold caused by Fulvia fulva (syn. Passalora fulva, Cladosporium fulvum) is an increasing problem in organically grown plants as well as in conventional and integrated cultivation, due to the reduction of applicable plant protection products. To counter the impacts on yield it is recommended to grow resistant varieties. In recent years, however, the frequency of breakdown of the monogenic resistance of these varieties has increased. To date, there is no knowledge of the occurrence of pathotypes in Germany. Nevertheless, knowledge about pathotypes is essential to conduct effective breeding work on new tomato varieties.
Together with the non-profit breeders’ association Kultursaat e. V., the Julius Kühn-Institute has designed a project supported by the Federal Programme “Organic Farming and Other Forms of Sustainable Agriculture”. The aim of the project was to test a new breeding strategy and to select new sources of resistance. An aspect of the project concerned with the current appearance of pathotypes of Fulvia fulva in Germany. Various isolates from submissions were entered into a pathogen bank and to a large degree identified in climatic chamber tests using a tomato differential set (MATREF). From these results, an overwiew was created which depicts the spatial occurence of different pathotypes in Germany and contains relevant information for breeding work during the project and growing in practice.
Key words: tomato, tomato leaf mold, Fulvia fulva, pathotypes, occurence, Germany
Ein zunehmendes Problem im geschützten Tomatenanbau ist die Samtfleckenkrankheit, verursacht durch den Pilz Fulvia fulva (Cooke) Cif. (1954) (syn. Passalora fulva, Cladosporium fulvum). Der saisonale, kostengünstige Anbau unter Folie ist dabei besonders betroffen. Es wird der Anbau resistenter Sorten empfohlen, die umfassend vor Infektionen schützen sollen. Fulvia fulva (Ff) wurde über viele Jahre als Cladosporium fulvum (Cf) bezeichnet, daraus leitet sich die Bezeichnung der Cf-Resistenzgene ab. Die Resistenzzüchtung konzentriert sich auf das Auffinden neuer Cf-Resistenzgene und das Einkreuzen möglichst vieler Cf-Resistenzgene in eine Sorte, um diese weitestgehend vor Angriffen des Erregers schützen zu können. In den vergangenen Jahren wurden die monogen bedingten Sortenresistenzen immer häufiger durchbrochen, vor allem in traditionellen Anbaugebieten wie der Bodensee-Region mit einem regelmäßig hohen Befallsdruck (Lammer, 2014, Michel, 2016). Die Folge sind enorme Schäden für die Anbauer. Im Rahmen eines BÖLN- (Bundesprogramm Ökologischer Landbau und andere Formen nachhaltiger Landwirtschaft, finanziert vom Bundesministerium für Ernährung und Landwirtschaft) geförderten Projektes, dessen Inhalt eine neue Züchtungsstrategie für das Pathosystem Tomate-Fulvia fulva war, sollte eine deutschlandweite Erfassung des aktuellen Pathotypenspektrums durchgeführt und die gesammelten Isolate an einem Differentialsortiment Tomate (MATREF) identifiziert werden. Aus den Ergebnissen können wichtige Hinweise für die Züchtung und die Praxis abgeleitet werden, die sowohl die aktuelle Relevanz der zu beachtenden Resistenzgene als auch den regional differenzierten Einsatz von Sorten mit unterschiedlichem Resistenzspektrum zum Inhalt haben.
2018 und 2019 wurden durch die Einsendung befallenen Blattmaterials, vor allem über die Pflanzenschutzdienste in Deutschland, fortlaufend Isolate von F. fulva gewonnen. Zusätzlich wurden Einsendungen von zwei Züchterstandorten des Projektpartners Kultursaat e. V. sowie einige Proben aus Österreich bearbeitet. Das befallene Blattmaterial wurde am Julius Kühn-Institut (JKI) aufgearbeitet, halbsteril auf PDA-Platten (PDA = potato dextrose agar) überführt und die Isolate gereinigt (Kreisel & Schauer, 1987) (Abb. 1 A-E). Lagen die Isolate in Reinform vor, wurden sie in Dauerkultur genommen, sowohl auf PDA-Schrägagarröhrchen bei + 4°C als auch in cryotubes mit 10 %iger Glyzerinlösung bei – 80°C (nach Kenyon et al., 1993) (Abb. 1 F-G). Die Identität einiger dieser Isolate als F. fulva wurde von Dr. Monika Götz (JKI, Institut für Pflanzenschutz in Gartenbau und Forst in Braunschweig) molekularbiologisch verifiziert.

Abb. 1. Einsendung vom Züchterstandort Überlingen (2018). A) Symptome blattoberseits (Chlorosen), B) Sporulation blattunterseits, C) Sporenrasen unter dem Stereomikroskop, D) halbsteriles Isolieren vom Blatt auf PDA + AB, E) Wachstum des Isolates auf PDA, F) Dauerkultur (DK) auf Schrägagarröhrchen (PDA), G) Einfüllen von agar plugs in cryotubes mit 10 %iger Glycerinlösung für Dauerkultur bei – 80°C
Zur Herstellung des Inokulationsmaterials wurde der Pilz auf PDA-Platten vermehrt (CPVO-TP/044/4 [angepasst], Persiel, 1967, de Wit, 1977). Dafür wurden 0,5 ml Suspension des jeweiligen Isolates (Sporendichte ca. 104 Sporen/ml) pro Platte aufgebracht und die Platten bei 22 – 24°C und Dunkelheit inkubiert. Nach dreiwöchigem Wachstum wurden die Konidien unter Zugabe von 10 – 15 ml Leitungswasser + 0,1 % Tween®20 pro Platte abgeschwemmt, über Mull filtriert und die gewonnene Suspension mit der Thomakammer laut CPVO-Vorgabe auf eine Sporendichte von mindestens 1,0 × 105 Sp./ml eingestellt.
Das Saatgut des Differentialsortimentes zur Bestimmung der Pathotypen stammte von MATREF (network of reference material, geführt von GEVES, Frankreich) (Tab. 1). Die bislang als resistent deklarierte Sorte Roterno F1 (RijkZwaan, De Lier, Niederlande) sowie die anfällige Sorte Moneymaker (Bingenheimer Saatgut AG, Echzell, Deutschland) wurden als Vergleichssorten in die Versuche einbezogen.
Tab. 1. Differentialsortiment Tomate-Fulvia fulva mit Resistenzgenen und Reaktionen der Pathotypen. Quelle: ISF (International Seed Federation, Nyon, Schweiz) (A = anfällig, R = resistent; grau hinterlegt: für Bestimmung der Pathotypen am JKI verwendete Sorten von MATREF)
| Pathotyp/Rasse | 0* | 1 | 2* | 3 | 4* | 1.2.4 | 2.4* | 5* | 2.3.4.5 | 2.4* | 2.5* | 2.4.5* | 2.5.9* | 2.4.5.9 | 1.2.3 |
| Gruppe |
|
| A |
| B | C | D |
|
|
| E |
|
|
| |
Tomatensorte | Resistenzgen |
| ||||||||||||||
Monalbo | keins | A | A | A | A | A | A | A | A | A | A | A | A | A | A | A |
Moneymaker | ||||||||||||||||
Motelle | ||||||||||||||||
Stirling Castle | Cf-1 | R | A | R | R | R | A | R | R | R | R |
|
|
|
| A |
Leaf Mould Resister | ||||||||||||||||
Vetomold | Cf-2 | R | R | A | R | R | A | A | R | A | A | A | A | A | A | A |
V121 | Cf-3 | R | R | R | A | R | R | R | R1 | A | R | R | R | R | R | A |
Purdue 135 | Cf-4 | R | R | R | R | A | A | A | R | A | A | R | A | R | A | R |
IVT 1149 | Cf-5 | R | R | R | R | R | R | R | A | A | R | A | A | A | A | R |
PI 187002–1 | ||||||||||||||||
Ontario 7717 | ||||||||||||||||
F77–38 (auch: Ontario 7818) | Cf-6 | R | R | R | R | R | R | R | R | R | R | R | R | R | R | R |
IVT 1154 | Cf-9 | R | R | R | R | R | R | R | R | R | R | R | R | A | A | R |
Ontario 7719 | ||||||||||||||||
Vagabond | Cf-2, Cf-4 | R | R | R | R | R | A | A | R | A | A | R | A | R | A | R |
F1 Vetomold × IVT 1149 | Cf-2, Cf-5 | R | R | R | R | R | R | R | R | A | R | A | A | A | A | R |
F1 Vagabond × IVT 1149 | Cf-2, Cf-4, Cf-5 | R | R | R | R | R | R | R | R | A | R | R | A | R | A | A |
F1 Vagabond × Ontario 7719 | Cf-2, Cf-4, Cf-9 | R | R | R | R | R | R | R | R | R | R | R | R | R | A | R |
* Pathotypen, die sehr häufig von Züchtern verwendet werden; 1Resistenz nur partiell | ||||||||||||||||
Die Pflanzenanzucht fand nach gängigen gärtnerischen Standards im Gewächshaus bei 22 – 24°C und bei Bedarf mit Zusatzlicht statt. Die Pflanzen wurden in Aussaatschalen mit Bio Traysubstrat (Klasmann-Deilmann GmbH, Geeste, Deutschland) ausgesät, nach 14 Tagen (BBCH 11/12) in 9 cm × 9 cm-Vierecktöpfe (Göttinger v. Lamprecht-Verpackungen GmbH, Göttingen, Deutschland) ebenfalls in Bio Traysubstrat pikiert und nach weiteren sieben Tagen bei BBCH 12/13 inokuliert. Ab fünf Tagen nach dem Pikieren wurden die Pflanzen einmal wöchentlich mit Bio Tomatendünger flüssig (COMPO GmbH, Münster, Deutschland) in der angegebenen Dosierung gedüngt.
Die Versuche wurden in Anlehnung an die CPVO-Richtlinie CPVO-TP/044/4 in der Klimakammer (Viessmann Kühlsysteme GmbH, Hof/Saale, Deutschland) bei 22°C und 12 Stunden Licht/12 Stunden Dunkelheit durchgeführt. Es wurden pro Tomatensorte jeweils 12 Pflanzen behandelt. Nach 24stündiger Eingewöhnung in der Klimakammer wurden die Pflanzen mit der jeweiligen Suspension mit Hilfe eines Gaschromatografiesprühers inokuliert. Die unbehandelte Kontrolle mit je drei Pflanzen/Sorte wurde mit Leitungswasser besprüht. Nach dem Abtrocknen wurden die Pflanzen für ca. 72 Stunden im Folienzelt inkubiert, um die Luftfeuchtigkeit für die Keimung der Pilzsporen zu optimieren. Zusätzlich wurden in einigen Versuchsdurchgängen Pflanzen in geringerer Anzahl (6 Pflanzen/Testsorte) im Gewächshaus behandelt, um die Stärke der Pflanzenreaktion unter suboptimalen Bedingungen für den Pilz als Vergleich heranziehen zu können.
Die Pflanzen wurden 10, 15 und 20 Tage nach der Inokulation auf Chlorosen, Nekrosen sowie die Bildung von pilzlichen Organen (Myzel, Sporen) auf der Blattfläche der Laubblätter 1–7 bonitiert. Um die Stärke der Pflanzenreaktion zu bewerten, wurde nicht nur in befallen/nicht befallen unterschieden, sondern zusätzlich die Ausprägung der Symptome nach „schwach“ (x-), „mittel“ (x) und „stark“ (x+) differenziert. Diese Differenzierung diente zur Erfassung der Virulenzstärke des geprüften Isolates und zur Einschätzung, wie stark die jeweils beteiligten Resistenzgene wirken. Die unterschiedlich starke Wirkung der einzelnen Cf-Resistenzgene ist in der Literatur beschrieben (de Wit, 1977, Hammond-Kossack & Jones, 1994, Laugé et al., 1998, Oliver et al., 2000). Bei unklarem Befund wurden Blätter in die Feuchte Kammer eingelegt und nach einigen Tagen auf das Auswachsen pilzlicher Strukturen kontrolliert. Diese wurden gegebenenfalls auf PDA-Platten isoliert.
Zur Auswertung wurde die Anzahl befallener Pflanzen pro Sorte/Linie sowie der Vergleich mit den anfälligen und resistenten Standards herangezogen. Die Ergebnisse wurden statistisch mit Hilfe von SAS® 9.4. ausgewertet. Auf das Prüfmerkmal „durchschnittliche Anzahl befallener Blätter/Pflanze“ wurde das SIMULATE-Verfahren für unbalancierte Daten und Varianzheterogenität (bei α = 5 %) angewendet.
2018 wurden an den Züchterstandorten des Projektpartners Kultursaat e. V. (Holste und Überlingen) aus befallenen Pflanzenbeständen 21 Proben von 15 Zuchtlinien bzw. Sorten gesammelt. Aus den eingesandten Blattproben wurden elf Isolate gewonnen. Weitere Einsendungen gingen von diversen Gemüsebaubetrieben aus Baden-Württemberg sowie aus Österreich ein: es handelte sich um 26 Proben von 24 Sorten, daraus konnten 15 Isolate aufbereitet werden. Im Jahr 2019 wurden erneut aus ganz Deutschland insgesamt 31 Proben an das JKI geschickt, aus denen 25 Isolate gewonnen werden konnten.
2018 und 2019 konnten insgesamt 51 Isolate in die Pathogenbank aufgenommen werden, die dann für die Bestimmung der Pathotypen zur Verfügung standen.
Die Ergebnisse der Klimakammer- und Gewächshausversuche zur Bestimmung des Pathotypen werden beispielhaft am Isolat 31/2018 (interne Probennummer) im Detail dargestellt. Das Isolat 31/2018 aus der Bodenseeregion (aus 78267 Aach) zeigte bei Testung am Differentialsortiment nachfolgend beschriebene Reaktionen:
Die Sorten Moneymaker, Monalbo, Vetomold, V121, F77–38, IVT 1154 (Abb. 2) sowie auch die bisher als resistent geführte Sorte Roterno F1 (Abb. 2, Abb. 3 C) erwiesen sich in der Klimakammer als anfällig für das Isolat 31/2018. Auch unter den für den Pilz weniger optimalen Bedingungen im Gewächshaus zeigte sich ein vergleichbares Symptombild an den Pflanzen (Abb. 2, Abb. 3 A + B), hier dargestellt am Beispiel der Testsorte IVT 1154. Die Sporulation war im Gewächshaus in der Regel geringer ausgeprägt als in der Klimakammer unter definierten Bedingungen.
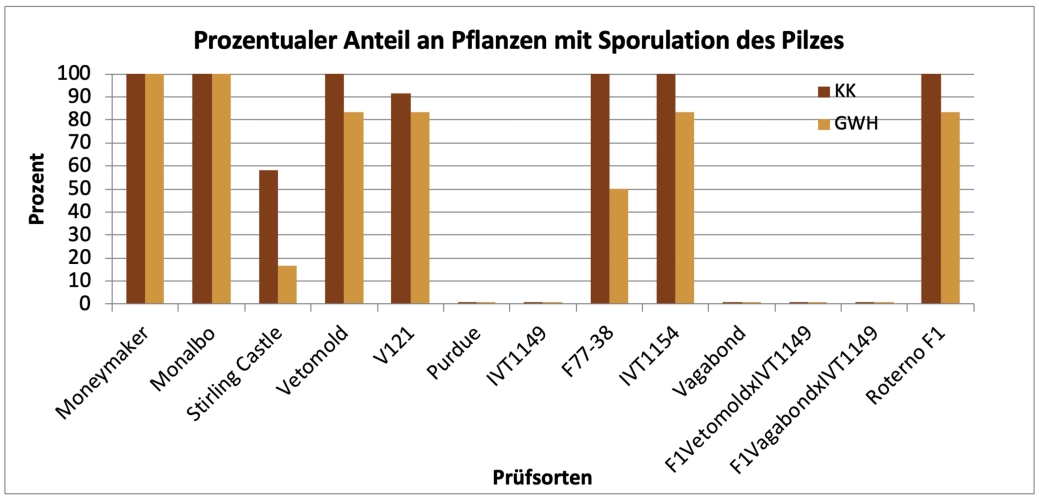
Abb. 2. Reaktion des Differentialsortiments Tomate-F. fulva (MATREF, GEVES) nach einer Inokulation mit dem Isolat 31/2018 nach 20 dpi (Tage nach Inokulation) in der Klimakammer (KK) und im Gewächshaus (GWH).

Abb. 3. Symptomausprägung (Chlorosen, Sporulation) nach 20 dpi an der Sorte IVT 1154 in der Klimakammer (A) und unter Gewächshausbedingungen (B); C) Befall an Roterno F1 (Gewächshaus).
Die Sorte Stirling Castle wies eine nur geringe und verzögerte Sporulation auf, so dass sie als resistent definiert wird (siehe Abb. 2). Dieser Unterschied in der Symptomausprägung im Vergleich zu den anderen Sorten im Differentialsortiment konnte im Klimakammerversuch am Prüfmerkmal der durchschnittlichen Anzahl befallener Blätter/Pflanze statistisch signifikant nachgewiesen werden (Abb. 4). Entsprechend ihrer Reaktion wird die Sorte Stirling Castle nach dem hier verwendeten Boniturschema mit der Differenzierung „schwach“ (x-) befallen eingestuft. Die verzögerte und schwache Sporulation der Sorte Stirling Castle zeigte sich auch in den Tests mit weiteren F. fulva-Isolaten aus der Pathogenbank und bestätigt somit die Angaben aus der Literatur zum Resistenzgen Cf1. Das in ‘Stirling Castle‘ enthaltene Resistenzgen Cf1 wird in der Literatur als schwach wirksam und eine geringe Sporulation zulassend beschrieben (von Sengbusch & Loschakowa-Hasenbusch, 1932, Persiel, 1967, de Wit, 1977, Laugé et al., 1998).
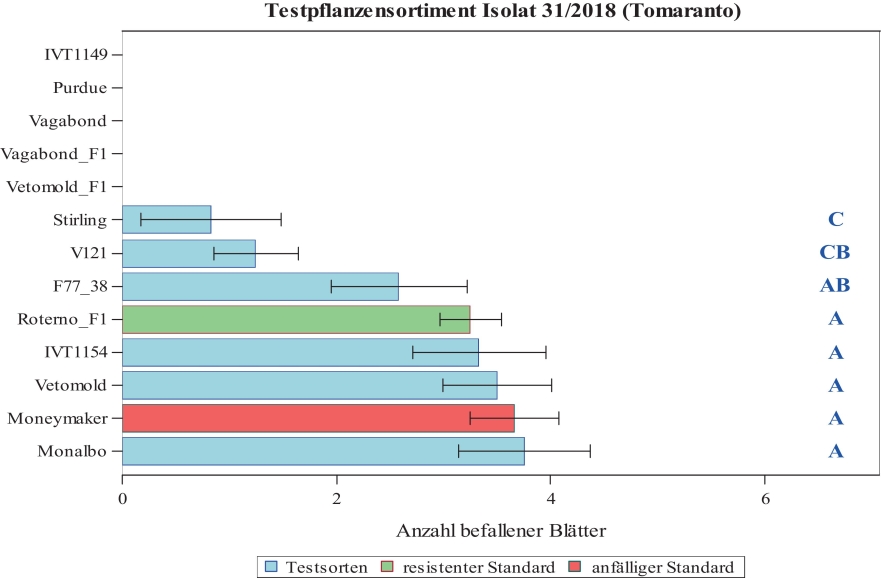
Abb. 4. Befall von Tomatenpflanzen (durchschnittliche Anzahl befallener Blätter pro Versuchspflanze) mit F. fulva (Isolat 31/2018) nach 20 dpi in der Klimakammer.
Entsprechend der Zuordnung der Sorten zu den enthaltenen Resistenzgenen gegenüber F. fulva (Tab. 2) wurde das Isolat mit der internen Probennummer 31/2018 als Pathotyp Ff:2.3.6.9 identifiziert.
Tab. 2. Reaktion ausgewählter Sorten des Differentialsortiments Tomate-F. fulva (MATREF, GEVES) nach 20 dpi mit dem Ff-Isolat 31/2018 (A – anfällig, R – resistent).
Sorte | Resistenzgen | Reaktion gg.-über Ff:31/2018 |
‘Moneymaker‘ | Cf0 | A |
‘Monalbo‘ | Cf0 | A |
‘Stirling Castle‘ | Cf1 | R |
‘Vetomold‘ | Cf2 | A |
V121 | Cf3 | A |
‘Purdue‘ | Cf4 | R |
IVT 1149 | Cf5 | R |
F77–38 | Cf6 | A |
IVT 1154 | Cf9 | A |
‘Vagabond‘ | Cf2, Cf4 | R |
F1 Vetomold × IVT 1149 | Cf2, Cf5 | R |
F1 Vagabond × IVT 1149 | Cf2, Cf4, Cf5 | R |
Roterno F1 | Cf? | A |
Von den 2018 und 2019 in Kultur genommenen Isolaten wurden bislang 16 hinsichtlich ihrer Pathotypen identifiziert. Die bisher identifizierten Pathotypen stammen von 14 marktgängigen Sorten verschiedener Züchter sowie zwei Tomatenlinien des Züchtungspartners. Die Ergebnisse sind in Tab. 3 sowie Abb. 5 dargestellt. Aus den Ergebnissen ist ersichtlich, dass in Abhängigkeit vor allem von der geografischen Lage in Deutschland und Österreich diverse Pathotypen des Erregers vorkommen. Die in der Pathogenbank vorhandenen Provenienzen des Erregers, die noch einem Pathotyp zuzuordnen sind, wurden in Abb. 5 gelb markiert.
Tab. 3. Übersicht über die am JKI identifizierten Ff-Isolate mit Herkunft und anfälligen Sorten des Differentialsortiments (MM – ‘Moneymaker‘).
Proben-Nr. | Probenahme | Herkunft | Bestimmung Pathotyp | Anfällige Sorten im Differentialsortiment |
31/2018 | 22.05.18 | 78267 Aach | Ff:2.3.6.9 | MM, Monalbo, Vetomold, V121, IVT 1154, F77–38, Roterno F1, (Stirling Castle)* |
33/2018 | 05.06.18 | 79356 Eichstetten | Ff:2.3.9 | MM, Monalbo, Vetomold, V121, IVT 1154, (Stirling Castle); (min. Befall an F77–38 u. Roterno F1) |
30/2018 | 22.05.18 | 78267 Aach | Ff:2.3.6.9 | MM, Monalbo, Vetomold, V121, IVT 1154, F77–38, Roterno F1, (Stirling Castle) |
50/2018 | 14.08.18 | 27729 Holste | Ff:1.2.5 | MM, Monalbo, Vetomold, F1 Vetomold, IVT 1149, Stirling Castle, (V121, F77–38) |
54/2018 | 27.08.18 | 88682 Salem | Ff:2.6.9 | MM, Monalbo, Vetomold, IVT 1154, F77–38, Roterno F1, (Stirling Castle, V121) |
61/2018 | 14.09.18 | A-8010 Kainbach | Ff:2.3.5 | MM, Monalbo, IVT1149, Vetomold, F1 Vetomold, V121, (Stirling Castle) |
70/2018 | 08.10.18 | 79379 Müllheim-H. | Ff:2.3.9 | MM, Monalbo, IVT 1154, Vetomold, V121, (Stirling Castle) |
43/2018 | 31.07.18 | 79426 Buggingen | Ff:2.6.9 | MM, Monalbo, Vetomold, IVT 1154, F77–38, Roterno F1, (V121, Stirling Castle) |
57/2018 | 30.08.18 | A-8200 Gleisdorf | Ff:1.2.3 | MM, Monalbo, Stirling Castle, V121, Vetomold |
59/2018 | 03.09.18 | A-3244 Ruprechtshofen | Ff:2.(3) | MM, Monalbo, Vetomold, (Stirling Castle, V121) |
78/2019 | 30.07.19 | 17237 Blankensee | Ff:2.3.9 | MM, Monalbo, Vetomold, (Stirling Castle), V121, IVT 1154 |
94/2019 | 20.08.19 | 01796 Pirna | Ff:2.3 | MM, Monalbo, Vetomold, (Stirling Castle), V121 |
101/2019 | 09.09.19 | 27313 Westen | Ff:2.3.6.9 | MM, Monalbo, (Stirling Castle), Vetomold, V121, F77–38, IVT 1154, Roterno F1 |
80/2019 | 12.08.19 | 34355 Escherode | Ff:2.3.9 | MM, Monalbo, (Stirling Castle), Vetomold, V121, IVT 1154 |
103/2019 | 24.09.19 | 16321 Bernau | Ff.1.2.3 | MM, Monalbo, Stirling Castle, Vetomold, V121 |
90/2019 | 19.08.19 | 41366 Schwalmtal | Ff:2.9 | MM, Monalbo, Vetomold, IVT 1154 |
* Sorte Stirling Castle (u. a.) wurde jeweils in Klammern gesetzt, da sie trotz Resistenz leichte Symptome aufwies (Erläuterungen dazu im Text) | ||||
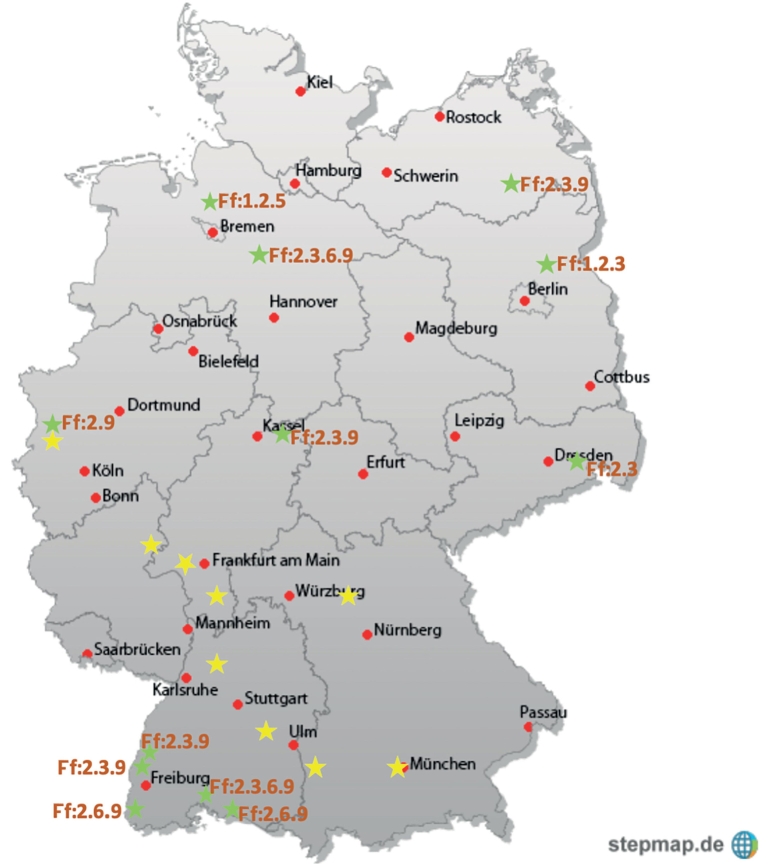
Abb. 5. Lokales Vorkommen von Pathotypen von F. fulva in Deutschland, Stand 2019. Grüne Markierungen: identifizierte Isolate; gelbe Markierungen: in Dauerkultur, als Pathotyp noch nicht identifiziert.
Es ist bekannt, dass Fulvia fulva hoch mutagen ist und weltweit fortlaufend neue Pathotypen mit veränderter Virulenz gegenüber den Tomaten auftreten (Kerr et al., 1971, Erfurth et al., 1982, Laterrot et al., 1985, Laterrot, 1986, Lindhout et al., 1989, Joosten et al., 1997, Oliver et al., 2000, Enya et al., 2009, Iida et al., 2010, Iida et al., 2015, Kubota et al., 2015, Li et al., 2015). Auch aus Deutschland, der Schweiz und Österreich gibt es seit einiger Zeit Berichte über Resistenzdurchbrüche an bisher als resistent geführten Sorten (Lammer, 2014, Michel, 2016), die mutmaßlich durch neue Pathotypen von F. fulva verursacht werden. Die hier dargestellten Untersuchungen bestätigen dies. Es wurden mit Samtflecken befallene Pflanzen diverser marktgängiger Sorten eingesendet, die bisher als resistent gegenüber dem Erreger eingestuft wurden. Der Resistenzumfang dieser Sorten wird von den Züchtern meist als Ff:A-E angegeben, das entspricht den Resistenzgenen Cf1, 2, 4, 5 und 9. Es war jedoch nicht bekannt, welches Pathotypenspektrum aktuell im deutschsprachigen Raum vorliegt. Mit den im Projekt durchgeführten Tests konnten erstmals Kenntnisse zum lokalen Auftreten von Pathotypen des Erregers in Deutschland gewonnen werden.
Die Zusendung von befallenem Pflanzenmaterial durch Pflanzenschutzberater und Tomatenproduzenten nahm im Projektverlauf mit Weitergabe der Informationen zu. Es zeigte sich eine deutliche Häufung der Befallsproblematik im süddeutschen, vor allem bodenseenahen Raum, wie es auch schon Lammer (2014) und Michel (2016) für den österreichischen und schweizerischen Bereich beschreiben. Aus den anderen Regionen Deutschlands wurde nur über temporäre bzw. spät im Jahr auftretende Befallslagen berichtet. Besonders problematisch scheinen Pathotypen mit den Virulenzgenen Avr9 und auch Avr3 (Ff:2.3.6.9, Ff:2.3.9, Ff:2.6.9) zu sein, da diese Pathotypen auch bisher widerstandsfähige Sorten wie Roterno F1 befallen. Dies bestätigte sich analog in den eigenen Versuchen. Die durchgeführten Tests mit den gewonnenen Isolaten am Differentialsortiment zeigen, dass diese Pathotypen vor allem in der Bodenseeregion, zum Teil aber auch in Mittel- und Norddeutschland verbreitet sind. Jedoch wurde am Züchterstandort in Norddeutschland (Holste) auch ein Pathotyp mit abweichender Genausstattung (Ff:1.2.5) aufgefunden. Das Cf5-Resistenzgen trat in den bisherigen Untersuchungen bei keinem weiteren Pathotyp in Deutschland auf.
Mit den Klimakammertests konnten die Pathotypen eindeutig identifiziert werden. Die Gewächshausversuche führten zu einem zusätzlichen Erkenntnisgewinn hinsichtlich der Virulenzstärke der Isolate. Je stärker die Symptomausprägung unter den im Gewächshaus vorherrschenden suboptimalen Bedingungen war, als desto aggressiver ist das Isolat einzuschätzen.
Die Kenntnisse zum Vorkommen von Pathotypen des Erregers sind für die Züchtung von grundlegender Bedeutung und konnten im Rahmen des Projektes für die Entwicklung einer neuen Züchtungsstrategie genutzt werden. Mit der Erzeugung von F4-Kreuzungsnachkommenschaften und der Erschließung neuer Resistenzquellen werden neue Züchtungsansätze bei Tomate erprobt, die der Krankheitsproblematik mit F. fulva effektiv und langfristig begegnen. Mit diesen F4-Kreuzungsnachkommen aus neuen Kreuzungen ähnlicher Linien wurden genetisch teilheterogene Populationen erzeugt, die variabler auf Stressoren reagieren können.
Mit den Untersuchungen zu den in den Anbaugebieten Deutschlands vorkommenden Pathotypen von F. fulva stehen für den Tomatenanbau erste Kenntnisse zur Sortenwahl hinsichtlich ihrer Resistenz zur Verfügung. Allerdings reichen die Untersuchungen nicht aus, um ein umfassendes Bild zur Verbreitung der Pathotypen und zur Populationsdynamik geben zu können. Die Kenntnisse zum Auftreten von Pathotypen sowie zur Populationsdynamik sind für die Züchtung von entscheidender Bedeutung, daher sind die entsprechenden Arbeiten (im Rahmen des Projektes) weiterzuführen, um letztlich die neue Züchtungsstrategie auch mit den teilresistenten Populationen validieren zu können.
Mit den Untersuchungen konnte erstmals ein aktuelles Bild des Pathotypenvorkommens von F. fulva in Deutschland aufgezeigt werden, welches für die Züchtung richtungsweisend ist und wertvolle praktische Hinweise in der Sortenwahl hinsichtlich Resistenzen gibt. Zur Vervollständigung des Bildes zum lokalen Auftreten der Pathotypen in Deutschland und der Erfassung einer zeitlichen Dynamik in der Pathotypenbildung sind weitere Untersuchungen erforderlich.
Da in den befallsintensiven Gebieten immer wieder über Resistenzdurchbrüche an bisher als widerstandsfähig geltenden Sorten berichtet wird, ist die im Rahmen des Projektes erforschte neue Züchtungsstrategie im ökologischen Tomatenanbau ein wichtiger Lösungsansatz. Die in der Projektarbeit gefundenen, gegen die nachgewiesenen neuen Pathotypen von F. fulva resistenten, Kultursaat-Linien sind ein bedeutender Meilenstein für die weitere Züchtungsarbeit. Die für den ökologischen Anbau entwickelte Züchtungsstrategie ist in Anbetracht der Reduzierung von Pflanzenschutzmitteln für den konventionellen und integrierten Anbau ein gleichfalls interessanter Lösungsansatz beim Anbau von Tomaten.
Die Autoren danken dem Bundesministerium für Ernährung und Landwirtschaft (BÖLN – Bundesprogramm Ökologischer Landbau und andere Formen nachhaltiger Landwirtschaft) für die Finanzierung des Projektes „Neues Konzept für die ökologische Tomatenzüchtung“, in dessen Rahmen die hier beschriebenen Versuche durchgeführt wurden. Weiterhin bedanken wir uns bei den Mitarbeitern des Projektpartners Kultursaat e. V. für die fruchtbare Zusammenarbeit sowie bei allen Pflanzenschutzberatern und Tomatenproduzenten, die uns mit der Einsendung von befallenen Pflanzenproben unterstützt haben. Frau Dr. Monika Götz vom Julius Kühn-Institut (Institut für Pflanzenschutz in Gartenbau und Forst) sei herzlich gedankt für die Durchführung der molekularbiologischen Arbeiten zur eindeutigen Identifizierung einiger Proben des bearbeiteten Pilzes F. fulva. Nicht zuletzt wäre die Durchführung der Arbeiten nicht möglich gewesen ohne das Engagement der technischen Assistentinen Heike Stosius und Eveline Büttner.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
de Wit, P.J.G.M., 1977: A light and scanning-electron microscopic study of infection of tomato plants by virulent and avirulent races of Cladosporium fulvum. Netherlands Journal of Plant Pathology 83 (3), 109-122.
Enya, J., K. Ikeda, T. Takeuchi, N. Horikoshi, T. Higashi, T. Sakai, Y. Iida, K. Nishi, M. Kubota, 2009: The first occurrence of leaf mold of tomato caused by races 4.9 and 4.9.11 of Passalora fulva (syn. Fulvia fulva) in Japan. Journal of General Plant Pathology 75 (1), 76–79, DOI: 10.1007/s10327-008-0134-0.
Erfurth, P., A. Ramson, D. Kießling, 1982: Die Samtfleckenkrankheit der Tomate und ihre Bekämpfung. Merkblatt des Pflanzenschutzes S7032. Hrsg.: Akademie der Landwirtschaftswissenschaften der DDR.
Hammond-Kossack, K.E., J.D.G. Jones, 1994: Incomplete Dominance of Tomato Cf Genes for Resistance to Cladosporium fulvum. Molecular Plant-Microbe Interactions 7(1), 58-70.
Iida, Y., Y. Iwadate, M. Kubota, F. Terami, 2010: Occurence of a new race 2.9 of leaf mold of tomato in Japan. Journal of General Plant Pathology 76 (1), 84-86, DOI: 10.1007/s10327-009-0207-8.
Iida, Y., P. van ‘t Hof, H. Beenen, C. Mesarich, M. Kubota, I. Stergiopoulos, R. Mehrabi, A. Notsu, K. Fujiwara, A. Bahkali, K. Abd-Elsalam, J. Collemare, P.J.G.M. de Wit, 2015: Novel Mutations Detected in Avirulence Genes Overcoming Tomato Cf Resistance Genes in Isolates of a Japanese Population of Cladosporium fulvum. PLoS ONE 10 (4), e0123271, DOI: 10.1371/journal. pone.0123271.
Joosten, M.H.A.J., R. Vogelsang, T.J. Cozijnsen, M.C. Verberne, P.J.G.M. de Wit, 1997: The Biotrophic Fungus Cladosporium fulvum Circumvents Cf-4-Mediated Resistance by Producing Unstable AVR4 Elicitors. The Plant Cell 9 (3), 367-379.
Kenyon, L., B.G. Lewis, A. Coddington, R. Harling, J.G. Turner, 1993: Pathogenicity mutants of the tomato leaf mould fungus Fulvia fulva (Cooke) Ciferri (syn. Cladosporium fulvum Cooke). Physiological and Molecular Plant Pathology 43 (3), 173-191.
Kerr, E.A., Z.A. Patrick, D.L. Bailey, 1971: Resistance in tomato species to new races of leaf mold (Cladosporium fulvum Cke.). Horticulture Research 11 (2), 84-92.
Kreisel, H., F. Schauer, 1987: Methoden des mykologischen Laboratoriums. Stuttgart, Verlag Gustav Fischer, 181 S.
Kubota, M., M. Morishima, Y. Iida, 2015: First occurrence of tomato leaf mold caused by the novel races 2.5.9 and 4.5.9 of Passalora fulva in Japan. Journal of General Plant Pathology 81 (4), 320–323, DOI: 10.1007/s10327-015-0592-0.
Lammer, P., 2014: Resistenz ausgewählter Tomaten-Liniensorten gegenüber der Samtfleckenkrankheit (Passalora fulva, syn. Cladosporium fulvum) unter biologischen Anbaubedingungen. Masterarbeit, Universität für Bodenkultur Wien, 131 S.
Laterrot, H., 1986: Race 2.5.9, a new race of Cladosporium fulvum (Fulvia fulva) and sources of resistance in tomato. Netherlands Journal of Plant Pathology 92 (6), 305-307.
Laterrot, H., M. Gerlagh, A. Ester, L. Stamova, 1985: Race 2.5, a new race of Cladosporium fulvum (Fulvia fulva) on tomate. Netherlands Journal of Plant Pathology 91 (1), 45-47.
Laugé, R., M.H.A.J. Joosten, J.P.W. Haanstra, P.H. Goodwin, P. Lindhout, P.J.G.M. de Wit, 1998: Successful search for a resistance gene in tomato targeted against a virulence factor of a fungal pathogen. Plant Biology 95 (15), 9014-9018.
Li, S., T. Zhao, H. Li, X. Xu, J. Li, 2015: First report of races 2.5 and 2.4.5 of Cladosporium fulvum (syn. Passalora fulva), causal fungus of tomato leaf mold disease in China. Journal of General Plant Pathology 81 (2), 162–165, DOI: 10.1007/s10327-015-0577-z.
Lindhout, P., W. Korta, M. Cislik, I. Vos, T. Gerlagh, 1989: Further identification of races of Cladosporium fulvum (Fulvia fulva) on tomato originating from the Netherlands, France and Poland. Netherlands Journal of Plant Pathology 95 (3), 143-148.
Michel, V., 2016: Cladosporium fulvum in der Schweiz. Neue Rasse des Erregers der Samtfleckenkrankheit an Tomate. Gemüse 2016 (4), 24-25.
Oliver, R.P., B. Henricot, G. Segers, 2000: Cladosporium fulvum, cause of leaf mould of tomato. In: Fungal Pathology. Kronstad, J.W. (Hrsg.), Dordrecht (NL), Kluwer Academic Publishers, 65-91.
Persiel, F., 1967: Resistenz und Resistenzzüchtung gegen die Braunfleckenkrankheit, Cladosporium fulvum Cooke, bei Tomaten. Zeitschrift für Pflanzenzüchtung 57 (4), 325-360.
Von Sengbusch, R., N. Loschakowa-Hasenbusch, 1932: Immunitätszüchtung bei Tomaten. Vorläufige Mitteilung über die Züchtung gegen die Braunfleckenkrankheit (Cladosporium fulvum Coocke) resistenter Sorten. Der Züchter 4 (11), 257-264.