

Entwicklungen in der Resistenzzüchtung an Kartoffel: Herausforderungen der Vergangenheit, Gegenwart und Zukunft
Developments in breeding for resistance in potato: Challenges of the past, present and future
Journal für Kulturpflanzen, 73 (7-8). S. 214–224, 2021, ISSN 1867-0911, DOI: 10.5073/JfK.2021.07-08.05, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Die Kartoffel (Solanum tuberosum) ist weltweit eine der wichtigsten Nahrungspflanzen. Sie ist eine Kulturart mit vielfältigen Verwendungsmöglichkeiten und einem hohen Wertschöpfungspotenzial. Allerdings wird die Kulturkartoffel auch von einer Vielzahl an Schaderregern befallen. Die Kraut- und Knollenfäule (Phytophthora infestans) sowie verschiedene Viren verursachen beträchtliche Ertrags-und Qualitätseinbußen. Daher ist die Resistenzzüchtung gegen diese Schaderreger schon seit langem von entscheidender Bedeutung. Sie stehen ebenfalls im Fokus der Züchtungsforschung und Resistenzprüfung am Julius Kühn-Institut. Heute kommen neben klassischen Züchtungsmethoden, zunehmend Techniken der markergestützten Selektion im Zuchtprozess zur Anwendung. Auch Methoden der Genomeditierung können möglicherweise in Zukunft eingesetzt werden um gesunde und ertragsstabile Kartoffelsorten zu entwickeln.
Stichwörter: Kartoffel, Solanum tuberosum, Kraut- und Knollenfäule, Viren, Zuchtmethoden
Potato (Solanum tuberosum) is one of the most important staple foods worldwide carrying versatile opportunities in utilisation and high added value. Cultivated potato is threatened by various diseases and pests. Late blight caused by Phytophthora infestans and various viruses cause high losses in yield and quality. Since many decades breeding for disease resistance is of high importance. Thus at Julius Kühn-Institute breeding research and resistance testing are focussed on them. Besides classical breeding methods marker assisted selection becomes of increasing importance in the breeding process yet. In future methods of genome editing possibly will be introduced into the breeding process for healthy and high valuable potatoes.
Key words: Potato, Solanum tuberosum, Late blight, potato virus, breeding methods
Die Kartoffel war über viele Jahrzehnte in weiten Teilen Europas das Grundnahrungsmittel schlechthin. Heute ist sie eine Kulturart mit vielfältigen Verwendungsmöglichkeiten und hohem Wertschöpfungspotenzial. Die am Julius Kühn-Institut (JKI) betriebene Züchtungsforschung und die Resistenzprüfung im Rahmen der Wertprüfung durch das Bundessortenamt (BSA) sind auf die kontinuierliche züchterische Verbesserung der Kartoffel gerichtet.
Im Folgenden soll die Relevanz der Resistenzzüchtung und –prüfung am Beispiel der zwei ökonomisch wichtigsten Krankheitskomplexe der Kartoffel, der Kraut-und Knollenfäule und einer Gruppe ausgewählter Kartoffelvirosen, beschrieben werden.
Züchtungsmethodisch ist die Kartoffel der Klonzüchtung zuzuordnen. Klonsorten werden vegetativ über Spross-, Blatt- oder Wurzelteile vermehrt und die Nachkommenschaften sind genetisch identisch mit dem Ausgangsmaterial. Um im Rahmen der Klonzüchtung Sorten mit neuen Eigenschaften züchten zu können, muss zu Beginn des Zuchtprozesses die vegetative Fortpflanzungsweise durch eine sexuelle Kreuzung durchbrochen und auf diese Weise eine genetische Neukombination des Erbguts der Kreuzungspartner hervorgerufen werden (Abb. 1). Nach der Kreuzung erfolgt die weitere Vermehrung wiederum vegetativ, verbunden mit einer strengen Selektion geeigneter Zuchtklone. Durch vegetative Pflanzenteile können allerdings sehr viel mehr Krankheiten auf die Nachkommen übertragen werden als über den Samen. So erweisen sich zahlreiche Viren, Bakterien und Pilze als knollenbürtig. Besondere Bedeutung haben in diesem Zusammenhang Viren, die nicht direkt chemisch bekämpft werden können (Jansky, 2000; Becker, 2011).

Abb. 1. Kreuzung von Kartoffeln mit Pollen auf einer kastrierten Blüte. Quelle: Methoden der Züchtung und Bewertung von Kartoffelzuchtmaterial, Akademie Verlag, Tschechoslowakische Akademie der Wissenschaften, Prag 1976.
Bereits ab den 30er Jahren des 20. Jahrhunderts wurden Wild- und Primitivformen der Kartoffel sowie Landsorten und Kartoffelzuchtstämme mit beispielsweise Widerstandsfähigkeit gegen Krankheiten als genetische Ressourcen in der Kartoffelzüchtung eingesetzt (Schick, 1932; Rothacker, 1993).
Ein umfangreicher Genpool wird am JKI-Institut für Züchtungsforschung an landwirtschaftlichen Kulturen in Groß Lüsewitz auf neue Genvarianten für Krankheitsresistenz evaluiert. Diese Arbeiten sind auf die Verbesserung der Widerstandsfähigkeit gegen das Kartoffelvirus Y und gegen die Kraut- und Knollenfäule gerichtet. Aber auch nach Resistenzen gegen Blattläuse als Virusüberträger, Kartoffelkäfer und Kartoffelnematoden wird in Genbank-Herkünften gesucht. In langfristig angelegten Kreuzungsprogrammen mit Solanum-Wildarten und aktuellem Kartoffelzuchtmaterial werden Arthybriden erzeugt, evaluiert und mehrfach mit aktuellen Sorten rückgekreuzt, um neben den guten agronomischen Eigenschaften der züchterisch adaptierten Sorteneltern auch Genvarianten des Wildelters für eine hohe Widerstandsfähigkeit gegen bestimmte Krankheiten zusammenzuführen (Hammann, 2013).
Das Bundessortenamt (BSA) lässt Kulturpflanzensorten zu und schützt diese Zulassung. Unterstützt wird das BSA hierbei vom JKI (früher Biologische Bundesanstalt für Land- und Forstwirtschaft, BBA), das in Form von Amtshilfe umfangreiche Prüfungen zur Krankheitsresistenz im Rahmen der Wertprüfung durchführt. Die Ergebnisse der Wertprüfung für die zugelassenen Sorten werden in der Beschreibenden Sortenliste des BSA veröffentlicht.
Die Prüfung von Pflanzen auf ihre Widerstandsfähigkeit gegen Schadorganismen wurde im Pflanzenschutzgesetz von 1949 nicht explizit geregelt (Sucker, 1998, Brammeier et al., 2001). Dennoch führte das frühere BBA-Institut für Resistenzprüfung, später Institut für Botanik, beispielsweise Forschungsarbeiten einschließlich Prüfungen zur Sortenresistenz bei Kartoffelkrankheiten wie der Kraut- und Knollenfäule durch (Ullrich, 1965; 1967; Schöber & Höppner, 1972; Schöber, 1979). Ähnliches bearbeitete das Institut für Virusforschung, später Institut für Viruskrankheiten der Pflanze, zur Virusresistenz von Kartoffeln (Köhler, 1953; Bode & Paul, 1956).
Während in der Bundesrepublik Pflanzenzüchtung und Sortenentwicklung bis heute, ausgenommen die Bereitstellung von Prebreeding-Material, privatwirtschaftlich strukturiert sind, erfolgt die Sortenprüfung und -zulassung über staatliche Stellen. In der ehemaligen DDR erfolgte beides –Züchtung und Prüfung (Zentralstelle für Sortenwesen) – in staatlichen Einrichtungen. Aus dem 1949 gegründeten Institut für Pflanzenzüchtung entwickelte sich das Institut für Kartoffelforschung der Akademie der Landwirtschaftswissenschaften (Darsow, 2000). Unter anderem wurden hier wilde und kultivierte Kartoffelspezies in erheblichem Maß genutzt, auf deren Grundlage wertvolle Kreuzungspartner mit z. B. Phytophthora-Resistenz entwickelt wurden, die noch heute in die züchterische Praxis einfließen (Oertel et al., 1986).
Bis heute ist die Kraut- und Knollenfäule, verursacht durch den Oomyceten Phytophthora infestans (Mont.) de Bary (Abb. 2 und 3), weltweit die wirtschaftlich bedeutendste Krankheit im Kartoffelanbau (Hawkes, 1990). Am deutlichsten lässt sich die ökonomische und soziale Relevanz dieser Krankheit durch die Hungersnöte in den 40er Jahren des 19. Jahrhunderts in Irland beschreiben, als P. infestans die Kartoffelkulturen und damit die Nahrungsgrundlage der Bevölkerung zerstörte (Bourke, 1993). Breits kurz danach wurde erfolgreich mit der Züchtung auf Resistenz gegen P. infestans begonnen (Dowley, 1995). Die Entwicklung wirkungsvoller Phytophthora-Fungizide engte die Bemühungen im Züchtungsbereich jedoch ein (Umaerus et al., 1983; Robinson, 1996). Trotz intensiver Fungizidanwendungen verursacht die Kraut- und Knollenfäule der Kartoffel jedoch weiterhin weltweit beträchtliche Kosten und Ertragsausfälle (Haverkort et al., 2008). Mit dem Ziel, die Krankheit wirkungsvoll einzudämmen aber auch die Pflanzenschutzmitteleinträge zu verringern, kommt der züchterischen Verbesserung der Widerstandsfähigkeit von Kartoffeln gegen P. infestans in Zukunft eine besondere Bedeutung zu.

Abb. 2. Krautfäule – Krankheitssymptome auf der Ober- und Unterseite von Kartoffelblättern. Quelle: Heiderich/JKI, Hammann/JKI.
Die Pathogenpopulation von P. infestans in Europa zeigt seit Mitte der 1970er Jahre eine zunehmende Diversität. Mittlerweile werden beide Paarungstypen A1 sowie A2 nachgewiesen, und es gibt Beweise für sexuelle Reproduktion und genetische Rekombination zu neuen Erregerrassen. Die Folge ist eine schnellere Anpassung des Erregers an veränderte Umweltbedingungen (Hohl & Iselin, 1984).
Resistenz gegen P. infestans wird durch 2 Resistenz-Typen gekennzeichnet. Bei dem ersten Resistenz-Typ sind einzelne dominante R-Gene – bekannt sind die Gene R1 bis R11 – mit klaren Spaltungsverhältnissen in den Nachkommenschaften beteiligt. Diese Gene bedingen eine komplette Resistenz gegen spezifische Erregerrassen. Jahrzehntelang beruhte die Züchtung auf Krautfäuleresistenz auf diesen R-Genen, die zuerst in der Wildart S. demissum und in eng verwandten Arten in Mexiko beobachtet und eingekreuzt wurden (Black, 1954). Aufgrund ihrer einfachen Vererbung kann diese Form der Resistenz züchterisch relativ einfach genutzt werden. Leider zeigte die Verwendung der auf einzelnen R-Genen basierenden Resistenz nur zeitlich begrenzten Erfolg. Diese Resistenz wirkt pathotypspezifisch und wird bei stetigem Anbau der resistenten Sorte durch eine selektive Bevorteilung virulenter Pathotypen, die sich in der Erregerpopulation rasch anreichern, bald durchbrochen (Bradshaw et al., 1995; Van der Plank, 1966).
Mittlerweile wurden weitere dominante Resistenzgene, beispielsweise aus Solanum bulbocastanum, einer nicht direkt kreuzbaren Wildform identifiziert und über Brückenkreuzungen mit anderen Wildarten, in langwierigen Kreuzungsprogrammen in die Kulturkartoffel eingelagert (Haverkort et al., 2009). Allerdings bergen auch diese Sorten die Gefahr von Resistenzdurchbrüchen. Daher wurde damit begonnen mehrere, nicht homologe Resistenzgene zu akkumulieren um auf diese Weise eine oligogene, dauerhaftere Resistenz in Kartoffelsorten zu erreichen (Zhu et al., 2012).
Bei fortgesetztem Anbau von Sorten mit denselben R-Genen ist diese Resistenz nicht dauerhaft und nur die Entwicklung genereller, dauerhafter Resistenz kann eine Lösung sein (Darsow, 2014).
Der zweite Resistenztyp wird bestimmt durch zahlreiche Minor-Gene, mit jeweils kleinen individuellen Effekten, die sich zu einer gegen viele Rassen des Erregers gerichteten Widerstandsfähigkeit addieren, freilich auf einem niedrigeren Expressionsniveau als die rassenspezifische Resistenz. Nach allgemeiner Auffassung ist dieser Typ von Widerstandsfähigkeit daher dauerhafter als der rassenspezifische (Bradshaw et al., 1995; Van der Plank, 1956). Dieser Resistenztypus wird auch als rassenunspezifische Resistenz, horizontale Resistenz, Feldresistenz oder auch als polygene Resistenz bezeichnet. Eine dauerhafte Resistenz wird quantitativ – d. h., von mehreren bis vielen zusammenwirkenden Genen – vererbt, was das Erreichen eines ausreichend hohen Resistenzniveaus zu einem langwierigen, stetigen Prozess mit zahlreichen Rekombinationszyklen werden lässt. Die Züchtung auf dauerhafte Resistenz ist daher züchtungsmethodisch weitaus anspruchsvoller als die Nutzung einiger weniger R-Gene mit großen Effekten. Die Nutzung der polygenen Resistenz in der Sortenzüchtung würde eine Kartoffelproduktion mit deutlich reduziertem Input an chemischem Pflanzenschutz ermöglichen. Für eine zielführende Resistenzzüchtung gegen P. infestans müssen weitere Sachverhalte beachtet werden. Resistenzen gegen einen Befall am Kraut bzw. an den Knollen sind als zwei physiologisch unterschiedliche Merkmale zu betrachten. Es gibt eine Korrelation zwischen der Widerstandsfähigkeit des Krautes und – nicht erwünschter – später Abreife. Die komplexe Vererbung erschwert den züchterischen Umgang mit der quantitativen Resistenz wesentlich. Außerdem unterliegt die Ausprägung der quantitativen Resistenz einem erheblichen Umwelteinfluss (Flier et al., 2003).
Zur Resistenzverbesserung gegen den Befall durch P. infestans wurden immer wieder andere Solanum-Wildarten eingekreuzt (Tab. 1), mit dem Ziel, eine dauerhaftere Widerstandsfähigkeit zu erreichen.
Tab. 1. Züchterisch genutzte Solanum-Arten mit hoher Kraut- und Knollenfäule-Resistenz (Hawkes, 1990). Die Darstellung erfolgt in alphabetischer Sortierung.
S. acaule | S. demissum | S. okadae |
S. berthaultii | S. × edinese | S. papita |
S. brachistotrichum | S. fendleri | S. pinnatisectum |
S. brevicaule | S. hjertingii | S. polytrichon |
S. bulbocastanum | S. hougasii | S. × sambucinum |
S. cardiophyllum | S. jamesii | S. stoloniferum |
S. chiquidenum | S. morelliforme | S. trifidum |
Da P. infestans sowohl Nekrosen auf den Blättern und Stängeln der Kartoffelpflanze als auch Fäule in der Knolle verursacht, wird der Resistenznachweis, soweit möglich, auf beide physiologische Merkmale gerichtet.
Die Prüfung der Widerstandfähigkeit von Kartoffelsorten gegen Krautfäule im Rahmen der Wertprüfung erfolgt durch das BSA im Feldversuch (BSA, 2019a). Die Resistenzprüfungen in der BBA (Schöber-Butin, 2000) lieferten über die Daten des BSA hinaus weitere detaillierte Informationen zur Widerstandsfähigkeit der Knolle aus Gewächshausversuchen, indem Kartoffelscheiben künstlich infiziert und die Intensität des sich entwickelnden Myzels bewertet wurde (Schöber-Butin, 2001). Seit Beginn der 2010er Jahre erfolgen die offiziellen Phytophthora-Resistenzprüfungen am JKI als Feldversuch in Anlehnung an die Methode der EPPO zur Bewertung der Wirksamkeit von Fungiziden (EPPO, 2012; 2020). Für die Bewertung der Widerstandsfähigkeit der Sorte wird die Fläche unter der Befallsverlaufskurve, reifegruppenspezifisch ermittelt, in Bezug zu hoch anfälligen Vergleichs- und Verrechnungssorten gesetzt und in die entsprechenden Bewertungsnoten 1–9 des BSA umgerechnet. Der Befall wird mehrmals wöchentlich eingeschätzt. Dabei wird der Anteil befallener Krautfläche an der Gesamtkrautfläche je Parzelle ermittelt. Die Bonitur hat stark subjektiven Charakter, ist zeitintensiv und benötigt langjährige Erfahrungen. Derzeit wird geprüft, ob es möglich ist, die aufwändige Sichtbonitur durch Bildanalyse zu ersetzen (Lindner et al., 2018).
Viren können in Abhängigkeit von der Kartoffelsorte Qualitätsverluste und Ertragsausfälle bis 75 % verursachen (Mellor, 1987). In Deutschland treten v. a. die im Folgenden aufgeführten Viren auf.
Das Kartoffelvirus Y (PVY), insbesondere mit den weit verbreiteten, schweren Schaden verursachenden, rekombinierten Stämmen PVYNW und PVYNTN (Glais et al., 2002) und das Kartoffelblattrollvirus (PLRV), sind dabei besonders ökonomisch bedeutend (Abb. 4, 5 und 6).
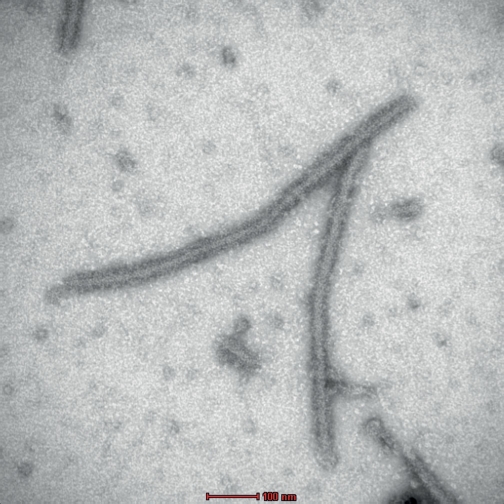
Abb. 4. Elektronenmikroskopische Aufnahme von mit Antiserum dekorierten PVY-Partikeln. Quelle: Richert-Pöggeler/JKI.

Abb. 5. Schweres von PVY verursachtes Mosaik an Kartoffelpflanzen im Bestand. Quelle: Weidemann/JKI
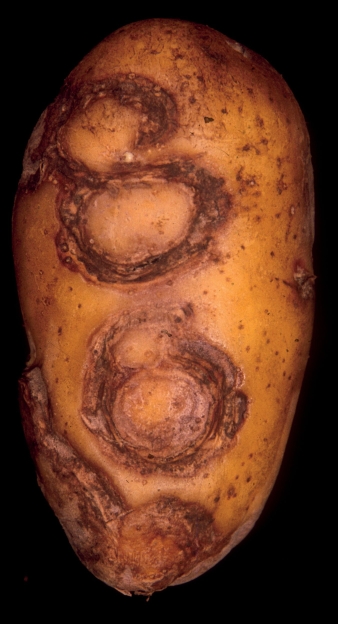
Abb. 6. Durch PVYNTN verursachte Ringnekrosen an der Oberfläche von Kartoffelknollen. Quelle: Lindner/JKI.
Kartoffelvirus A (PVA), ein Virus, das derselben Gattung wie PVY angehört, kann ebenfalls schwere Virosen verursachen, tritt jedoch nicht in vergleichbarem Umfang auf wie PVY. Kartoffelvirus X (PVX) verstärkt in Mischinfektionen mit anderen Kartoffelviren deren Schäden. Ansonsten sind die von diesem Virus verursachten Schadsymptome relativ mild. Weitere Viren wie Kartoffelvirus S (PVS), Kartoffelvirus M (PVM) und das Tabak-Rattle-Virus (TRV) können beträchtlichen Schaden verursachen, wobei sie jedoch zumeist kleinflächig in Abhängigkeit vom Standort und den dementsprechenden Bedingungen auftreten. Kartoffelviren können als systemisch bezeichnet werden, da ihre Verbreitung über Knollen und Pflanzen von Generation zu Generation stattfindet. Hierbei steigt das Infektionsniveau an und in gleichem Maße sinken Ertragsleistung und Qualität des Pflanzenmaterials (Jeffries et al., 2006). Virizide, die während der vegetativen Phase der Kartoffelpflanze den Krankheitsbefall reduzieren könnten, gibt es nicht. Größte Bedeutung bei der Produktion von Kartoffeln wird deshalb phytosanitären Strategien (Verwendung von zertifiziertem virusfreiem Pflanzgut, Selektion kranker Pflanzen in Pflanzgutbeständen durch Feldinspekteure) und den Einsatz virusresistenter Kartoffelsorten beigemessen (Thiel & Steinbach, 2018).
Mit zunehmender Intensität des Kartoffelanbaues im 19. Jahrhundert wurden Abbauerscheinungen in Form von Ertragsminderungen deutlich. Erste unbewusste Selektionen auf Virusresistenz erfolgten vermutlich damals schon, indem Sorten mit größeren Abbauerscheinungen verworfen wurden. Salaman (1921) wies Viren als deren Ursache nach. Mit Beginn der 1930er Jahre wurde eine Vielzahl von Virusresistenzgenen in Solanum-Arten beschrieben und in den Züchtungsprozess einbezogen (Tab. 2).
Tab. 2. Ausgewählte Solanum-Arten mit Majorgenen für Hypersensitivität und extreme Resistenz bzw. mit Minorgenen für Feldresistenz.
Virus | Resistenztyp | Solanum-Wildart | Referenz |
PLRV | Feldresistenz* | S. demissum | |
|
| S. acaule |
|
|
| S. andigena |
|
|
| S. chacoense | |
|
| S. etuberosum | |
|
| S. phureja | |
PVY/PVA | Feldresistenz | S. andigena |
|
|
| S. phureja | |
|
| S. previdens | |
| Extreme Resistenz** | S. stoloniferum | |
| Hypersensitivität** | S. demissum | |
|
| S. tuberosum |
|
PVY | Extreme Resistenz | S. hongasii | |
| Hypersensitivität | S. chacoense | |
PVM | Feldresistenz | S. gourlayi | |
| Hypersensitivität |
|
|
* polygen determiniert; ** monogen determiniert | |||
Der Resistenztyp, der für jedes angeführte Virus und zwar in verschiedener Ausprägung vorkommt, ist die polygen basierte horizontale oder Feldresistenz. Feldresistente Pflanzen können zwar befallen werden, die Anzahl der Infektionen ist jedoch reduziert, die Viruskonzentration in der Pflanze ist vermindert oder der Transport des Virus von Zelle zu Zelle eingeschränkt. Aufgrund der Vererbung durch wenige Polygene werden resistente Nachkommen nur erzielt, wenn beide Eltern bereits einen gewissen Grad polygener Resistenz aufweisen. Dagegen bieten durch Majorgene vermittelte Resistenztypen wie hypersensitive Resistenz (HR) und extreme Resistenz (ER) einen absoluten Schutz. ER verhindert die Virusvermehrung zu einem frühen Stadium der Infektion in der Zelle, scheint aber nicht zum Zelltod zu führen (Hämäläinen et al., 1997). Bei HR sterben die befallenen Zellen und die in ihrer nächsten Umgebung ab. In beiden Fällen wird das Virus nicht mehr systemisch verbreitet. Diese R-Gene (Majorgene) wirken gegen alle PVY-Stämme und sind in tetraploiden Zuchtstämmen meist simplex vorhanden, was die Selektion vereinfacht. Eine weitere Möglichkeit der Virusresistenz kann über eine Resistenz gegen die Vektoren der Viren erreicht werden. So besitzen beispielsweise verschiedene Solanum-Wildarten eine starke Drüsenbehaarung, die Blattläuse abweisen (Ross, 1986). In der Züchtung werden sowohl polygene als auch monogene Resistenzformen genutzt. Quellen für Virusresistenzgene in der Kartoffelzüchtung sind heute neben Sorten und resistenten Zuchtstämmen weiterhin vor allem Wildkartoffelarten (Salomon-Blackburn & Barker, 2001a; Khurana, 2004).
Die Pflanzenvirologie war zum Zeitpunkt der Durchführung erster Wertprüfungen der Kartoffel eine noch sehr junge Wissenschaft. Methoden zum Erregernachweis lagen vorerst Symptomausprägungen an Zeigerpflanzen zugrunde (Köhler, 1949). Dem folgten Augenstecklingsprüfungen (ASP), bei denen die Kartoffeljungpflanzen nicht nur visuell bewertet wurden, sondern zum direkten Erregernachweis der Präzipitintest zur Anwendung kam (Koenig, 1985). In den 80er Jahren ist der ELISA Test (+ ASP) etabliert worden (Casper & Meyer, 1981; Weidemann, 1984). Eine weitere Steigerung in der Sensibilisierung bezüglich des Erregernachweises und in der zeiteffizienten Durchführung der Resistenztests stellen molekularbiologische Verfahren dar (Pastrik & Steinbach, 2012), die derzeit am JKI etabliert werden.
Die Prüfung des BSA zur Widerstandfähigkeit von Kartoffelsorten gegen Viruskrankheiten im Rahmen der Wertprüfung erfolgt nur nach gesonderter Aufforderung (BSA, 2019b). Die eigentliche Resistenzprüfung und -bewertung wird am JKI in Form der ASP mit ELISA-Test vorgenommen, der ein Feldversuch vorangestellt ist (Landsmann, 2000; Hinrichs-Berger & Landsmann, 2000). In die Virusresistenztestung waren zunächst vier Kartoffelviren: A (PVA), M (PVM), Y (PVY) und das Blattrollvirus (PLRV) einbezogen. Auf Grund geringer wirtschaftlicher Bedeutung wurden PVM und PVA aus der Wertprüfung herausgenommen. Durch den Einsatz systemisch wirkender Insektizide nahm auch die Bedeutung von PLRV, das durch auf der Kartoffel siedelnde Blattläuse übertragen wird, ab. Im Zeitraum 2002 bis 2012 waren mehr als 80 % der offiziell ermittelten Virusinfektionen des Kartoffelpflanzgutes durch PVY verursacht. Die übrigen drei Viren waren zusammen in weniger als 20 % der Proben nachweisbar (Lindner & Billenkamp, 2005; Lindner et al., 2015). Auf Grund dieser Ergebnisse erfolgte die Virusresistenzprüfung ab 2012 nur noch für PVY.
Der Züchtung kommt bei der Bewältigung aktueller Herausforderungen wie dem Klimawandel, dem nachhaltigen Wirtschaften und dem Erhalt der Biodiversität eine besondere Rolle zu. Sowohl etablierte traditionelle Züchtungstechniken als auch neue molekulargenetische Züchtungsmethoden sollen mit dem Ziel der Erhöhung von Ressourceneffizienz und der Anpassung des Resistenz- und Toleranzverhaltens von Kulturartensorten an veränderte Umweltbedingungen weiterentwickelt werden (BMEL, 2020a).
Die aktuellen Zuchtmethoden basieren zu einem großen Teil wie auch die der klassischen Methoden auf der Nutzung von Wild- und Primitivformen als Kreuzungspartner (Salomon-Blackburn & Barker, 2001b). Diese Genquellen mit Eigenschaften, die im bisherigen Kulturkartoffelsortiment fehlen oder nicht ausreichend ausgeprägt sind, werden aufgrund ihrer schwierigen Handhabung zumeist in wissenschaftlichen Einrichtungen unter Anwendung verschiedener Ansätze wie In-vitro-Methoden und Genomanalysen bearbeitet (Abb. 7) und können anschließend als Prebreeding-Material in Sortenzüchtungsprogramme einfließen.

Abb. 7. In-vitro-Kultur zur Erzeugung und Erhaltung von Prebreeding-Material. Quelle: Hammann/JKI und Hartung/JKI.
Eine sehr effektive Züchtungsmethode ist die markergestützte Selektion. Mittlerweile werden immer exaktere Markersysteme etabliert, um Resistenzgene nachzuweisen und ihre Übertragung im Zuchtmaterial zu verfolgen (Del Herrera et al., 2018; Blossei et al., 2020). Beispielsweise konnte das Ry-Gen für die Ausprägung der extremen PVY Resistenz in Solanum-Wildarten und mittlerweile in zahlreichen Kartoffelsorten nachgewiesen werden (Lindner et al., 2011). In Kreuzungsnachkommenschaften aus der Wildart S. bulbocastanum mit verbesserter Krautfäuleresistenz wurden molekulare Marker für mehrere Majorgene beschrieben (Rakosy-Tican et al., 2020).
Zu den Nachweismethoden, die den Züchtungsprozess zielgerichteter und effektiver machen, zählen z. B. die genomische In-situ-Hybridisierung, mit der in Kreuzungsnachkommen einzelne Chromosomen, die entweder vom Kulturart- oder vom Wildart-Elter stammen, eindeutig erkannt werden. Damit lässt sich in Rückkreuzungen die schrittweise Reduzierung des von der Wildart stammenden Genomanteils direkt verfolgen (Gaiero et al., 2018).
Die somatische Hybridisierung ist eine biotechnologische Methode, die es erlaubt, Genomanteile von sexuell inkompatiblen Solanum-Spezies mittels Protoplastenfusion in die Kulturkartoffel zu überführen (Gavrilenko et al., 2003; Rakosy-Tican et al., 2020). Es muss jedoch der Nachweis erbracht werden, dass dieser Vorgang ebenso auf natürlich verlaufendem sexuellem Weg erfolgen kann. Andernfalls fallen die Nachkommenschaften unter das Gentechnikrecht (Messmer et al., 2012).
Im Gegensatz zur klassischen Züchtung bauen gentechnische Züchtungsmethoden auf einer zielgerichtet erzeugten Veränderung des genetischen Materials auf.
Mit Hilfe der Gentechnik können arteigene (Cis-Genese) oder artfremde Gene (Trans-Genese) mittels Vektoren oder durch physikalische Methoden in das Genom der Pflanze eingefügt werden. Darüber hinaus können Gene ausgeschaltet (RNAi-Technik) bzw. ihre Wirkung reguliert werden. Beispielsweise gibt es seit geraumer Zeit Versuche, mit Hilfe gentechnischer Verfahren mehrere rassenspezifische Rpi-Gene aus verschiedenen, nicht direkt kreuzbaren Solanum-Wildarten zu kombinieren, um auf diese Weise eine dauerhafte Phytophthora-Resistenz zu erzeugen. Hierzu sind u. a. in den USA, Deutschland und Holland Resistenzgene aus S. stoloniferum, S. bulbocastanum und S. venturii in vorhandene Sorten eingefügt worden (Haverkort et al., 2016).
Die klassische Gentechnik wird, da mit dieser Technik erzeugte Produkte entsprechend des Gentechnikgesetzes (2001) ohne Genehmigung weder freigesetzt noch vermarktet werden dürfen, in der kommerziellen Pflanzenzüchtung in der EU derzeit nicht angewendet.
Zukünftig lässt sich der Züchtungsprozess mit Methoden der Hochdurchsatz Phänotypisierung und damit einhergehender Genotypisierung über genomweite Assoziationsstudien noch effizienter gestalten. Diese Methoden ermöglichen eine weit umfangreichere Kartierung von Resistenzgenen im Vergleich zur heutigen Technik, so dass mit Methoden der genomischen Selektion die vorhandene genetische Diversität systematisch nutzbar gemacht werden kann. Zudem lassen sich gezielt Resistenzgene einlagern und pyramidisieren (Danan et al., 2011; Mosquera et al., 2016; Sharma et al., 2018; Yuan et al., 2020).
Diese Techniken ermöglichen es, gezielt Veränderungen an Pflanzengenomen durchzuführen. Derzeit werden drei verschiedene Nukleasetechniken angewendet: Zinkfinger-Nukleasen, TALEN und CRISPR/Cas (Hartung et al., 2017). Bei den Methoden zerschneidet das eingebrachte Enzym gezielt die DNA und die Zelle hat die Fähigkeit, den Schnitt zu reparieren. Dabei werden je nach Verfahren punktgenau kleine Modifikationen erzeugt (vergleichbar mit natürlich vorkommenden Mutationen), oder es können ganze Genabschnitte fremder Organismen eingebaut werden. Von den Nuklease-Techniken hat sich CRISPR/Cas auf Grund seiner einfachen Herstellung und Applikation als die effizienteste Technik durchgesetzt (Abb. 8). Ein Vorteil bei dieser Methode ist zudem, dass mithilfe einer RNA die Zielsequenz zum Schneiden erkannt wird. In den 6–8 Jahren seit Bekanntwerden der Technik für die Anwendung in Eukaryonten hat sich CRISPR/Cas weltweit als Instrument verbreitet und wird in vielen Laboren unter anderem auch in der Züchtungsforschung eingesetzt.
Ein aktuelles Beispiel für die Anwendung von CRISPR/Cas in der Forschung ist das Verbundprojekt ’ADLATUS’ unter Beteiligung des JKI zur Erstellung neuer und zur Verstärkung bestehender Abwehrmechanismen der Kartoffel gegen die Schaderreger Meloidogyne chitwoodi, PLRV, PVY und TRV (BMEL, 2020b).
Über Züchtungserfolge bezüglich Virus-Resistenzen berichten Zhang et al. (2019), die im Rahmen einer chinesisch-deutschen Forschungskooperation mittels CRISPR/Cas13a PVY-Infektionen in Kartoffeln verhindern konnten. Makhotenko et al. (2019) haben am Resistenzmechanismus der Pflanzenzelle gegen abiotischen und biotischen Stress gearbeitet. Mittels CRISPR/Cas9 konnte ein Allel erzeugt werden, das Resistenz gegen PVY-Infektionen verursacht.
Der Europäische Gerichtshofs hat in seinem Urteil vom 25. Juli 2018 den Regelungsstatus von aus Mutagenese-Techniken gewonnenen Organismen entsprechend der Freisetzungsrichtlinie 2001/18/EG interpretiert. So sind demnach alle durch Mutageneseverfahren erzeugten Organismen als gentechnisch veränderte Organismen (GVO) anzusehen (Urteil Rechtssache C-528/16). Dies bedeutet, dass auch Pflanzen, die mit Hilfe bestimmter Genom-Editierungsverfahren gewonnen bzw. gezüchtet werden, allen Vorschriften für GVO unterliegen (Griebsch, 2018).
Aktuell diskutiert die EU diese neuen Züchtungsmethoden mit den Mitgliedsstaaten. Das Ergebnis soll im April 2021 vorliegen und als neue Diskussionsgrundlage für Regulierung, Forschung und Politik zur möglichen Anpassung des Rechtsrahmens dienen (Jülicher et al., 2020).
In Zukunft werden klassische Züchtungsmethoden möglicherweise durch Methoden der Genomeditierung, der Hochdurchsatz Phänotypisierung oder weiterer Methoden ergänzt werden können, um den Züchtungsprozess zu beschleunigen und um wertvolle Eigenschaften wie beispielsweise Resistenzgene gegen die verschiedensten Stressfaktoren in die Kulturkartoffel einzubringen, was auf konventionellem Weg nicht oder nur sehr aufwändig möglich wäre. Dennoch werden klassische Züchtungsmethoden auch in Zukunft von erheblicher Bedeutung sein. Gerade in klassischen Anbauversuchen unter den verschiedensten Umweltbedingungen werden große Datenmengen generiert, die einer intensiven Auswertung bedürfen, um optimal angepasste, gesunde und nachhaltig produzierte Nahrungsmittel zu erzeugen.
Für die freundliche Unterstützung beim Zustandekommen dieser Publikation gilt unser Dank Frau Dr. B. Schöber-Butin, Frau U. Buchta, Herrn Dr. H.L. Weidemann und Herrn Dr. U. Darsow.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Becker, H., 2011: Pflanzenzüchtung. Stuttgart, Verlag Eugen Ulmer, 368 S.
Black, W., 1954: Late blight resistance work in Scotland. American Potato Journal 31, 93-100.
Blossei, J., M. Sprengel, T. Hammann, 2020: Pre-breeding bei der Kartoffel (Solanum tuberosum) zur Verbesserung der Resistenz gegen Phytophthora infestans. Journal für Kulturpflanzen 72, 577-585, DOI: 10.5073/JfK.2020.12.03.
BMEL, 2020a: Diskussionspapier: Ackerbaustrategie 2035 – Perspektiven für einen produktiven und vielfältigen Pflanzenbau. Bundesministerium für Ernährung und Landwirtschaft, Referat 711, Broschüre, 67 S.
BMEL, 2020b: Widerstandsfähige Kulturpflanzen: Ernährung sichern, Ressourcen schützen. Pressemitteilung Nr. 236/2020. URL: https://www.bmel.de/SharedDocs/Pressemitteilungen/DE/2020/236-widerstandsfaehige-kulturpflanzen.html.
Bode, O., H.L. Paul, 1956: Elektronenmikroskopische Untersuchungen über Kartoffel-Viren. III. Vermessungen an Teilchen des Kartoffel-Y-Virus. Phytopathologische Zeitschrift 27, 107-112.
Bourke, A., 1993: The Visitation of God? - The Potato and the Great Irish Famine. Lilliput Press Ltd. Dublin, Ireland.
Bradshaw, J.E., R.L. Wastie, H.E. Stewart, G.R. Mackay, 1995: Breeding for resistance to late blight in Scotland. In: Phytophthora infestans. Dowley, L.J., E. Bannon, L.R. Cooke, T. Keane, E. O’Sullivan (Eds.), Dublin, Ireland, Boole Press, 246-253.
Brammeier, H., H. Beer, F. Klingauf, 2001: Biologische Bundesanstalt für Land-und Forstwirtschaft: Pflanzenschutz, Umweltschutz, Verbraucherschutz im Spiegel der BBA-Arbeiten und jüngsten Regierungserklärungen. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 53, 120- 127.
Brown, C.R., P.E. Thomas, 1994: Resistance to potato leafroll virus derived from Solanum chacoense, characterization and inheritance. Euphytica 74, 51-57.
BSA, 2019a: Richtlinien für die Durchführung von landwirtschaftlichen Wertprüfungen und Sortenversuchen, 4.3.6.7 Krautfäule, Bundessortenamt Hannover.
BSA, 2019b: Richtlinien für die Durchführung von landwirtschaftlichen Wertprüfungen und Sortenversuchen, 4.3.6.5 Viruskrankheiten, Bundessortenamt Hannover.
Casper, R., S. Meyer, 1981: Die Anwendung des ELISA-Verfahrens zum Nachweis pflanzenpathogener Viren. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 33, 49-54.
Chaves, R., C.R. Brown, M. Iwanaga, 1988: Transfer of resistance to PLRV titer buildup from Solanum etuberosum to a tuber-bearing Solanum gene pool. Theoretical and Applied Genetics 76, 497-500, DOI: 10.1007/BF00288843.
Cockerham, G., 1970: Genetical studies on resistance to potato viruses X and Y. Heredity 25, 309-348.
Danan, S., J.B. Veyrieras, V. Lefebvre, 2011: Construction of a potato consensus map and QTL meta-analysis offer new insights into the genetic architecture of late blight resistance and plant maturity traits. BMC Plant Biology 11, 1–16, DOI: 10.1186/1471-2229-11-16.
Darsow, U., 2000: 50 Jahre Züchtungsforschung zu Phytophthora infestans bei Kartoffeln in Groß Lüsewitz. Bundesanstalt für Züchtungsforschung, Quedlinburg, Beiträge zur Züchtungsforschung 6, 49 S.
Darsow, U., 2014: Pre-breeding and breeding of potatoes for quantitative Resistance to Phytophthora infestans on foliage and tubers and for different utilization – problems, solutions and results. Quedlinburg, Julius–Kühn–Archiv 441, 312 S.
Davidson, T.M.W., 1980: Breeding for resistance to virus disease of the potato (Solanum tuberosum) at the Scottish Plant Breeding Station. In: Scottish Plant Breeding Station 59th Annual Report, 100-108.
Dowley, L.J., 1995: Research on Phytophthora infestans in Ireland: A short historical view. In: Phytophthora infestans. Dowley, L.J., E. Bannon, L.R. Cooke, T. Keane, E. O’Sullivan (Eds.), Dublin, Ireland, Boole Press, 12-29.
EPPO, 2012: Efficacy evaluation of plant protection products; PP 1/152(4) Design and analysis of efficacy evaluation trials. Bulletin OEPP/EPPO Bulletin 42, 367-381.
EPPO, 2020: Efficacy evaluation of fungicides, PP 1/002 (5) Phytophthora infestans in potato. Bulletin OEPP/EPPO Bulletin 0, 1-4.
Flier, W.G., G.B.M. van den Bosch, L.J. Turkensteen, 2003: Stability of partial resistance in potato cultivars exposed to aggressive strains of Phytophthora infestans. Plant Pathology 52 (3), 326–337, DOI: 10.1046/j.1365-3059.2003.00862.x.
Franco-Lara, L., H. Barker, 1999: Characterisation of resistance to potato leafroll virus accumulation in Solanum phureja. Euphytica 108, 137-144, DOI: 10.1023/A:1003668629040.
Gaiero, P., P. Speranza, H. de Jong, 2018: Introgressive Hybridization in Potato revealed by Novel Cytogenetic and Genomic Technologies. American Journal of Potato Research 95, 607–621, DOI: 10.1007/s12230-018-9669-6.
Gavrilenko, T., R. Thieme, U. Heimbach, T. Thieme, 2003: Fertile somatic hybrids of Solanum etuberosum (+) dihaploid Solanum tuberosum and their backcrossing progenies: relationships of genome dosage with tuber development and resistance to potato virus Y. Euphytica 131, 323-332, DOI: 10.1023/A:1024041104170.
Gibson, R.W., E. Pehu, R.D. Woods, M.G.K. Jones, 1990: Resistance to potato virus Y and potato virus X in Solanum brevidens. Annals Applied Biology 116, 151-156, DOI: 10.1111/j.1744-7348.1990.tb06594.x.
Glais, L., M. Tribodet, C. Kerlan, 2002: Genomic variability in Potato potyvirus Y (PVY): evidence that PVYNW and PVYNTN variants are single to multiple recombinants between PVYO and PVYN isolates. Archiv Virology 147, 363-378, DOI: 10.1007/s705-002-8325-0.
Griebsch, T., 2018: Anwendbarkeit des Gentechnikgesetzes auf nach CRISP/Cas9 verändertes Saatgut. Natur und Recht 40, 92-100.
Hämäläinen, J.H., V. A. Watanabe, J.P.T. Valkonen, A. Arihara, R.L. Plaisted, E. Pehu, 1997: Mapping and marker-assisted selection for a gene for extreme resistance to potato virus Y. Theoretical and Applied Genetics 94, 192-197, DOI: 10.1007/s001220050399.
Hammann, T., 2013: Inwertsetzung wilder Verwandter der Kartoffel zur Entwicklung von genetisch erweitertem Keimplasma mit verbesserter Resistenz gegen die Kraut- und Knollenfäule (Phytophthora infestans). Journal für Kulturpflanzen 65, 285-292, DOI: 10.5073/JfK.2013.07.04.
Hartung, F., J. Schiemann, T. Sprink, 2017: CRISPR/Cas9 und andere Genome Editing Techniken. 2. Symposium Zierpflanzenzüchtung vom 13. bis 14. März 2017 - Proceedings. Quedlinburg, Julius-Kühn-Archiv 457, 36-39, DOI: 10.5073/jka.2017.457.006.
Haverkort, A.J., P.M. Boonekamp, R. Hutten, E. Jacobsen, L.A.P. Lotz, G.J.T. Kessel, R.G.F. Visser, E.A.G. van der Vossen, 2008: Societal costs of late blight in potato and prospects of durable resistance through cisgenetic modification. Potato Research 51, 47–57, DOI: 10.1007/s11540-008-9089-y.
Haverkort, A.J., P.C. Struik, R.G.F. Visser, E. Jacobsen, 2009: Applied Biotechnology to combat late blight caused by Phytophthora infestans. Potato Research 52, 249-264, DOI: 10.1007/s11540-009-9136-3.
Haverkort, A.J., P.M. Boonekamp, R. Hutten, E. Jacobsen, 2016: Durable late blight resistance in potato through dynamic varieties obtained by cisgenesis: scientific and societal advances in the DuRPh project. Potato Research 59, 35-66, DOI: 10.1007/s11540-015-9312-6.
Hawkes, J.G., 1990: The Potato: Evolution, Biodiversity and Genetic Resources. Belhaven Press. Oxford, U.K., 259 S.
Hinrichs-Berger, J., J. Landsmann, 2000: Zur Einstufung der Virusanfälligkeit von Kartoffeln im Rahmen der Sortenzulassung. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 52, 300-304.
Hohl, H.R., K. Iselin, 1984: Strains of Phytophthora infestans from Switzerland with A2 mating type behaviour. Transactions British Mycological Society 83, 529-530, DOI: 10.1016/S0007-1536(84)80057-1.
Hosaka, K., Y. Hosaka, M. Mori, T. Maida, H. Matsunaga, 2001: Detection of a simplex RAPD marker linked to resistance to potato virus Y in a tetraploid potato. American Potato Journal 78, 191-196, DOI: 10.1007/BF02883544.
Jansky, S., 2000: Breeding for Disease Resistance in Potato. In: Plant Breeding Reviews 19. J. Janick (Ed.), New Jersey, USA, John Wiley & Sons, 69-155.
Jeffries, C, H. Barker, S.M.P. Khurana, 2006: Viruses and Viroids In: Handbook of Potato Production, Improvement and Postharvest Management. Gopal, J., S.M.P. Khurana (Eds.), New York, USA, Food Products Press, 387-448.
Jülicher, S., U. Niggli, J. Falk, 2020: Klassische Züchtung und CRISPR/Cas in friedlicher Koexistenz? Digitale Veranstaltungsreihe „Dialog Genome Editing“, URL: https://www.bwagrar.de/Aktuelles/Klassische-Zuechtung-und-Cris.
Khurana, J., 2004: Potato viruses and their management. Diseases of Fruits and Vegetables 2, 389–440, DOI: 10.1007/1-4020-2607-2_11.
Köhler, E., 1949: Fortschritte beim Nachweis von Kartoffelvirosen mit der Testpflanzenmethode. Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz 56, 369-374.
Köhler, E., 1953: Der Solanum demissum-Bastard „A6“ als Testpflanze verschiedener Mosaikviren. Züchter 23,173-176.
Koenig, R., 1985: Antikörper im Dienste der Pflanzenvirologie. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 37, 161-170.
Landsmann, J., 2000: Kartoffelvirosen. In: Die Prüfung von Pflanzen auf ihre Widerstandsfähigkeit gegen Schadorganismen in der Biologischen Bundesanstalt, Teil 2, Resistenzprüfung von Kulturpflanzen im Acker- und Gartenbau gegen Pilze, Bakterien und Viren. Mitteilungen Biologische Bundesanstalt Land- und Forstwirtschaft. Berlin-Dahlem 373, 62-64.
Lindner, K., N. Billenkamp, 2005: Veränderungen im Stammspektrum des Kartoffelvirus Y: Eine Ursache für die Zunahme der Virusanfälligkeit von Kartoffel- und Tabaksorten? Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 57, 245-253.
Lindner, K., A. Behn, A. Schwarzfischer, Y.S. Song, 2011: Extreme Y-Resistenz im aktuellen deutschen Kartoffelsortiment. Journal für Kulturpflanzen 63, 97-103, DOI: 10.5073/JfK.2011.04.01.
Lindner, K., F. Trautwein, A. Kellermann, G. Bauch, 2015: Potato virus Y (PVY) in seed potato certification. Journal Plant Disease Protection 122, 109-119, DOI: 10.1007/BF03356539.
Lindner, K., T. Hammann, H. Lilienthal, D. Feistkorn, 2018: Erste Ergebnisse zur Prüfung der Widerstandsfähigkeit von Kartoffelsorten- und Zuchtstämmen gegen Krautfäule (Phytophthora infestans) mittels Bildanalyse im Vergleich zur Sichtbonitur. Mitteilungen der Biologischen Bundesanstalt für Land- Forstwirtschaft, Berlin- Dahlem 461, 433.
Makhotenko, A.V., A.V. Khromov, E.A. Snigir, S.S. Makarova, V.V. Makarov, T.P. Suprunova, 2019: Functional Analysis of Coilin in Virus Resistance and Stress Tolerance of Potato Solanum tuberosum using CRISPR/Cas9 Editing. Dokuments Biochemistry Biophysics 484, 88-91, DOI: 10.1134/S1607672919010241.
Marczewski, W., D. Strzelczyk-Zyta, J. Hennig, K. Witek, C. Gebhardt, 2006: Potato chromosomes IX and XI carry genes for resistance to potato virus M. Theoretical and Applied Genetics 112, 1232–1238, DOI: 10.1007/s00122-006-0224-3.
Mellor, F., 1987: Virus-free potatoes through meristem culture. Biotechnology in Agriculture and Forestry 3, 1–2, DOI: 10.1007/978-3-642-72773-3_3.
Messmer, M., K.P. Wilbois, C. Baier, F. Schäfer, C. Arncken, D. Drexler, I. Hildermann, 2012: Erzeugung von genetischer Variation. In: Techniken der Pflanzenzüchtung, FiBl, 14-18.
Mosquera, T., M.F. Alvarez, J.M. Jiménez-Gómez, M.S. Muktar, M.J. Paulo, ..., C. Gebhardt, 2016: Targeted and untargeted approaches unravel novel Candidate Genes and Diagnostic SNPs for Quantitative Resistance of the Potato (Solanum tuberosum L.) to Phytophthora infestans causing the Late Blight Disease. PLOS ONE 11 (6), e0156254, DOI: 10.1371/journal.pone.0156254.
Novy, R., A. Gillen, J. Whitworth, 2007: Characterization of the expression and inheritance of potato leafroll virus (PLRV) and potato virus Y (PVY) resistance in three generations of germplasm derived from Solanum etuberosum. Theoretical and Applied Genetics 114, 1161-1172, DOI: 10.1007/s00122-007-0508-2.
Oertel, H., P. Schuhmann, J. Weber, 1986: Institut für Kartoffelforschung Groß Lüsewitz der Akademie der Landwirtschaftswissenschaften der DDR, Groß Lüsewitz, 48 S.
Pastrik, K.-H., P. Steinbach, 2012: Beschaffenheitsprüfung auf Viruskrankheiten der Kartoffel, Teil 1: Entwicklung und Validierung der qPCR als Knollentest. Tagungsband - 58. Deutsche Pflanzenschutztagung, 10.-14. September 2012, Technische Universität Braunschweig. Julius-Kühn-Archiv 438, 227.
Rakosy-Tican, E.; R. Thieme, J. König, M. Nachtigall, T. Hammann, T.E. Denes, K. Kruppa, M. Molnar-Lang, 2020: Introgression of two broad-spectrum late blight resistance genes, Rpi-Blb1 and Rpi-Blb3, from Solanum bulbocastanum dun plus race-specific R genes into potato pre-breeding lines. Frontiers in Plant Science 11, 1-17, DOI: 10.3389/fpls.2020.00699.
Robinson, R.A., 1996: Return to Resistance. Breeding Crops to reduce Pesticide Dependence, Davis, Canada. AG Access.
Del Herrera, M.R., L.J. Vidalon, J.D. Montenegro, C. Riccio, F. Guzman, I. Bartolini, M. Ghislain, 2018: Molecular and genetic characterization of the Ryadg locus on chromosome XI from Andigena potatoes conferring extreme resistance to potato virus Y. Theoretical and Applied Genetics 131 (9), 1925–1938, DOI: 10.1007/s00122-018-3123-5.
Ross, H., 1961: Über die Vererbung von Eigenschaften für Resistenz gegen das Y- und A-virus in Solanum stoloniferum und die mögliche Bedeutung für eine allgemeine Gentetik der Virusresistenz in Solanum sect. Tuberiarium. In: Brandes, J., R. Bartels, J. Völk, C. Wetter (Eds.) Proceedings of the 4th Conference Potato Virus Diseases, Braunschweig 1060, 40-49.
Ross, H., 1986: Potato Breeding – Problems and Perspectives. Verlag Paul Parey. Berlin, Advances in Plant Breeding 13, 1-133.
Rothacker, D., 1993: Zur Geschichte und Bedeutung der Kartoffel in Europa – Ein Geschenk der neuen Welt, URL: https://www.zobodat.at/pdf/KATOOENF_0061_0213-0251.pdf.
Salaman, R.N., 1921: Degeneration of potatoes. In: Report on the International Potato Conference. London, UK, Royal Horticultural Society, 79-91.
Salomon-Blackburn, R., H. Barker, 2001a: Are view of host major-gene resistance to potato viruses X, Y, A and V in potato: genes, genetics and mapped locations. Heredity 86, 8-16, DOI: 10.1046/j.1365-2540.2001.00798.x.
Salomon-Blackburn, R., H. Barker, 2001b: Breeding virus resistant potatoes (Solanum tuberosum): a review of traditional and molecular approaches. Heredity 86, 17-35, DOI: 10.1046/j.1365-2540.2001.00799.x.
Schick, R., 1932: Über das Verhalten von Solanum demissum, Solanum tuberosum und ihren Bastarden gegenüber verschiedenen Herkünften von Phytophthora infestans. Züchter 4, 233-237.
Schöber, B., E. Höppner, 1972: Zur Methodik der Resistenzprüfung von Kartoffelknollen gegen den Erreger der Braunfäule, Phytophthora infestans (Mont.) der Bary. Potato Research 15, 378-383, DOI: 10.1007/BF02361768.
Schöber, B., 1979: Tagung der E.A.P.R. – Arbeitsgruppe „Vereinheitlichung in der Methodik der Sortenprüfung“, Wien, Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 31, 156-157.
Schöber-Butin, B., 2000: Kraut und Braunfäule. In: Die Prüfung von Pflanzen auf ihre Widerstandsfähigkeit gegen Schadorganismen in der Biologischen Bundesanstalt, Teil 2, Resistenzprüfung von Kulturpflanzen im Acker- und Gartenbau gegen Pilze, Bakterien und Viren. Mitteilungen der Biologischen Bundesanstalt für Land- und Forstwirtschaft, Berlin-Dahlem 373, 56-58.
Schöber-Butin, B., 2001: Die Kraut- und Braunfäule der Kartoffel und ihr Erreger Phytophthora infestans (Mont.) de Bary. Mitteilungen der Biologischen Bundesanstalt für Land- und Forstwirtschaft, Berlin-Dahlem 384, 64 S.
Sharma, S.K., K. MacKenzie, K. McLean, F. Dale, S. Daniels, G.J. Bryan, 2018: Linkage Disequilibrium and evaluation of Genome-Wide Association Mapping Models in tetraploid potato. G3-Genes Genomes Genetics 8, 3185-3202, DOI: 10.1534/g3.118.200377.
Sucker, U., 1998: Die Biologische Reichsanstalt für Land- und Forstwirtschaft und die Entstehungsgeschichte eines reichseinheitlichen „Pflanzenschutzgesetzes“ (1914 bis 1937). Mitteilungen der Biologischen Bundesanstalt für Land- und Forstwirtschaft, Berlin-Dahlem 352, 229 S.
Thiel, W., P. Steinbach, 2018: Selektion in Pflanzkartoffeln – Erkennen und Bereinigen von Fremdbesatz und vermehrungsrelevanten Krankheiten, Clenze, Deutschland, Agrimedia Verlag, 280 S.
Ullrich, J., 1965: Die Überempfindlichkeitsresistenz von 15 deutschen Kartoffelsorten gegenüber dem Erreger der Kraut- und Braunfäule, (Phytophthora infestans) (Mont.) de Bary. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 17, 36-40.
Ullrich, J., 1967: Die Braunfäule der Kartoffel (Phytophthora infestans (Mont.) de Bary). Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 19, 55-59.
Umaerus, V., M. Umaerus, L. Erjefalt, B.A. Nilsson, 1983: Phytophthora, its Biology, Taxonomy, Ecology and Pathology. St. Paul, USA, The American Phytopathological Society.
Van der Plank, J.E., 1966: Horizontal (polygenic) and vertical (oligogenic) resistance against blight. American Potato Journal 43, 43-52, DOI: 10.1007/BF02871406.
Weidemann, H.L., 1984: Die Kartoffel-Virus-Y(PVYN)-Konzentration in Knollen verschiedener Kartoffelsorten. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 36, 25-27.
Yuan, J., B. Bizimungu, D. De Koeyer, U. Rosyara, Z. Wen, M. Lagüe, 2020: Genome-Wide Association Study of Resistance to Potato Common Scab. Potato Research 63, 253–266, DOI: 10.1007/s11540-019-09437-w.
Zhang, X., F. Zhang, Z. Zhong, C. Ruhao, Y. Wang, L. Chang, R. Bock, B. Nie, J. Zhang, J., 2019: Generation of virus-resistant potato plants by RNA genome targeting. Plant Biotechnology Journal 17, 1814–1822, DOI: 10.1111/pbi.13102.
Zhu, S., Y. Li, J.H. Vossen, R.G.F. Visser, E. Jacobsen, 2012: Functional stacking of three resistance genes against Phytophthora infestans in potato. Transgenic Research 21, 88-99, DOI: 10.1007/s11248-011-9510-1.