

Eine Zeitreise durch die Nematologie in Deutschland – Von den Anfängen bis zur Nutzung künstlicher Intelligenz
A time travel through nematology in Germany – From the beginnings to the use of artificial intelligence
Journal für Kulturpflanzen, 73 (7-8). S. 243–251, 2021, ISSN 1867-0911, DOI: 10.5073/JfK.2021.07-08.08, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Das Nachrichtenblatt für den Deutschen Pflanzenschutzdienst, unser heutiges Journal für Kulturpflanzen, feiert seinen 100. Geburtstag. Seinem Ziel, „den im praktischen Pflanzenschutzdienst Tätigen Belehrung und Informationen (zu) übermitteln“, wie Otto Appel zur Einführung schrieb, ist es bis heute treu geblieben. Dies gilt auch für den Bereich der Nematologie. Die Themen haben sich dabei über die Zeit weiterentwickelt. Standen früher Biologie und Wirtspflanzenspektrum einzelner Arten pflanzenparasitärer Nematoden im Fokus des Interesses, so sind es heute Wirt-Parasit Interaktionen, Resistenz und Toleranz von Kulturpflanzen oder der Einfluss von Klimawandel und Globalisierung auf die Verbreitung und das Schadpotenzial der Nematoden. Der vorliegende Beitrag blickt zurück auf die Themen vor 100 Jahren, stellt am Beispiel laufender Arbeiten am Julius Kühn-Institut aktuelle Forschungsthemen vor und gibt einen Ausblick auf die Themen der Zukunft.
Stichwörter: Rübenzystennematode, Heterodera schachtii, Phytobiom, Nematodenresistenz, Bioindikatoren, Digitalisierung
The Nachrichtenblatt für den Deutschen Pflanzenschutzdienst, today's Journal of Cultivated Plants, celebrates its 100th birthday. It has remained true to its goal of “providing instruction and information to those involved in the practical plant protection service” to this day as stated in its first issue by Otto Appel. This also applies to the field of nematology. The topics have expanded over time and developed further on an international level. While the main focus was initially on the biology and host plant spectrum of the various nematode species, today it is on host-parasite interactions, resistance and tolerance of cultivated plants and the influence of climate change and globalization on the distribution and harmful effects of nematodes. The present article looks back at the topics 100 years ago, presents current research topics using the example of ongoing work at the Julius Kühn Institute and provides an outlook on the topics of the future.
Key words: Beet cyst nematode, Heterodera schachtii, phytobiome, nematode resistance, bioindicators, digitalization
Vor 100 Jahren erschien die erste Ausgabe des Nachrichtenblatt für den Deutschen Pflanzenschutzdienst, der Vorgängerzeitschrift unseres heutigen Journal für Kulturpflanzen. Was waren die Themen in der damaligen Zeit, was sind sie heute und was werden sie in Zukunft sein? Für den Bereich Nematologie soll dies im Folgenden dargestellt werden. Aufgrund der Vielfalt an Themen kann dies nur anhand von einigen Beispielen erfolgen. So haben die Autoren vor allem Themen aufgegriffen, die am Julius Kühn-Institut schwerpunktmäßig bearbeitet werden, wohl wissend, dass nematologische Forschung im deutschsprachigen Raum, dem Verbreitungsgebiet des Journal für Kulturpflanzen, natürlich an vielen weiteren Forschungsinstitutionen von Bund, Ländern und Unternehmen betrieben wird und nematologische Entwicklungen niemals nur eine bestimmte Region betreffen, sondern immer national bzw. international zu betrachten sind.
Die erste Erwähnung pflanzenparasitärer Nematoden im Nachrichtenblatt für den Deutschen Pflanzenschutzdienst findet sich im Jahr 1922 und zwar in der 7. Ausgabe des 2. Jahrgangs. Hier verweist Wilke auf Arbeiten von Thorne und Hiddings zum Rübenzystennematoden Heterodera schachtii im Westen der USA (Wilke, 1922). Dieser Nematode wurde übrigens vor genau 150 Jahren im Jahr 1871 von Adolf Schmidt aus Aschersleben beschrieben und nach seinem Entdecker Hermann Schacht benannt (Hallmann et al., 2009). Es war seinerzeit die fünfte Beschreibung eines pflanzenparasitären Nematoden überhaupt und die erste Beschreibung eines Nematoden an unterirdischen Pflanzenorganen. In dem Beitrag von Wilke (1922) wird darauf hingewiesen, dass H. schachtii in den USA erstmals Anfang des 20. Jahrhunderts im Zuckerrübenanbau nachgewiesen wurde. In kürzester Zeit verbreitete er sich in den Hauptanbaugebieten der Zuckerrübe in Idaho, Utah, Kalifornien und Colorado. Da die infizierten Flächen in der Regel weit voneinander entfernt lagen, wurde vermutet, dass die Einschleppung über kontaminiertes Saatgut erfolgte. Saatgut kam seinerzeit vor allem aus Europa und war häufig mit Erden, die Zysten enthalten konnten, kontaminiert. Heute gehen wir davon aus, dass über eine sorgfältige Saatgutreinigung in Verbindung mit Quarantänemaßnahmen eine solche Einschleppung hätte verhindert werden können. Dies wiederum unterstreicht anschaulich, wie wichtig eine konsequente Umsetzung phytosanitärer Maßnahmen für den Schutz von Kulturpflanzen vor neuen Schaderregern ist. Einmal eingeschleppt, erfolgte die weitere Ausbreitung von H. schachtii in den USA durch den Transport von Erdpartikeln während und nach der Bodenbearbeitung. Weiter heißt es in diesem Beitrag, dass Thorne und Hiddings den Nematoden in bis zu 76 cm Tiefe nachweisen konnten. Aufgrund des Auftretens von H. schachtii in solch großer Tiefe schlussfolgerten die Autoren, dass eine Bekämpfung mit Kalk oder anderen Chemikalien keinen Sinn mache und man sich ganz auf eine geregelte Fruchtfolge konzentrieren sollte. Laut den Autoren werden Weizen, Hafer, Gerste, Mais, Kartoffeln, Erbsen, Bohnen, Luzerne und Klee von H. schachtii verschont, wohingegen Kohl, Blumenkohl, Rübsen, Speiserüben, Mangold sowie Unkräuter wie Senf, Amarant, Knöterich und Portulak befallen werden und somit von Befallsflächen fernzuhalten sind.
Das Wirtspflanzenspektrum von H. schachtii ist auch das Thema einer Pressenotiz der Biologischen Reichsanstalt im Nachrichtenblatt Nr. 8 des darauffolgenden Jahres (Anonym, 1923). Hier wird das Flugblatt Nr. 11 der Biologischen Reichsanstalt zur Bekämpfung der Rübenmüdigkeit vorgestellt. Als Wirtspflanzen für H. schachtii werden neben Zuckerrübe auch Runkelrüben, Raps, Kohl, Hafer, Roggen, Weizen, Erbsen, Wicken, Pferdebohnen und Kartoffeln genannt. Diese Ausführungen belegen, dass man seinerzeit noch nicht zwischen den verschiedenen Heterodera-Arten differenzieren konnte und man bei den Untersuchungen zum Wirtspflanzenspektrum unwissend mit einer Mischung verschiedener Heterodera-Arten arbeitete. Da H. schachtii hauptsächlich Pflanzen aus den Familien Brassicaceae und Amaranthaceae (inklusive Gänsefußgewächse = Chenopodiaceae) befällt, nicht aber Getreide, Leguminosen oder Kartoffel, lässt das zuvor genannte Wirtspflanzenspektrum vermuten, dass die Böden neben H. schachtii zumindest auch H. avenae (an Getreide), H. goettingiana (an Leguminosen) sowie Globodera rostochiensis (an Kartoffel) enthielten. Unklar ist, ob die Liste der Wirtspflanzen auf eigenen Untersuchungen der Biologischen Reichsanstalt beruhte oder ob man sich hier der sehr ausführlichen Liste von Wirtspflanzen von Julius Kühn bediente, die dieser 40 Jahre zuvor zusammengestellt hatte (Kühn, 1881). Julius Kühn untersuchte seinerzeit 180 Kulturpflanzen und Unkräuter aus 35 Familien auf deren Wirtseignung für H. schachtii. Als Wirtspflanze für H. schachtii führte auch Julius Kühn irrtümlich Getreidearten und Leguminosen auf, was nur durch die Verwendung kontaminierter Erden zu erklären ist.
Im 3. Jahrgang des Nachrichtenblatt des Deutschen Pflanzenschutzdienstes wird auf eine der bedeutendsten nematologischen Arbeiten der damaligen Zeit verwiesen. Es handelt sich um die von Dr. Walter Baunacke durchgeführten „Untersuchungen zur Biologie und Bekämpfung des Rübennematoden Heterodera schachtii Schmidt“, erschienen in Arbeiten aus der Biologischen Reichsanstalt für Land- und Forstwirtschaft, Band 11, Seiten 185–288 (Molz, 1923). Erstmals wird hier auf die Bedeutung des Schlupfreizes der Wirtspflanze für die Aktivierung der juvenilen Tiere in den Zysten verwiesen. Laut Baunacke ist die Aktivierung der Tiere Voraussetzung für den Erfolg einer jeden Bekämpfungsmaßnahme, denn nur wenn die Tiere den Schutz der Zyste verlassen haben, können sie über Maßnahmen wie Nichtwirtspflanzen, resistente Sorten oder Pflanzenschutzmittel unterdrückt werden. Weiterhin untersuchte Baunacke die Fortbewegung der Tiere im Boden. Durch Darbietung von Wirtspflanzen in räumlicher Entfernung von H. schachtii konnte Baunacke zeigen, dass die juvenilen Tiere in der Lage waren, bis zu 2,4 m in horizontaler und 1,0 m in vertikaler Richtung zu wandern, bevor sie in die Wurzel eindrangen.
Wie diese Arbeiten eindrucksvoll belegen, dominierte der Rübenzystennematode H. schachtii bereits vor 100 Jahren die nematologische Forschung. Das eigentlich erstaunliche dabei ist, dass er weiterhin Bestandteil zentraler Forschungsfragen ist, auch wenn diese über die Jahrzehnte hinweg vielfältiger geworden sind und man tiefer in die Grundlagen eingetaucht ist. Dabei finden sich im Nachrichtenblatt des Deutschen Pflanzenschutzdienstes vor allem angewandte Themen, wie zur Wirkung resistenter Zwischenfrüchte (z. B. Ölrettich, Senf) (Steudel & Müller, 1981; Steudel et al., 1989), resistenter und/oder toleranter Zuckerrüben (Kenter et al., 2014) oder aber einer Monokultur von Zuckerrüben (Thielemann & Steudel, 1970) auf die Abundanzdynamik von H. schachtii. Gleich eine ganze Serie von Veröffentlichungen widmete sich der Optimierung von Methoden zur Erfassung von Zystennematoden in Bodenproben und lieferte damit den Grundbaustein für eine bessere Standardisierung dieser Verfahren (Müller, 1980, 1983 a-c). Gerne wurde das Nachrichtenblatt auch immer wieder für die Präsentation nematologischer Jubiläen genutzt, um so an wegweisende Arbeiten zu erinnern und aufzuzeigen, wie diese Arbeiten unseren heutigen Wissensstand beeinflusst haben (Sturhan, 2008; Hallmann et al., 2009). Andere Themen zu H. schachtii, wie die grundlegenden Arbeiten von Florian Grundler und Mitarbeitern (Universität Bonn) zu den molekularen Mechanismen der Entwicklung von H. schachtii sowie der Nährstoffaufnahme der Nematoden (Anjam et al., 2020; Siddique & Grundler, 2018) oder Arbeiten zur molekularen Charakterisierung verschiedener Populationen von H. schachtii (Nuaima et al., 2020) finden sich dagegen in internationalen Journalen. Auch 150 Jahre nach Beschreibung dieses Nematoden ist eines sicher: Aufgrund der wirtschaftlichen Bedeutung von Zuckerrüben als Zuckerpflanze und der enormen Schadwirkung von H. schachtii wird uns dieser Nematode auch in Zukunft intensiv fordern, in der Praxis, wie auch in der Forschung.
Verglichen mit der Zeit von vor 100 Jahren hat sich die nematologische Forschung deutlich in die Breite entwickelt, sei es im Bereich der Biologie der Tiere, der Grundlagen von Wirt-Parasit-Interaktionen bis hin zu Fruchtfolgemaßnahmen und chemischen bzw. biologischen Bekämpfungsverfahren. Langfristiges Ziel all dieser Forschungsaktivitäten ist die Entwicklung zuverlässiger und möglichst nachhaltiger Verfahren zum Schutz unserer Kulturpflanzen vor Nematodenbefall (Sikora & Roberts, 2018). Die großen gesellschaftlichen Themen wie Globalisierung, Klimawandel, Nachhaltigkeit, Biodiversität und Digitalisierung prägen dabei die nematologische Forschung. Im Rahmen dieses Beitrages können wir nur auf einige ausgewählte Arbeiten näher eingehen und möchten dies anhand einiger aktueller Forschungsarbeiten am Julius Kühn-Institut tun. Zu Nematoden in einer globalen Welt, ihrer Diagnose, Kultivierung und Bekämpfung, wurde erst kürzlich anlässlich des Jahres der Pflanzengesundheit ausführlich im Journal für Kulturpflanzen berichtet (Berger et al., 2020; Douanla-Meli et al., 2020; Hoppe et al., 2020), so dass diese Aspekte hier nicht weiter vertieft werden.
Durch ihre zentrale Position im Bodennahrungsnetz fungieren Nematoden als Indikatoren für Bodenabbauprozesse, Bodengesundheit sowie Bodenfruchtbarkeit von Agrarökosystemen (Ferris et al., 2001). Die fünf trophischen Nematodengruppen (herbivore, bakterivore, fungivore, omnivore und karnivore Nematoden) reagieren unterschiedlich sensibel auf individuelle Agrarmanagementmaßnahmen wie (Grün-)Düngung, Pflanzenschutz oder Bodenbearbeitung (Neher et al., 2019). Durch einen Vergleich der Häufigkeit von Vertretern der verschiedenen trophischen Gruppen können Indices berechnet werden, die eine ökologische Bewertung der jeweiligen Maßnahmen ermöglicht. In Ackerböden sind insbesondere bakterivore, fungivore und herbivore Nematoden vertreten, wohingegen omnivore und karnivore Arten durch Bodenbearbeitung, intensive Düngung oder den ständig wechselnden Umweltbedingungen in annuellen Ackerbausystemen stark beeinträchtigt werden. Ein weiterer Ansatz ist die Nutzung von Nematodenindices als Indikator für Nährstoffverfügbarkeit. Bakterivore Nematoden nehmen proportional mit der Verfügbarkeit von Bakterien als Nahrungsgrundlage zu. Durch das höhere C/N-Verhältnis der bakterivoren Nematoden (10:1) im Vergleich zu Bakterien (6:1) wird ein Großteil des mit der Nahrung aufgenommenen bakteriellen Stickstoffs von den Nematoden nicht benötigt und als pflanzenverfügbares Ammonium ausgeschieden (Freckman, 1988). Ein Anstieg der bakterivoren Nematoden sollte somit zu einem Anstieg des frei verfügbaren Stickstoffs im Boden und demnach zu einem verbesserten Pflanzenwachstum bzw. einer erhöhten Bodenfruchtbarkeit führen. Dies zeigte sich so auch in einer Studie des Julius Kühn-Institutes mit der Universität Kassel, in der der Ausgangsbesatz mit bakterivoren Nematoden im Boden mit der Biomasseproduktion von Felderbsen positiv korrelierte (Abb. 1). Allgemein sind die freilebenden Nematoden neben der organischen Bodensubstanz eine wichtige Senke für Stickstoff und andere Nährstoffe. Diese Senke kann durch nachhaltige Bewirtschaftung (ganzjährige Bodenbedeckung, reduzierte Bodenbearbeitung, organische Düngung/Mulch) aktiv gefördert werden (Schmidt et al., 2020) und führt so zu einer verbesserten Nährstofffreisetzung während der Vegetationsperiode. Möglicherweise eigenen sich Nematoden darüber hinaus auch als Indikatoren für Bodensuppressivität. Aktuelle Untersuchungen lassen vermuten, dass hier vor allem bestimmte Arten fungivorer Nematoden von Bedeutung sind. Ein besseres Verständnis der Funktionen verschiedener trophischer Gruppen von Nematoden im Boden in Bezug auf Bodengesundheit, Bodenfruchtbarkeit und Bodenqualität könnte in Zukunft eine holistischere Bewertung der Güte von (Agrar-) Ökosystemen ermöglichen. Wer also den Erfolg von Agrarmaßnahmen in Bezug auf eine nachhaltigere Landnutzung evaluieren möchte, kommt um eine Analyse der Nematodenfauna als wichtige Bioindikatoren im Boden nicht herum.
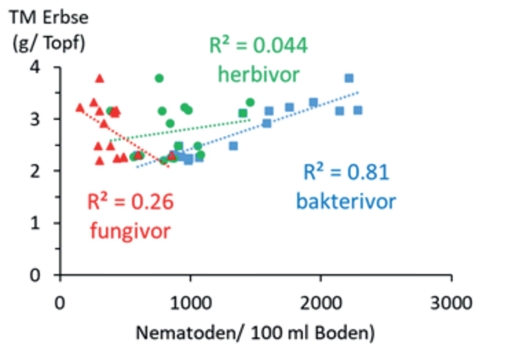
Abb. 1. Trockenmasse (TM) der Erbsen nach 12-wöchigem Wuchs in Abhängigkeit der Besatzdichte des Bodens (vor Aussaat) mit bakteriovoren, herbivoren und fungivoren Nematoden. Daten aus Schmidt et al. (2020).
Das Phytobiom umfasst die Pflanze mit all ihren mikroskopisch kleinen Mitbewohnern in der Pflanze selbst, auf ihren ober- und unterirdischen Außenflächen sowie im wurzelnahen Boden, der sogenannten Rhizosphäre. Die zunehmende Verwendung dieses Begriffs trägt der Erkenntnis Rechnung, dass die Pflanze mit ihren Symbionten ein selbstorganisierendes System bildet, das für Nährstoffversorgung, Wachstum und Abwehr von Schaderregern wichtig ist. Im Agrarökosystem kann die Nutzung der Systemleistungen des Phytobioms zur nachhaltigen Stabilität des Ertrags der Kulturpflanze entscheidend beitragen. Eine Arbeitsgruppe am JKI befasst sich mit den Interaktionen zwischen Mikroorganismen, Kulturpflanze und Nematoden in der Rhizosphäre mit dem Ziel, Schäden durch Nematoden zu verringern. Endoparasitäre Nematoden müssen durch die Rhizosphäre wandern, bevor sie in die Wurzel einer Wirtspflanze eindringen, um sich dort zu vermehren. Damit sind sie einer Vielzahl unterschiedlicher Bakterien- und Pilzarten konfrontiert, von denen sich einige an die Kutikula der Nematoden anheften und in der Folge deren Eindringung in die Wurzel und Vermehrung reduzieren (Abb. 2) (Adam et al., 2014b; Elhady et al., 2017; Topalović et al., 2020b). Je nach Suppressivität des Bodens wurden Vermehrungsraten beobachtet, die um eine Zehnerpotenz geringer waren als in der sterilen Kontrolle. Bei der antagonistischen Wirkung der Mikroorganismen gegen die Nematoden spielen nicht nur direkte Effekte eine Rolle (Topalović et al., 2019), sondern vor allem die Induktion der pflanzlichen Abwehr (Adam et al., 2014a; Topalović et al., 2020a). Sedentär-endoparasitische Nematoden etablieren sich in der Wurzel, indem sie sich tarnen und lokal die Immunabwehr der Pflanze manipulieren. Bestimmte an der Kutikula der eindringenden Nematoden anhaftende Bakterien aus der Rhizosphäre können eine systemische Immunantwort der Pflanze auslösen und dadurch die Nematoden in der Wurzel bekämpfen (Topalović et al., 2020a).

Abb. 2. An der Kutikula von Meloidogyne hapla Juvenilen haftende Bakterien der Gattung Microbacterium, aufgenommen mit einem Rasterelekronenmikroskop (ESEM). Foto: Katja Richert-Pöggeler, JKI.
Um das Potential des Phytobioms besser zu nutzen, kann es über die Kulturpflanze oder seitens des assoziierten (Mikro-)Bioms beeinflusst werden. Sorten könnten hinsichtlich ihres Pflanze-Boden-Feedbacks verbessert werden. Das Biom kann durch Zugabe förderlicher Mikroorganismen, organische Zusätze oder den Anbau von Vor- und Zwischenfrüchten gestärkt werden. Exemplarisch konnte durch Studien am JKI gezeigt werden, dass die Kulturpflanze sich ein eigenes Mikrobiom in der Rhizosphäre anreichert, das sie besser vor Nematoden schützt als das Mikrobiom fremder Pflanzen (Elhady et al., 2018). Interessanterweise können bestimmte Vorfrüchte das Mikrobiom auch suppressiver machen, so zum Beispiel Mais vor Soja.
Oft sind bodenbürtige Schaderreger besonders ertragsmindernd in Komplexen mit anderen Arten. Ein Beispiel ist die langzeitige Nachbaukrankheit bei Apfel, bei der freilebende Nematoden zusammen mit assoziierten Pilzen eine Abwehrreaktion der Wurzel induzieren und diese dadurch erheblich schädigen (Kanfra et al., 2018). Hinweise auf diesen Zusammenhang lieferte die Trennung von Mikroorganismen und Nematoden aus nachbaukrankem Boden und anschließendem Biotest dieser Fraktionen an Apfelsämlingen. Die Nematoden mit den an ihnen befindlichen Mikroorganismen konnten die bekannten Symptome der Bodenmüdigkeit an Wurzeln auslösen, nicht aber die Mikroorganismen allein. Pflanzenparasitäre Nematoden waren in den untersuchten Böden nur in geringer Anzahl vorhanden und trugen nicht zu den Schäden bei.
Die Kartoffelzystennematoden Globodera pallida und G. rostochiensis können unter anderem große Schäden in der europäischen Produktion von Stärkekartoffeln verursachen. Daher unterliegen diese Nematoden entsprechenden Quarantänerichtlinien, die in der EU über Richtlinie 2007/33/EG des Rates zur Bekämpfung von Kartoffelnematoden geregelt werden. In dieser Richtlinie wird die Verwendung resistenter Kartoffelsorten ausdrücklich als wichtigste Maßnahme amtlicher Bekämpfungsprogramme genannt. Auf Flächen mit Kartoffelzystennematoden müssen Sorten mit sehr hohen Resistenzgraden Verwendung finden. Ziel dabei ist es, durch den Anbau resistenter Sorten die Nematoden einerseits zum Schlupf anzuregen, deren Vermehrung aber durch die Resistenzreaktion der Pflanze, d. h. über die Inaktivierung des für die Nahrungsaufnahme erforderlichen speziellen Nährzellensystems (Synzytium), zu unterbinden, um so die Populationsdichte der Nematoden auf einer befallenen Fläche nachhaltig zu reduzieren.
Der Anbau von Stärkekartoffeln hat sich, bedingt durch eine geringe Transportwürdigkeit der Knollen, auf Flächen in der Nähe der Stärkefabriken konzentriert. Durch zu enge Fruchtfolgen und damit verbundenem hohen Befallsdruck ergaben sich sehr hohe Populationsdichten von G. pallida, der vorherrschenden Art in diesen Anbaugebieten. Durch den gesetzlich vorgeschriebenen Anbau nematodenresistenter Kartoffelsorten ergab sich ein sehr hoher Selektionsdruck bei den vorhandenen Nematodenpopulationen, wodurch im Jahr 2014 erstmals Populationen des Pathotyps Pa3 von G. pallida beschrieben wurden, die eine veränderte Virulenz gegenüber bisher als sehr resistent eingestuften Kartoffelsorten zeigten (Niere et al., 2014). Im Jahr 2015 wurden in den Niederlanden ebenfalls Populationen mit einer veränderten Virulenz detektiert und deren Auftreten den zuständigen Behörden mitgeteilt. Zur Bekämpfung dieser Populationen stehen somit keine Sorten mehr zur Verfügung, da die bisher verwendeten Sorten mit einer überwiegend aus Solanum vernei stammenden und vom Resistenzgen GpaVvrn vermittelten Resistenz unwirksam sind (Kiewnick et al., 2018).
Ziel aktueller Forschungsarbeiten ist es daher, neue Resistenzquellen zu erschließen, um eine Bekämpfung des neuen Virulenztyps „Emsland“ zu ermöglichen. In dem Forschungsprojekt: Neue Resistenzquellen gegenüber Globodera pallida in Stärkekartoffeln „PARES“, gefördert von der Fachagentur für Nachwachsende Rohstoffe, war daher ein Hauptziel die Schaffung und Bereitstellung von innovativem Zuchtmaterial der Kartoffel mit Resistenz gegen verschiedene Virulenztypen von G. pallida.
Verschiedene Akzessionen wurden auf Resistenz gegen den neuen Virulenztyp geprüft und Material mit hohem Resistenzniveau wurde in Kreuzungen mit anfälligen Sorten genutzt, um die Grundlage für die Entwicklung molekularer Marker zu legen (Abb. 3). Diese Marker sollen mit Hilfe der ’Marker Assisted Selection‘ (MAS) die Introgression der verantwortlichen Resistenzgene in Sortenkandidaten beschleunigen. Um in diesem Projekt frühzeitig Kreuzungsnachkommen phänotypisieren zu können, wurde ein Resistenzprüfungsverfahren mit Pflanzen aus Gewebekultur erfolgreich etabliert (Mwangi et al., 2019). Mit diesem Testsystem konnten Genotypen aus Wild- und Primitivformen der Kartoffel (Solanum spp.) hinsichtlich ihrer Resistenz gegenüber verschiedenen Virulenztypen von G. pallida charakterisiert werden. Des Weiteren zeigten Untersuchungen im Rahmen des Europäischen Forschungsprojektes „PalAdapt“, dass es sich nicht um eine Einschleppung neuer virulenter Populationen, sondern um eine lokale Selektion durch den intensiven Anbau resistenter Sorten handelte. Wobei sich die Populationen des neuen Virulenztyps aus Deutschland und den Niederlanden populationsgenetisch nicht unterscheiden lassen (Grenier et al., 2020).

Abb. 3. Phänotypisierung von Kartoffelgewebekulturpflanzen in Bezug auf Resistenz gegen Globodera pallida . Foto: Sebastian Kiewnick, JKI.
Ein lang ersehntes Ziel ist das teilflächenspezifische Management eines Nematodenbefalls. Da der Aufwand für Daten aus repräsentativen Bodenproben auf großen Flächen häufig in keinem Verhältnis zum Nutzen steht, werden solche Daten oft gar nicht erst erhoben. Daher zielen aktuelle Forschungsansätze darauf ab, einen Nematodenbefall mit Hilfe verschiedener Sensortechniken (Thermografie, Chlorophyllfluoreszenz, Multi- und Hyperspektralsignaturen) aus der Ferne zu erfassen. Hierbei nutzt man physiologische Reaktionsnormen oberirdischer Pflanzenteile, die sich in Folge des Nematodenbefalls als Symptome an der Wirtspflanze zeigen (Welke, Blattverfärbung, Wassergehalt, Transpiration, Kümmerwuchs). Für H. schachtii konnten Bereiche hyperspektraler Signaturen aus der Blattreflexion von Zuckerrüben bereits beschrieben werden (Joalland et al., 2017). Aber erst die Verrechnung der Signaturen mit Hilfe eines Transformationsalgorithmus und die anschließende Analyse im komplexen, biologischen Modell bringen Schätzparameter für ertragsrelevante Populationsdichten aus dem Signal und tatsächlichen Wert für bestimmte Zeiträume in Beziehung (r2> 0,8) (Schmidt & Daub, 2015).
Für die Identifizierung von Quarantänenematoden wie Bursaphelenchus xylophilus ist es wichtig, auf unübersichtlichen und großen Arealen einen Erstbefall möglichst schnell zu erkennen. Ein möglicher Ansatz hierbei ist die Auswertung von Satellitenbildern, wie zum Beispiel der Satelliten SENTINEL-2A und 2B aus dem ESA Kopernikusprogramm mit multispektralen Sensoren und einer Auflösung von 10 m. Die durch B. xylophilus verursachte Kiefernwelke führt zur intensiven Verfärbung bis hin zum völligen Verlust von Nadeln. Mit der Berechnung verschiedener auf hyperspektralen Signaturen basierender Vegetationsindices und Abgleich der Bildbereiche mit georeferenzierten Daten können solche Befallsherde und deren Ausbreitung erfasst werden (Beck et al., 2015). Was für Bäume bereits gelingt, muss für Feldkulturen erst noch entwickelt werden, da die Auflösung der Bilddaten für kleinräumige Phänomene in Feldkulturen noch unzureichend ist. Mit kontinuierlich fortschreitender Entwicklung im Bereich der Datenverarbeitung und -speicherung ist davon auszugehen, dass die Fernerkundung zukünftig einen bedeutenden Part bei der Erfassung von Pflanzenschäden und deren Verursachern einnimmt. Ein entscheidender Vorteil von Satellitenbildern ist, dass hierbei Zeiträume ausgewählt werden können, in denen für die Symptomausprägung begünstigende Witterungsbedingungen vorherrschen.
Ein weiterer zukunftsträchtiger Anwendungsbereich der digitalen Bildauswertung besteht bei der quantitativen Phänotypisierung von Nematoden auf mikroskopischer Ebene. So wurden für Caenorhabditis elegans, einem häufig in der Biologie verwendeten bakterivoren Modellnematoden, verschiedene automatisierte Anwendungen zur Quantifizierung von Eiern und Juvenilen sowie zur Phänotypisierung von Körperdimensionen, Lebensdauer und Bewegungsaktivität entwickelt (Jung et al., 2014; Xian et al., 2013). Dies funktioniert in sauberen Nematodensuspensionen sehr gut. Bei pflanzenparasitären Nematoden, die aus Bodenextrakten gewonnen werden, sind die Suspensionen in der Regel mit hohen Anteilen organischer Restbestandteile verunreinigt. Damit Nematoden in solchen Suspensionen durch automatisierte Verfahren erkennbar sind, müssen sie durch einen Erkennungsalgorithmus von gleichzeitig auftretenden Artefakten differenziert werden können. Mit Hilfe maschineller Lernverfahren und neuronaler Netze konnten solche Erkennungsalgorithmen zum Beispiel für die Quantifizierung von angefärbten Eiern des Sojabohnenzystennematoden (Akintayo et al., 2018) und Juvenilen des Kartoffelzystennematoden, im Rahmen des PheNeSens Projektes, entwickelt werden (Chen et al., 2020). Im gleichen Projekt konnte zum ersten Mal für Zystennematoden ein einzigartiges Verfahren entwickelt werden, in dem über 70 % der Zysten auch in Aggregation und in Überlagerung mit organischem Rest erkannt und quantifiziert werden konnten (Abb. 4) (Chen et al., 2019). Solche Entwicklungen liefern wichtige Grundlagen zum Aufbau von automatisierten Hochdurchsatzverfahren in der Pflanzenzüchtung, die in Zukunft zum Beispiel für ein breit angelegtes Screening genetischer Resistenzen gegen Nematoden eigesetzt werden könnten.

Abb. 4. Annotation und Segmentierung von Zysten (grün hervorgehoben) im Bodenextrakt für die Erstellung von Trainingsdaten im PheNeSens Projekt. Foto: Matthias Daub, JKI.
Pflanzenparasitäre Nematoden werden auch in Zukunft wichtige Verursacher von Ertragsverlusten an vielen Kulturpflanzen sein. Es ist davon auszugehen, dass ihre wirtschaftliche Bedeutung infolge einseitiger Fruchtfolgen und erhöhter Anbauintensitäten eher noch zunehmen wird. Klimawandel und Globalisierung werden die negativen Auswirkungen eines Nematodenbefalls zudem weiter verstärken, da sich wärmeliebende Arten in die gemäßigten Regionen ausbreiten, vorhandene Arten stärker vermehren bzw. Arten mit dem globalen Warenhandel in bis dahin neue Gebiete verschleppt werden. Bezüglich der zukünftigen Herausforderungen in der Nematologie haben Sikora et al. (2018) die wesentlichen Aspekte umfassend erörtert, von denen einige hier nun vorgestellt werden sollen.
Ein zentraler Aspekt eines jeglichen Nematodenmanagements ist die Verhinderung der Einschleppung bzw. Verbreitung neuer oder besonders schädigender Arten. Die hierfür erforderlichen phytosanitären Maßnahmen sind kontinuierlich anzuwenden, weiter zu entwickeln und anzupassen. Haben sich die Nematoden bereits etabliert, ist der Aufbau schädigender Nematodendichten möglichst im Ansatz zu vermeiden. Dies erfordert eine frühzeitige und zuverlässige Diagnose der Nematoden, sowie ein gutes Verständnis von deren Biologie hinsichtlich Wirtspflanzenspektrum, Verschleppungswegen und Populationsdynamik. Zukünftige Fernerkundungsverfahren sollten einen Nematodenbefall frühzeitig erkennen, noch bevor er visuell sichtbar wird. So kann der Landwirt schnell reagieren und anhand der übermittelten GPS-Daten den Problembereich punktgenau beproben und eine Analyse veranlassen. Mittels molekularer Verfahren auf Basis von on-site Hybridisierungsverfahren oder multi-plex-Amplifikationen könnte ein rascher Nachweis aller in Frage kommender Nematoden durchgeführt werden. Idealerweise würde dieser Nachweis sowohl qualitativ als auch quantitativ sein. Dort, wo keine molekularen Verfahren zur Verfügung stehen, könnten bildverarbeitende Verfahren in Verbindung mit Künstlicher Intelligenz und Deep Learning zum Einsatz kommen, um Nematodeneier, lebende Tiere oder Zysten zu identifizieren und zu quantifizieren. Die so generierten Werte ließen sich in Entscheidungshilfesysteme einspeisen, die dann den Landwirten alternative Managementstrategien aufzeigen.
Maßnahmen zum Schutz der Kulturpflanze sollten zukünftig die natürlichen Schutz- bzw. Abwehrmechanismen der Pflanze besser nutzen. Verfahren zur Nutzung des Mikrobioms, zum Priming bzw. der Applikation antagonistischer Mikroorganismen sind weiter zu entwickeln und in der Praxis zu etablieren. Auch sollte das antagonistische Potenzial des Bodens bei der Bekämpfung pflanzenparasitärer Nematoden stärker als bisher Berücksichtigung finden, wie zum Beispiel durch Applikation von organischer Substanz bzw. Komposten, Anbau von Zwischen- und Unterfrüchten oder Förderung des Bodenlebens durch bodenschonende Anbauverfahren. Im Idealfall würde ein solches Vorgehen zu einem suppressiven Boden führen, in dem pflanzenparasitäre Nematoden zwar noch auftreten, aber keinen Schaden mehr verursachen. Der Grad der Suppressivität ließe sich dabei möglicherweise über die Nematodenfauna als Bioindikator erfassen und bewerten.
Mit zunehmender Aufschlüsselung der Genome von Kultur- und Wildpflanzen werden immer neue Resistenzquellen entdeckt, die für die Züchtung resistenter Sorten genutzt werden können. Durch Pyramidisierung von Resistenzen mit unterschiedlicher Wirkungsweise ließe sich die Widerstandsfähigkeit einer Pflanze gegenüber Nematoden sogar noch weiter verbessern. In Fällen, in denen klassische Züchtungsverfahren zu langwierig oder erst gar nicht möglich sind, könnten neue Züchtungsmethoden, wie das Genome Editing, zu einem besseren Schutz der Kulturpflanze vor Nematodenbefall beitragen.
Klassische Verfahren wie sauberes Pflanzgut, phytosanitäre Maßnahmen, Fruchtfolge und Anbau von Zwischenfrüchten werden auch zukünftig eine zentrale Rolle beim Nematodenmanagement einnehmen. Neue Nichtwirtspflanzen werden in ihrer Anbauwürdigkeit so verbessert werden, dass eine effiziente Bekämpfung der jeweiligen Nematoden gegeben ist. Bei Zwischenfrüchten wird die Entwicklung multiresistenter Sorten weiter fortschreiten und deren Verwendung in der Praxis zunehmen. Trotz all der hier aufgezeigten Optionen wird es aber auch in Zukunft Bekämpfungslücken geben, für die der Einsatz nematizider Wirkstoffe, sei es biologischer oder chemischer Natur, eine Lösung darstellen könnte. Letztendlich sind die vielfältigen Maßnahmen zum Nematodenmanagement noch intensiver als in der Vergangenheit mit den sonstigen agronomischen Maßnahmen zu kombinieren, um dem Ziel größtmöglicher Nachhaltigkeit gerecht zu werden.
Diesen und zahlreichen weiteren Herausforderungen sieht sich die Nematologie in Deutschland durch die Bereitstellung modernster Forschungskapazitäten und intensiver Vernetzung auf nationaler und internationaler Ebene gut gewappnet und blickt somit optimistisch in die Zukunft.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Adam, M., H. Heuer, J. Hallmann, 2014a: Bacterial antagonists of fungal pathogens also control root-knot nematodes by induced systemic resistance of tomato plants. PloS One 9, e90402, DOI: 10.1371/journal.pone.0090402.
Adam, M., A. Westphal, J. Hallmann, H. Heuer, 2014b: Specific microbial attachment to root knot nematodes in suppressive soil. Applied and Environmental Microbiology 80, 2679–2686, DOI: 10.1128/AEM.03905-13.
Akintayo, A., G.L. Tylka, A.K. Singh, B. Ganapathysubramanian, A. Singh, S. Sarkar, 2018: A deep learning framework to discern and count microscopic nematode eggs. Scientific Reports 8, 9145, DOI: 10.1038/s41598-018-27272-w.
Anonym, 1923: Pressenotizen der Biologischen Bundesanstalt. Nachrichtenblatt für den Deutschen Pflanzenschutzdienst 3, 61.
Anjam, M.S., S.J. Shah, C. Matera, E. Różańska, M. Sobczak, S. Siddique, F.M.W. Grundler, 2020: Host factors influence the sex of nematodes parasitizing roots of Arabidopsis thaliana. Plant Cell and Environment 43, 1160-1174, DOI: 10.1111/pce.13728.
Beck, P.S.A., P. Zarco-Tejada, P. Strobl, J. San Mugal, 2015: The feasibility of detecting trees affected by the Pine Wood Nematode using remote sensing. European Commission, Joint Research Centre, Institute for Environment and Sustainability, Luxenbourg, DOI: 10.2788/711975.
Berger, B., M. Becker, M. Daub, S. Steinmöller, S. König, 2020: Kartoffelzystennematoden (Globodera pallida/G. rostochiensis) und Kartoffelkrebs-Erreger (Synchytrium endobioticum) belastete Resterden – Status quo und Perspektiven effektiver Diagnosemethoden und Dekontaminationsverfahren. Journal für Kulturpflanzen 72, 431-434, DOI: 10.5073/JfK.2020.08.13.
Chen, L., M. Strauch, M. Daub, M. Jansen, H,-H. Luigs, D. Merhof, 2019: Instance segmentation of nematode cysts in microscopic images of soil samples. 41st International Engineering in Medicine and Biology Conference (EMBC 2019) (Annual international conference of the IEEE Engineering in Medicine and Biology Society), DOI: 10.1109/EMBC.2019.8856567.
Chen, L., M. Strauch, M. Daub, X. Jiang, M. Jansen, H.-G. Luigs, S. Schultz-Kuhlmann, S. Krüssel, D. Merhof, 2020: A CNN framework based on line annotations for detecting nematodes in microscopic images. In: Institute of Electrical and Electronics Engineers (Eds.): IEEE ISBI 2020: International Conference on Biomedical Imaging, April 2-7, 2020, Iowa City, Iowa, USA. Symposium proceedings, Piscataway, NJ, 508-512, DOI: 10.1109/ISBI45749.2020.9098465.
Douanla-Meli, C., E. Fornefeld, P. Baufeld, Y. Becker, K. Flath, M. Götz, C. Hoffmann, B. Hoppe, W. Jelkmann, S. König, M. Lorbeer, W. Maier, M. Maixner, E. Pfeilstetter, A. Pucher, J. Riebesehl, B.C. Schäfer, Q. Schorpp, H. Tlapák, S. Wagner, A. Wensing, H. Ziebell, K. Zikeli, F. Bittner, 2020: Diagnose von Quarantäneschadorganismen am Julius Kühn-Institut im nationalen Referenzlaboratorium für Schadorganismen der Pflanzen. Journal für Kulturpflanzen 72, 404–414, DOI: 10.5073/JfK.2020.08.11.
Elhady, A., S. Adss, J. Hallmann, H. Heuer, 2018: Rhizosphere microbiomes modulated by pre-crops assisted plants in defense against plant-parasitic nematodes. Frontiers in Microbiology 9, 2679, DOI: 10.3389/fmicb.2018.01133.
Elhady, A., A. Gine, O. Topalović, S. Jacquiod, S.J. Sørensen, F.J. Sorribbas, H. Heuer., 2017: Microbiomes associated with infective stages of root-knot and lesion nematodes in soil. PloS One 12, e0177145, DOI: 10.1371/journal.pone.0177145.
Ferris, H., T. Bongers, R.G.M. de Goede, 2001: A framework for soil food web diagnostics: extension of the nematode faunal analysis concept. Applied Soil Ecology 18, 13–29, DOI: 10.1016/S0929-1393(01)00152-4.
Freckman, D.W., 1988: Bacterivorous nematodes and organic-matter decomposition. Agric. Ecosyst. Environ., Proceedings of a Workshop on Interactions between Soil-Inhabiting Invertebrates and Microorganisms in Relation to Plant Growth 24, 195-217.
Grenier, E., S. Kiewnick, G. Smant, S. Fournet, J. Montarry, M. Holterman, J. Helder, A. Goverse, 2020: Monitoring and tackling genetic selection in the potato cyst nematode Globodera pallida. EFSA Supporting Publications 17, EN-1874, DOI: 10.2903/sp.efsa.2020.EN-1874.
Hallmann, J., M. Daub, F.M.W. Grundler, A. Westphal, 2009: 150 Jahre Heterodera schachtii: Ein Überblick der frühen Arbeiten. Journal für Kulturpflanzen 61, 429-439.
Hoppe, B., H. Braasch, S. Urban, T. Schröder, 2020: Die in vitro-Zuchten von Bursaphelenchus spp. am Referenzlaboratorium für Quarantäneschadorganismen am Julius Kühn-Institut in Braunschweig. Journal für Kulturpflanzen 72, 415-420, DOI: 10.5073/JfK.2020.08.12.
Joalland, S, C. Screpanti, F. Liebisch, H.V. Varella, A. Gaume, A. Walter, 2017: Comparison of visible imaging, thermography and spectrometry methods to evaluate the effect of Heterodera schachtii inoculation on sugar beets. Plant Methods 13, 73, DOI: 10.1186/s13007-017-0223-1.
Jung, S.K., B. Aleman-Meza, C. Riepe, W.W. Zhong, 2014: QuantWorm: A comprehensive software package for Caenorhabditis elegans phenotypic assays. Plos One 9, e84830, DOI: 10.1371/journal.pone.0084830.
Kanfra, X., B. Liu, L. Beerhues, S.J. Sørenson, H. Heuer, 2018: Free-living nematodes together with associated microbes play an essential role in apple replant disease. Frontiers in Plant Science 9, 2679, DOI: 10.3389/fpls.2018.01666.
Kenter, C., P. Lukashyk, M. Daub, E. Ladewig, 2014: Population dynamics of Heterodera schachtii Schm. and yield response of susceptible and resistant sugar beet (Beta vulgaris L.) after cultivation of susceptible and resistant oilseed radish (Raphanus sativus L.). Journal für Kulturpflanzen 66, 289–299, DOI: 10.5073/JfK.2014.09.01.
Kiewnick, S., J. Mwangi, B. Niere, M. Daub, 2018: PARES – Neue Resistenzquellen gegenüber Globodera pallida in Stärkekartoffeln. 46. Tagung des DPG Arbeitskreises Nematologie. Kurzfassungen der DPG-Arbeitskreis-Tagung Nematologie, 13/14. März 2018, 8.
Kühn, J., 1881: Die Ergebnisse zur Ermittlung der Ursache der Rübenmüdigkeit und zur Erforschung der Natur des Nematoden. Berichte aus dem Physiologischen Laboratorium der Universität Halle 3, 1-153.
Molz, E., 1923: Dr. W. Baunacke. Untersuchungen zur Biologie und Bekämpfung des Rübennematoden Heterodera schachtii Schmidt. Nachrichtenblatt des deutschen Pflanzenschutzdienstes 3, 14-15.
Müller, J., 1980: Ein verbessertes Extraktionsverfahren für Heterodera schachtii. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes. 32, 21-24.
Müller, J., 1983a: Zur Problematik der quantitativen Erfassung von Heterodera schachtii mit Hilfe von Bodenuntersuchungen. I Ermittlung des Nematodenbesatzes in Mischproben. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 35, 132-136.
Müller, J., 1983b: Zur Problematik der quantitativen Erfassung von Heterodera schachtii mit Hilfe von Bodenuntersuchungen. II Ermittlung des Nematodenbesatzes in Feldproben. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 35, 150-155.
Müller, J., 1983c: Zur Problematik der quantitativen Erfassung von Heterodera schachtii mit Hilfe von Bodenuntersuchungen. III Einfluss von Bearbeiter und Extraktionsmethodik. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 35, 168-172.
Mwangi, J.M., B. Niere, M. Daub, M.R. Finckh, S. Kiewnick, 2019: Reproduction of Globodera pallida on tissue culture-derived potato plants and their potential use in resistance screening process. Nematology 21, 613-623, DOI: 10.1163/15685411-00003239.
Neher, D.A., T. Nishanthan, Z.J. Grabau, S.Y. Chen, 2019: Crop rotation and tillage affect nematode communities more than biocides in monoculture soybean. Applied Soil Ecology 140, 89–97, DOI: 10.1016/j.apsoil.2019.03.016.
Niere, B., S. Krüssel, K. Osmers, 2014: Auftreten einer außergewöhnlich virulenten Population der Kartoffelzystennematoden. Journal für Kulturpflanzen 66: 426-427.
Nuaima, R.H., J. Roeb, J. Hallmann, M. Daub, H. Heuer, 2020: Significant genetic differences among Heterodera schachtii populations within and among sugar beet production areas. Nematology 22, 165-177, DOI: 10.1163/15685411-00003297.
Schmidt, K., M. Daub, 2015: Heterodera schachtii Populationsschätzung mit hyperspektralen Messungen: Möglichkeiten und Grenzen. Journal für Kulturpflanzen 67, 328.
Schmidt, J.H., J. Hallmann, M.R. Finckh, 2020: Bacterivorous nematodes correlate with soil fertility and improved crop production in an organic minimum tillage system. Sustainability 12, 6730, DOI: 10.3390/su12176730.
Siddique S., F.M.W. Grundler, 2018: Parasitic nematodes manipulate plant development to establish feeding sites. Current Opinion in Microbiology 46, 102–108, DOI: 10.1016/j.mib.2018.09.004.
Sikora, R.A., D. Coyne, J. Hallmann, P. Timber, 2018: Reflections and challenges: nematology in subtropical and tropical agriculture. In: Plant parasitic nematodes in subtropical and tropical agriculture, 3rd edition. Sikora, RA., D. Coyne, J. Hallmann, P. Timber (Eds.), Wallingford, UK, CABI, p. 1-19, DOI: 10.1079/9781786391247.0001.
Sikora, R.A., P.A. Roberts, 2018: Management practices: an overview of integrated nematode management technologies. In: Plant parasitic nematodes in subtropical and tropical agriculture, 3rd edition. Sikora, RA., D. Coyne, J. Hallmann, P. Timber (Eds.), Wallingford, UK, CABI, p. 795-838, DOI: 10.1079/9781786391247.0795.
Steudel, W., J. Müller, 1981: Der Einfluß resistenter Ölrettichlinien auf die Abundanzdynamik von Heterodera schachtii Schmidt. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 33, 97-103.
Steudel, W., J. Schlang, J. Müller, 1989: Untersuchungen zum Einfluß einiger Zwischenfrüchte auf die Abundanzdynamik des Rübennematoden (Heterodera schachtii Schmidt) in einer Zuckerrüben-Getreide-Fruchtfolge. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 41, 199-203.
Sturhan, D., 2008: Ein nematologisches Jubiläum: 150 Jahre Ditylenchus dipsaci (Kühn. 1857). Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 60, 261-266.
Thielemann, R., W. Steudel, 1970: Neunjährige Erfahrungen mit Monokultur von Zuckerrüben auf mit Heterodera schachtii (Schmidt) verseuchtem Boden. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 25, 145-149.
Topalović, O., A. Elhady, J. Hallmann, K.R. Richert-Pöggeler, H. Heuer, 2019: Bacteria isolated from the cuticle of plant-parasitic nematodes attached to and antagonized the root-knot nematode Meloidogyne hapla. Scientific Reports 9, 11477, DOI: 10.1038/s41598-019-47942-7.
Topalović, O., S. Bredenbruch, A.S.S. Schleker, H. Heuer, 2020a: Microbes attaching to endoparasitic phytonematodes in soil trigger plant defense upon root penetration by the nematode. Frontiers in Plant Science 11, 138, DOI: 10.3389/fpls.2020.00138.
Topalović, O., H. Heuer, A. Reineke, J. Zinkernagel, J. Hallmann, 2020b: Antagonistic role of the microbiome from a Meloidogyne hapla-suppressive soil against species of plant-parasitic nematodes with different life strategies. Nematology 22, 75–86, DOI: 10.1163/15685411-00003285.
Wilke, S., 1922: Thorne und Hiddings, Die Rübennematode (Heterodera schachtii Schmidt) in den westlichen Staaten von Amerika. Nachrichtenblatt für den deutschen Pflanzenschutzdienst 2, 58.
Xian, B., J. Shen, W.Y. Chen, N. Sun, N. Qiao, D.Q. Jiang et al., 2013: WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell 12, 398-409. DOI: 10.1111/acel.12063.