

110 Jahre Forschung für den Biologischen Pflanzenschutz – Erfolge und zukünftige Herausforderungen am Julius Kühn-Institut
110 years of research for biological control – Achievements and future challenges at the Julius Kühn-Institut
Journal für Kulturpflanzen, 73 (7-8). S. 252–260, 2021, ISSN 1867-0911, DOI: 10.5073/JfK.2021.07-08.09, Verlag Eugen Ulmer KG, Stuttgart
 | Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). This is an Open Access article distributed under the terms of the Creative Commons Attribution 4.0 International License (https://creativecommons.org/licenses/by/4.0/deed.en). |
Biologische Pflanzenschutzverfahren nutzen lebende Organismen und biologische Wirkstoffe zur Begrenzung und Bekämpfung von Schaderregerpopulationen und gelten als besonders umweltfreundlich. Im Rahmen der europäischen und nationalen Strategien zur Reduktion des chemischen Pflanzenschutzes kommt ihnen eine besondere Bedeutung zu. Erste Forschungsaktivitäten zum Einsatz von Schlupfwespen sind in Deutschland bereits seit 1911 dokumentiert. Systematische Forschungs- und Entwicklungsarbeiten wurden dann ab den 1950er Jahren am Institut für Biologischen Pflanzenschutz in Darmstadt aufgenommen und werden heute vielerorts fortgeschrieben. Vielfältige Erfolge und wiederkehrende Rückschläge kennzeichnen den langen Weg des biologischen Pflanzenschutzes von den frühen Pionierzeiten bis heute. Während bereits zahlreiche biologische Verfahren aus der heutigen Pflanzenschutzpraxis nicht mehr wegzudenken sind, wird der Pflanzenbau der Zukunft noch weitaus stärker auf biologische Pflanzenschutzverfahren setzen.
Stichwörter: Nützlinge, Mikroorganismen, Pflanzenstoffe, Biodiversität, Pestizide
Biological plant protection employs living organisms and biological ingredients to control disease agents and pest populations. They are considered as highly environmentally friendly and obtained utmost importance in recent European and national strategies to reduce the use of chemical pesticides. First research activities on the use of parasitic wasps in Germany date back to 1911. From the 1950s, further systematic research and development were carried out at the Institute for Biological Control in Darmstadt. Multiple achievements and repeated throwbacks mark the long path of biological control since these early pioneering days. Today, many biological control measures are an indispensable component in the plant protection practice. Their role in future plant production systems will be even more decisive.
Key words: Beneficials, microorganisms, botanicals, biodiversity, pesticides
Der Biologische Pflanzenschutz beruht auf der Nutzung bzw. Verwendung lebender Organismen (einschließlich Viren) sowie biologischer Wirkstoffe und Prinzipien mit dem Ziel der Verminderung der Populationsdichten oder Auswirkungen von Schadorganismen, so dass der wirtschaftliche Schaden weitgehend reduziert wird (Koch et al., 2019). Auch die Anwendung von Infochemikalien (Semiochemicals), z. B. der Einsatz von Pheromonen, wird international häufig zu biologischen Verfahren gezählt, wobei sich hierfür in Deutschland eher der Begriff des „biotechnischen Pflanzenschutzes“ durchgesetzt hat. Biologische Pflanzenschutzverfahren wirken in der Regel sehr spezifisch und gehen mit einem minimalen Eingriff in den Naturhaushalt einher. Daher sind sie wichtige Instrumente der Schaderregerkontrolle im ökologischen und im integrierten Pflanzenbau. Man unterscheidet konservierende (Schutz und Förderung von Antagonisten), klassische (dauerhafte Etablierung gebietsfremder Nützlinge) und augmentative Verfahren (Massenproduktion und Freisetzung von Mikro- und Makroorganismen), je nachdem wie diese Antagonisten für pflanzenschützerische Zwecke eingebunden oder verwendet werden (Batra, 1982; Krieg & Franz, 1989 Eilenberg et al., 2001).
In Deutschland lassen sich gezielte Forschungs- und Entwicklungsarbeiten zum biologischen Pflanzenschutz bis in die Anfänge des 20. Jahrhunderts zurückverfolgen, wobei die Arbeiten des Julius Kühn-Instituts (JKI) (seit 2008) und seiner Vorgängerinstitutionen, der Biologischen Bundesanstalt für Land- und Forstwirtschaft (BBA) (seit 1950) bzw. der Biologische Zentralanstalten für Land- und Forstwirtschaft“ (BZA) (seit 1949) in der ehemaligen DRR und der Biologischen Reichsanstalt für Land- und Forstwirtschaft (BRA) (seit 1919) eine besonders hervorgehobene Stellung haben. Neben einem Rückblick auf die besonderen Erfolge dieser Arbeiten, soll in dem vorliegenden Überblicksbeitrag auf die gegenwärtigen und zukünftigen Herausforderungen des biologischen Pflanzenschutzes eingegangen werden.
Natürliche Gegenspieler von Schaderregern an Kulturpflanzen erbringen wichtige Ökosystemdienstleistungen für den Menschen. Sie sind ein unverzichtbarer Baustein für eine natürliche Schädlingsregulierung in ackerbaulichen Kulturen, im Gemüse- und Zierpflanzenbau, im Obst- oder Weinbau sowie im Forst, und helfen, Nutzpflanzen auf eine umweltfreundliche und nachhaltige Weise gesund zu erhalten. Nützlinge im Sinne des Pflanzenschutzes sind in der Regel wirbellose Tiere, die als Räuber, Parasitoide oder Parasiten verschiedene Stadien von Schaderregern abtöten oder in ihrer Vitalität schwächen. Sie gehören meistens zu den Arthropoda oder auch zu den Nematoda (Krieg & Franz, 1989, Schmutterer & Huber, 2005).
Man kennt verschiedene Strategien, Nützlinge als Gegenspieler von Schaderregern zu rekrutieren. Im konservierenden biologischen Pflanzenschutz wird versucht, durch angepassten Pflanzenschutz und die Gestaltung des Lebensraumes die natürliche Vielfalt von Nützlingen zu erhalten und ihre Ökosystemleistung zu fördern. Auch hierzu wurden und werden am JKI und dessen Vorgängerinstitutionen wichtige Forschungsansätze verfolgt. So haben intensive Arbeiten an mehreren Fachinstituten des JKI dazu beigetragen, dass Nebenwirkungen von Präparaten und ihren Wirkstoffen auf Nützlinge heutzutage in anerkannten, standardisierten und aussagekräftigen Testverfahren bei der Zulassung von Pflanzenschutzmitteln geprüft werden (Candolfi et al., 2000). Auch Möglichkeiten der Nützlingsförderung durch Habitatmanagement und Bereitstellung von Ressourcen in Agrarökosystem wurden in den 1990er Jahren an mehreren Instituten der damaligen BBA intensiv beforscht (z. B. Ruppert, 1993) und sind auch aktuell angesichts des Verlustes an biologischer Vielfalt wieder ein wichtiges Aktionsfeld (z. B. Herz et al., 2019). Ein hierbei wichtiger Faktor ist unter anderem die Schaffung von ökologischen Infrastrukturen wie Hecken und ein- oder mehrjährige Blühstreifen (Boller et al., 2004). So sind beispielsweise Schwebfliegen oder parasitoide Wespen eifrige Blütenbesucher, denn sie benötigen Nektar und Pollen als Energiequelle oder zur Eireifung. Bei Vorhandensein dieser Ressourcen in der Kultur kann die natürliche Schädlingsregulierung deutlich gefördert werden. Kürzlich wurde in einer internationalen Studie, an der auch das JKI in Darmstadt beteiligt war, gezeigt, dass mit mehrjährigen Blühstreifen in Fahrgassen ökologischer Obstbaubetriebe eine verbesserte Blattlausregulierung erreicht werden kann (Cahenzli et al., 2019).
Bei akuten Schädlingsproblemen, aber auch als vorbeugende Maßnahme entsteht oft der Wunsch, Nützlinge gezielt in die Kultur einzubringen, um weitere Schäden an den Pflanzen zu verhindern. Bereits in der im Jahr 1898 gegründeten „Biologischen Abteilung für Land- und Forstwirtschaft“ am Kaiserlichen Gesundheitsamt in Berlin-Dahlem wurden erste Überlegungen zum Einsatz von Nützlingen angestellt. So sind einer heute am Institut für Biologischen Pflanzenschutz befindlichen „Schlupfwespenakte“ Aufzeichnungen zu entnehmen, nach denen im Jahr 1911 die Kaiserliche Biologische Anstalt für Land- und Forstwirtschaft die Bestrebungen des „Königlichen Provinzialschulkollegiums der Provinz Westpreußen“ zur Bekämpfung von Kohlschädlingen mit Hilfe von Nützlingen in einem Gutachten bewerten sollte (Abb. 1, Biologische Reichsanstalt für Land- und Forstwirtschaft, 1906-1933).

Abb. 1. „Schlupfwespenakte“ – eine Dokumentation zu Forschungsaktivitäten zum Einsatz von Schlupfwespen im biologischen Pflanzenschutz an der Kaiserlichen Biologischen Anstalt für Land- und Forstwirtschaft in den Jahren 1906 – 1933. Unveröffentlicht.
Konkret ging es darum, Kokons der Brackwespe Cotesia glomerata in großem Stil durch Lehrer und Schüler einsammeln zu lassen, diese unter geeigneten Bedingungen zu hältern und dann im folgenden Jahr gezielt im Kohlanbau einzusetzen – heute wäre dies ein moderner CitizenScience-Ansatz! Die Experten der Kaiserlichen Anstalt äußerten sich allerdings eher skeptisch. Doch in einem folgenden Bericht des besagten Provinzialschulkollegiums werden erste Erfolge dieser Aktion geschildert, insbesondere auch dadurch, dass „die Jugend durch die lebhaft interessierenden Erscheinungen in der Entwicklung der Tierchen zu aufmerksamer Beobachtung angeregt und für die Sache erwärmt wurde“. Systematischer begann die Suche nach spezifischen Nützlinge dann rund 10 Jahre später – mittlerweile an der BRA und initiiert von Albrecht Hase, der dort das „Laboratorium für physiologische Zoologie“ leitete. Sein Augenmerk galt zunächst der Bekämpfung von Vorratsschädlingen mit Brackwespen, für die er Methoden der Massenzucht entwickelte und dazu in engem Austausch mit Kollegen in Frankreich und den USA stand. Bald – ebenfalls angeregt durch die internationale Zusammenarbeit – interessierte sich Hase auch für die Rekrutierung eines Eiparasitoiden, die Erzwespe Trichogramma. Die ersten dieser Forschungsobjekte fand Hase in seinem eigenen Garten, nicht weit vom Standort Berlin-Dahlem entfernt, und zwar in Form von parasitierten Eigelegen der Kohleule (Hase, 1925). Die daraus schlüpfende Art war T. evanescens und Hase gelangen erste Schritte hin zu einer Massenzucht und Verfügbarmachung dieser Tiere in großem Stil für Versuche gegen eine Vielzahl von Schädlingen in Landwirtschaft, Gartenbau und Forst. In den folgenden zehn Jahren waren die Aktivitäten von kleinen Erfolgen, mehr aber noch von Rückschlägen gezeichnet und letztendlich fehlten dann auch irgendwann die notwendigen finanziellen Mittel. Ab 1933, während der Schreckensjahre des Nazi-Regimes und der Kriegs- und Nachkriegsjahre, wurden keine Forschungen mehr in der „Schlupfwespenakte“ dokumentiert. Erst in den 1950er Jahren griffen Quednau und Kollegen ebenfalls am Standort Dahlem an der nun bestehenden BBA das Trichogramma-Thema wieder auf, allerdings mehr in Richtung Verhaltensbiologie und Systematik dieses Nützlings (Quednau, 1956; 1958).
Jost Franz holte Trichogramma dann 1956 schließlich an das im Jahr 1948 gegründete „Kartoffelkäfer“-Institut in Darmstadt, dem heutigen Institut für Biologischen Pflanzenschutz des JKI. Seine Forschung zielte dabei direkt auf eine Optimierung der Massenzucht sowie eine Verbesserung in der Applikationstechnik insbesondere für den Einsatz von Trichogramma im Obstbau ab (Schütte & Franz, 1961). Ab den 1970er Jahren führte dann die praxisnahe Forschung unter Sherif Hassan am Darmstädter Institut zu einem regelrechten Boom möglicher Anwendungen dieses Nützlings. Die von ihm forcierte internationale Zusammenarbeit ebnete den Weg zu einer globalen Erfolgsgeschichte (Hassan, 1998). Heutzutage ist Trichogramma ein bestens etablierter Nützling mit einer Vielzahl von Einsatzgebieten im Vorratsschutz, Gartenbau und natürlich im Ackerbau zur Bekämpfung des Maiszünslers (Ostrinia nubilalis) auf aktuell mehr als 40.000 ha Anwendungsfläche in Deutschland (Koch et al., 2019). Mehrere Firmen bieten diesen Nützling an und der Einsatz erfolgt sehr effektiv auch mit modernen Methoden wie der Ausbringung mit Multikoptern.
Die gartenbauliche Praxis verlässt sich auf kommerziell in Massenzucht produzierte Nützlinge, die sehr spezialisiert gegen ganz bestimmte Schaderreger vorgehen. Der gewerbliche Einsatz von Nützlingen in Deutschland begann in systematischer Weise bereits in den 1980er Jahren. Zu diesem Zeitpunkt standen kommerziell zwei Nützlinge in größerem Maßstab zur Verfügung: die Raubmilbe Phytoseiulus persimilis gegen Spinnmilben und die Erzwespe Encarsia formosa zur Bekämpfung der Weißen Fliege Trialeurodes vaporariorum (Franz, 1984). In beiden Fällen half auch das Interesse von engagierten Gemüseproduzenten den Nützlingen zum Durchbruch (Hussey, 1985). Heutzutage stehen dem Erwerbsgärtner mehr als 80 verschiedene Arten zur Verfügung (Bathon, 1999). Vor allem im Tomaten-, Gurken- und Zierpflanzenanbau kommen bei mehr als 90 % der Betriebe diese Gegenspieler mehr oder weniger regelmäßig zur Anwendung (Koch et al., 2019). Die Mehrzahl der käuflichen Nützlinge wird unter Glas eingesetzt und bietet bei Pflanzenschutzproblemen im Gewächshaus sowie in der Innenraumdekoration die bevorzugte, aber auch oftmals die einzig machbare Option (Abb. 2).
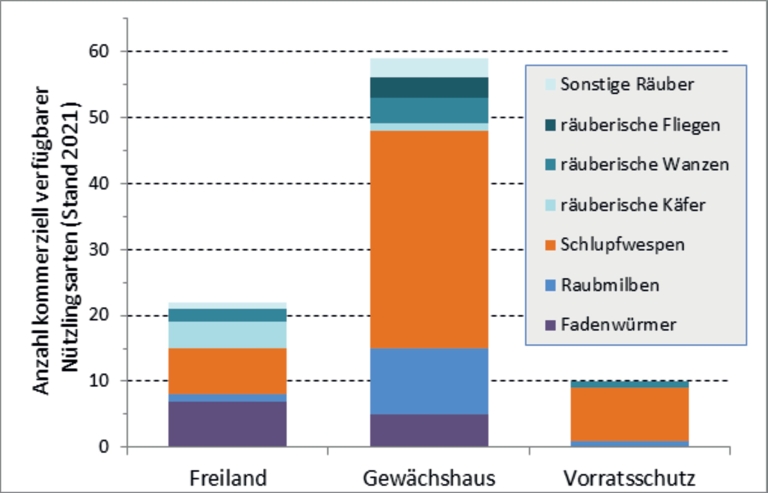
Abb. 2. Anzahl der im Jahr 2021 verfügbaren Arten von Räubern, Parasitoiden und Fadenwürmern in den Anwendungsbereichen Freiland, Gewächshaus und Vorratsschutz. Räuberisch lebende Arten und Fadenwürmer kommen sowohl im Freiland und unter Glas gegen eine Vielzahl an Schädlingen zum Einsatz. Schlupfwespen dagegen sind mehr spezialisiert und werden nur dort eingesetzt, wo ihre Wirte vorkommen.
Auch im Vorratsschutz sind Nützlinge wichtig. Im Freiland sollten heimische Arten freigelassen werden (vgl. Regelung nach § 40 Bundesnaturschutzgesetz). Hier eignen sich z. B. insektenpathogene Fadenwürmer, da sie wenig mobil sind und nicht vom Anwendungsort abwandern. Sehr mobile, kommerziell verfügbare Nützlinge wie der Sieben-Punkt-Marienkäfer oder die Hainschwebfliege sind auch heimisch, wandern aber meist nach der Freilassung schnell ab, vor allem wenn die Umweltbedingungen nicht so vorteilhaft sind. Kommerziell produzierte Nützlinge werden meist mit genauen Angaben zu ihrer Biologie, ihrem Wirts- und Beutespektrum und Hinweisen zur bestmöglichen Ausbringung an den Kunden geliefert. Insektenpathogene Fadenwürmer werden i. d. R. in Wasser suspendiert und dann mit der Gießkanne oder auch der Pflanzenschutzspritze (bei geeigneter Düse und möglichst auch nach Entfernung von sehr kleinporigen Filtern, die für die Fadenwürmer nicht passierbar sind) oder dem Druckluftsprühgerät am Zielort auf den Boden oder an die Pflanze gesprüht. Die meisten Parasitoide wie E. formosa, Trichogramma oder verschiedene Blattlausschlupfwespen werden in einem Ruhestadium vom Nützlingsproduzenten auf Kartonkärtchen geklebt oder in Pappröhrchen eingebracht, die dann in die Kultur an den Pflanzen befestigt werden. Die Wespen schlüpfen nach und nach, suchen nach spezifischen Signalen (meist Duftstoffen) ihrer Wirte und parasitieren diese dann. Die nächste Generation entsteht und kann wiederum Schädlinge bekämpfen. Räuberische Arten werden oft im Ei- oder Larvalstadium ausgebracht, oftmals „formuliert“ mit Buchweizen-Spelzen oder anderen Trägerstoffen in kleinen Papiertütchen, die den Räubern eine Versteckmöglichkeit bieten und verhindern, dass sich die Tiere während des Transportes vor dem Einsatz gegenseitig auffressen. Räuber wie die Larve der Florfliege haben ein breiteres Beutespektrum und sind dadurch gegen mehrere Schädlinge wirksam. Eine Auflistung der kommerziell erhältlichen Nützlinge sowie Bezugsquellen ist einem Infoblatt des JKI zu entnehmen (https://www.julius-kuehn.de/media/Veroeffentlichungen/Flyer/Nuetzlinge_zu_kaufen.pdf).
Mitunter können heimische Arten auch eingeschleppte Schädlinge, die zunächst große Probleme bereiten, nach einer gewissen Zeit sehr gut regulieren. So parasitieren die heimischen Schlupfwespen Dacnusa sibirica und Diglyphus isaea, die Ende der 1980er Jahre aus den USA eingeschleppten Minierfliegen Liriomyza trifolii und L. huidobrensis so erfolgreich, dass deren Auftreten in den Gewächshäusern gut kontrollierbar ist (Leuprecht, 1992). Beide Parasitoide sind auch kommerziell zu erwerben und können bei rechtzeitigem Einsatz einen Befall weitgehend verhindern. Aktuell werden am JKI Möglichkeiten erforscht, wie man mit heimischen Parasitoiden-Arten die zu Beginn der 2010er Jahre nach Deutschland eingeschleppte Kirschessigfliege Drosophila suzukii vor allem im geschützten Beerenobstanbau kontrollieren kann (Englert & Herz, 2016).
Das Ziel der klassischen biologischen Schädlingsbekämpfung ist die dauerhafte Regulierung eingeschleppter Schädlinge mittels nachgeführter spezifischer Antagonisten aus dem ursprünglichen Herkunftsgebiet. Diese Strategie wurde in Deutschland erstmals mit der Einfuhr der Erzwespe Aphelinus mali zur Regulierung der zuvor von Nordamerika aus eingeschleppten Blutlaus im Obstbau verfolgt. Die ersten Tiere gelangten im Jahr 1924 aus Uruguay an das Institut für Pflanzenkrankheiten in Landsberg an der Warthe (heute das polnische Gorzów Wielkopolski), wurden dort vermehrt und an weitere Forschungsinstitution verteilt (Quelle: BRA-Schlupfwespenakte). Heute ist diese Erzwespe seit langem etabliert und für die Populationsregulierung dieses Schädlings unverzichtbar – eine Erfolgsgeschichte! Ähnlich gelungen verlief auch die Ansiedlung der Erzwespe Prospaltella perniciosi gegen die San-José-Schildlaus, ausgehend von der Landesanstalt für Pflanzenschutz in Baden-Württemberg während der 1950er Jahre (Krieg & Franz, 1989). Damalige Bemühungen am Institut in Darmstadt den Kartoffelkäfer mit der räuberischen Baumwanze Perillus bioculatus zu bekämpfen, schlugen hingegen fehl. Freilassungen in mehreren europäischen Ländern blieben erfolglos, die nearktische Wanze etablierte sich nicht (Franz, 1967). Heutzutage würde man die Freilassung eines Nützlings außerhalb seiner Herkunftsregion zunächst sehr kritisch bewerten, um negative Auswirkungen durch ungewollt invasive Arten wie im Fall des Asiatischen Marienkäfers Harmonia axyridis ab den 2000er Jahren zu vermeiden (Bathon, 1999). Dagegen kommt es aber auf Grund der zunehmenden Globalisierung in Transport und Warenaustausch trotz strenger Importbedingungen immer wieder zur Verschleppung von Pflanzenschädlingen in Regionen außerhalb ihres natürlichen Verbreitungsgebietes. Bei passenden Klimabedingungen und dem Vorhandensein geeigneter Wirtspflanzen können sich diese Organismen etablieren und beim Fehlen spezifischer natürlicher Feinde ungebremst vermehren. In Deutschland hat z. B. das explosionsartige Auftreten der Kirschessigfliege seit 2014 ganz neue Herausforderungen vor allem an den Beerenobstbau gestellt. Ähnliches könnte geschehen, wenn sich die bereits in den südwestlichen Bundesländern festgestellte Marmorierte Baumwanze (Halyomorpha halys) weiter ausbreitet und vermehrt. Sie besitzt ein breites Wirtspflanzenspektrum und könnte sich zu einem ernstzunehmenden Schädling im Obst (Apfel, Pfirsich), Gemüse (vor allem Tomate) und auch Ackerbau (Mais) entwickeln. In anderen Invasionsgebieten, z. B. den USA oder auch der Schweiz, erhofft man sich Entlastung durch die Etablierung der sehr spezifischen „Samurai-Wespe“ (Trissolcus japonicus). Im Jahr 2020 wurde dieser Eiparasitoid erstmals auch in Deutschland nachgewiesen – vielleicht eine neue Chance in der klassischen biologischen Schädlingsbekämpfung (Dieckhoff et al., 2021).
Die Entwicklung von Ideen für eine spezielle Nützlingsförderung als auch die Gewinnung neuer effizienter Kandidaten aus der heimischen Fauna, aber auch aus dem Ursprungsgebiet eingeschleppter Schädlinge sind auch in Zukunft unverzichtbare Strategien bei der Bewältigung von Pflanzenschutzproblemen. Der biologische Pflanzenschutz mit Nützlingen bietet aber keine ad hoc-Lösungen. Vielmehr benötigt er auf Grund seiner Komplexität eine besondere Wertschätzung dieser „Freunde“ und die Berücksichtigung ihrer wesentlichen Bedürfnisse in der Kulturpflanzenerzeugung.
Im Gegensatz zu Makroorganismen, deren Verwendung derzeit vom Bundesnaturschutzgesetz geregelt ist, unterliegt das Inverkehrbringen von mikrobiellen Antagonisten, Naturstoffen und Semiochemicals europäischen Regelungen der Wirkstoffgenehmigung und Pflanzenschutzmittelzulassung, welche in der Verordnung (EG) Nr. 1107/2009 und weiteren damit zusammenhängenden Verordnungen und Gesetzen niedergelegt sind. Im Rahmen entsprechender Prüfverfahren werden diese Mittel hinsichtlich ihrer Identität, biologischen Eigenschaften, Wirksamkeit, Humanpathogenität und -toxikologie, Umweltverhalten und Ökotoxikologie, usw. bewertet. Stand Frühjahr 2021 sind in Deutschland allein 32 verschiedene Virus-, Bakterien- und Pilzstämme in verschiedenen Pflanzenschutzmitteln zugelassen. Außerdem kommen ca. 15 Naturstoffe und zehn Pheromone hinzu.
Wesentliche Impulse für die Entwicklung vieler dieser Mittel basieren auf den Forschungsarbeiten des Instituts für Biologischen Pflanzenschutz in Darmstadt. Dort wurden erste Arbeiten mit Mikroorganismen (einschl. Viren) als Pflanzenschutzmittel bereits in den 1950er Jahren initiiert, wobei der Fokus dieser frühen Aktivitäten insbesondere auf Forstschädlingen, wie z. B. Rote Kiefernbuschhornblattwespe Neodiprion sertifer oder Wald- und Feldmaikäfer (Melolontha sp.), lag. Zunehmend rückte aber auch der Garten- und Obstbau in den Mittelpunkt. 1964 wurde das erste mikrobielle Präparat „BIOSPOR“ auf Basis des Bacillus thuringiensis in Deutschland anerkannt. Auch der Stamm des Käferspezifischen Stammes B. thuringiensis ssp. tenebrionis wurde von den Darmstädter Forschern entdeckt und später zu einem besonders für den ökologischen Kartoffelanbau wichtigen Produkt NOVODOR entwickelt. Enge Forschungs- und Entwicklungskooperationen mit Pflanzenschutzmittelhersteller führten Anfang der 1990er Jahre zur Zulassung von verschiedener Pilz- (Metarhizium anisopliae, BIO 1020) und Viruspräparaten (Cydia pomonella Granulovirus, GRANUPOM) (Zimmermann, 1998). Nachdem 2005 in Deutschland erstmals Resistenzen der Obstmade gegen das Apfelwicklergranulovirus (CpGV) festgestellt wurden, bereiteten jüngere Forschungsarbeiten den Weg für neue, resistenzbrechende CpGV-Präparate, sowie für das Phthorimaea operculella Granulovirus (PhopGV) zur Bekämpfung der Tomatenminiermotte (Jehle et al., 2006; BIOCOMES, 2017). Aus dem Bereich der Naturstoffe und anderer nicht-chemischer Pflanzenschutzverfahren ist die Entwicklung des damaligen Pflanzenstärkungsmittels MILSANA und die Heißwasserbehandlungen von Saatgut zur Bekämpfung samenbürtiger Krankheitserreger hervorzuheben (Schmitt et al., 2002; Koch et al., 2010). MILSANA beruht auf einem Extrakt aus dem Sachalin-Staudenknöterich und erhöht die Widerstandsfähigkeit von Pflanzen gegen den Echten Mehltau und Botrytis. Heute sind entsprechende Präparate als Fungizide in Nordamerika im Einsatz. Mit diesen Arbeiten wurden neben der biologischen Bekämpfung von Schädlingen auch jene von Krankheitserregern erfolgreich in das Institutsportfolio integriert.
Jüngste Forschungsschwerpunkte mit mikrobiellen Antagonisten umfassen Bodenschädlinge (Maikäfer M. melolontha, Drahtwürmer (Agriotes sp.), Eulenraupen (Agrotis sp.), Dickmaulrüssler, pflanzenpathogene Nematoden), invasive Schädlinge (Kirschessigfliege D. suzukii, Tomatenminiermotte Tuta absoluta, Buchsbaumzünsler Cydalima perspectalis, Herbstheerwurm Spodoptera frugiperda und die Marmorierte Baumwanze H. halys), sowie und samen- und bodenbürtige Krankheitserreger (Brandpilze und Fusarien), um nur einige zu nennen. Die Produktion, Formulierung und Applikation biologischer Präparate erfordert oftmals spezifische Methoden und Verfahrenstechniken, welche ebenfalls am Institut erforscht werden. Zur Identifikation und für Wirkungsstudien mikrobieller Antagonisten kommen heute modernste molekulare Techniken der Genomsequenzierung (DNAseq und RNAseq) dieser Organismen und der zu kontrollierenden Schaderreger zum Einsatz. Diese Methoden haben die Möglichkeiten der Diagnostik und das Potential funktioneller Studien revolutioniert und um ein Vielfaches beschleunigt.
Viele Insekten und Spinnen, aber auch bodenlebende Organismen wie Fadenwürmer, Raubmilben und natürlich auch Mikroorganismen stellen als natürliche Gegenspieler von Schädlingen ihre Fraß- oder Parasitierungstätigkeit der Landwirtschaft als kostenlose Ökosystemdienstleistung zur Verfügung. Insbesondere die Begrenzung der Bestandsdichte von pflanzensaugenden Schaderregern wie Blattläusen im Ackerbau oder Spinnmilben im Obst- und Gemüsebau unter die ökonomisch relevante Schadensschwelle kann mit der natürlich vorkommenden „Armada“ an Nützlingen gelingen (Freier et al., 2007). Der alarmierende Verlust der Biologischen Vielfalt (IPBES, 2018) bedroht auch diese für die Kulturpflanzenerzeugung so wichtige funktionelle Biodiversität. Habitatverlust durch Simplifizierung der Agrarlandschaft gilt als eine wesentliche Ursache (Seibold et al., 2019), weshalb ein wesentlicher Schritt zur Erhaltung und Förderung von ökosystemaren Dienstleistungen wie Bestäubung, biologische Schädlingskontrolle oder auch Bodengesundheit daher in einer verbesserten Diversifizierung der Agrarlandschaft gesehen wird (Martin et al., 2019; Albrecht et al., 2020). Für Arthropoden sind hier vor allem die Erhaltung essentieller Nahrungshabitate (Alternativbeute/-wirte, pflanzenbürtige Nahrung wie Nektar und Pollen) und Landschaftsstrukturen wie Hecken, naturnahe Bereiche, Streuobstwiesen etc. als Rückzugshabitate wichtig. Verschiedene Agrarumweltmaßnahmen, z. B. die Anlage von Hecken oder Blühstreifen, auch mit gebietseigenem Saatgut von Wildpflanzen, bieten bereits finanzierte Umsetzungsmöglichkeiten für die Landwirtschaft. Aktuell gibt es auch in Deutschland im Rahmen des „Aktionsprogramms Insektenschutz“ (BMU, 2019) oder verschiedener Förderprogramme des BMEL zahlreiche Forschungsprojekte, die beispielsweise untersuchen, wie mit maßgeschneiderten Blühstreifen oder einer Erhöhung der Anbauvielfalt die Populationen von Nützlingen in der Kultur oder auch in der Agrarlandschaft gefördert werden können. An einigen ist auch das Institut für Biologischen Pflanzenschutz beteiligt (z. B. FInAL-Projekt (Förderung von Insekten in Agrarlandschaften: https://www.final-projekt.de/), MonViA-Projekt (Das bundesweite Monitoring der biologischen Vielfalt in Agrarlandschaften: https://www.agrarmonitoring-monvia.de)) bzw. besonders in Obstkulturen aktiv (Herz et al., 2020; Cahenzli et al., 2019).
Die Erfolge in Bezug auf die Erforschung und Entwicklung biologischer Pflanzenschutzverfahren mit Makro- und Mikroorganismen wären ohne eine nachhaltige und überaus fruchtbare nationale, europäische und weltweite Zusammenarbeit des Instituts mit unzähligen Forschungspartnern, Institutionen und in diversen Gremien nicht möglich geworden. Diese stets anwendungsbezogenen und problemorientierten Kooperationen haben die Arbeiten des Instituts als auch seiner Partner wesentlich gefördert und geprägt. Hervorzuheben sind die seit Jahrzehnten andauernde Mitarbeit in der International Organisation for Biological and Integrated Control (IOBC-WPRS), der European and Mediterranean Plant Protection Organization (EPPO), der Society of Invertebrate Pathology (SIP), mit der Gesellschaft für internationale Zusammenarbeit (GIZ) sowie in zahlreichen EU-Forschungsverbünden, um nur die wichtigsten zu nennen.
Dennoch führte der biologische Pflanzenschutz in den vergangenen Jahrzehnten neben dem alles dominierenden chemischen Pflanzenschutz ein Nischendasein und war überwiegend auf den Ökologischen Landbau, wo chemisch-synthetische PSM nicht verwendet werden dürfen, und den Unter-Glas-Anbau beschränkt. Dies hat sich in den vergangenen Jahren grundlegend geändert, biologische Pflanzenschutzverfahren werden mittlerweile in vielen Kulturen eingesetzt (Jehle et al., 2014; Koch et al., 2019). Heute setzen gesellschaftliche und politische Forderungen und die damit einhergehenden Ziele der Verringerung des chemischen Pflanzenschutzes neue Rahmenbedingungen. Bereits die VO (EG) 1107/2009 priorisierte in seinen Erwägungsgründen (35) nicht-chemischen Methoden vor chemischen PSM. Entsprechend den allgemeinen Grundsätzen der Richtlinie 2009/218/EG sind „nachhaltigen biologischen, physikalischen und anderen nichtchemischen Methoden […] der Vorzug vor chemischen Methoden zu geben“. Ebenso zielt die Farm-to-Fork-Strategie der Europäischen Union auf eine deutliche Reduktion des chemischen Pflanzenschutzes und auf einen verstärkten Ausbau des Ökologischen Landbaus auf 30 % bis zum Jahr 2030.
Die Landwirtschaft der Zukunft wird daher mit deutlich weniger Agrochemikalien auskommen müssen. Biologische Präparate und Verfahren werden hierzu einen wichtigen Beitrag leisten. Weltweit werden heute augmentative Verfahren auf ca. 55 Millionen Hektar eingesetzt, wobei über 500 Nützlingsarten kommerziell erhältlich und mehr als 200 Stämme von Mikroorganismen zugelassen sind (van Lenteren et al., 2018; Willer et al., 2021). Circa 60 % der derzeitig bearbeiteten Wirkstoffgenehmigungsverfahren auf EU-Ebene sind mittlerweile biologischer Natur.
Somit wird der biologische Pflanzenschutz zukünftig eine weit bedeutendere Rolle in der Anbaupraxis spielen, was auch mit hohen Erwartungen an diese Verfahren verknüpft ist. Nicht alle diese Erwartungen werden ad hoc erfüllt werden, insbesondere lässt sich kaum ein chemisches Mittel analog durch ein biologisches Verfahren ersetzen, weil die gewohnten Wirkungsgrade und Wirkungsbreiten chemischer Mittel von biologischen Verfahren häufig nicht erreicht werden.
Biologische Verfahren zeichnen sich grundsätzlich durch eine hohe Spezifität für den Zielorganismus aus, hierauf gründen sich ihre allgemein günstigen human- und ökotoxikologischen Eigenschaften. Aufgrund ihrer Selektivität haben viele biologische Pflanzenschutzmittel nur wenige Anwendungen, d. h. einzelne Mittel können häufig nur gegen einen oder wenige Schaderreger in wenigen Kulturen eingesetzt werden. Dies gilt oft auch für spezifische Nützlinge, die nur ganz bestimmte Schaderreger attackieren können. Gerade diese Eigenschaft ist besonders für den klassischen biologischen Pflanzenschutz interessant, wenn sich Perspektiven zur Regulierung invasiver Schädlinge durch hochangepasste Gegenspieler aus dem Ursprungsgebiet eröffnen. Die dem biologischen Pflanzenschutz inhärente ökologische Vorzüglichkeit stößt allerdings auf verschiedenen Ebenen an ihre ökonomischen Grenzen; beispielsweise, wenn einerseits mehrere Schädlinge gleichzeitig bekämpft werden müssen (Landwirt) oder andererseits die Anwendungsfläche und damit die potentielle Marktgröße eines entsprechend spezifischen Produktes ein Inverkehrbringen unrentabel machen (Hersteller). Somit finden sich biologische Mittel und Verfahren unter den gegenwärtigen Zulassungs- und Produktionsbedingungen in einem Selektivitätsdilemma: je spezifischer die Wirkung eines Antagonisten, desto weniger potentielle Anwendungen und umso kleiner ist der Markt für ein entsprechendes Produkt. Gleichzeitig würden aber sehr viele unterschiedliche biologisch basierte Verfahren benötigt, um einen weniger selektiven chemischen Wirkstoff mit einem großen Anwendungsfeld zu ersetzen. Mit anderen Worten: Gerade die selektivsten Mittel und Verfahren haben unter den gegenwärtigen Zulassungsbedingungen und Marktbedürfnissen die größten ökonomischen Schwierigkeiten einer Kommerzialisierung.
Neben der Kulturpflanze und dem Schaderreger bringen auf Mikro- und Makroorganismen beruhende biologische Pflanzenschutzverfahren eine weitere biotische Komponente ins Pflanzen-Schaderreger-System. Das sogenannte „Control Window“ (Evans, 1994) wird hierdurch um ein vielfaches komplexer (Abb. 3).
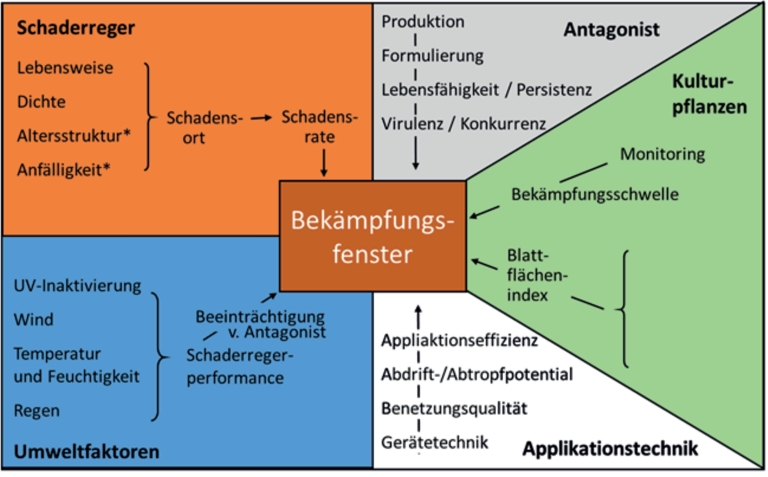
Abb. 3. Das Bekämpfungsfenster („Control Window“) wurde ursprünglich für Baculoviren und Insekten entwickelt, es gilt aber im Wesentlichen für viele andere mikrobieller Antagonisten von Insekten und über weite Teile auch für Pathogene und ihre Antagonisten (nach Evans, 1994). * von besonderer Bedeutung bei Insekten als Schaderreger.
Insbesondere im Freiland unterliegt die Performance des biologischen Antagonisten schwer zu kontrollierenden Parametern. Feuchtigkeit (Luft, Boden, Blatt), Temperatur, UV-Exposition beeinflussen nicht nur das Wachstum und die Etablierungsfähigkeit des Schaderregers, sondern auch der augmentativ eingesetzten Gegenspieler. Hinzu kommen die Virulenz bzw. Konkurrenz- und Lebensfähigkeit des Antagonisten, die auch durch die Produktionsbedingungen und Formulierung beeinflusst werden können. Aber auch die Dichte, Anfälligkeit und Altersstruktur der Schädlingspopulation sind für den Erfolg einer biologischen Bekämpfung von grundlegender Bedeutung. Beispielsweise, müssen Bakterien und Viren von den Schädlingen peroral aufgenommen werden, ihre Wirkung hängt somit von der Fraßrate und dem Entwicklungszustand des Schädlings ab. Vielfach müssen zudem die Applikationstechnik und die Schadschwellen in Bezug auf die spezifischen Eigenschaften des biologischen Wirkstoffes angepasst werden. Die Vielzahl dieser Einflussfaktoren und die Komplexität ihrer Interaktion addieren sich zu einer Systemplastizität, in der die Wirkungssicherheit biologischer Pflanzenschutzverfahren weniger konstant ist als bei chemischen Mitteln. Deren gewohnte Wirkungsgrade werden von biologischen Verfahren meist nicht erreicht. Daher werden auch etwaige Erwartungen, chemische Pflanzenschutzverfahren durch biologische und andere nicht-chemische Verfahren ersetzen zu können, ohne Anpassungen der für chemischen Pflanzenschutz optimierten Anbaubedingungen nichts anderes als eine herbe Enttäuschung erfahren. Biologische Pflanzenschutzverfahren entfalten ihre volle Wirkung nur im Verbund mit weiteren vorbeugenden Maßnahmen im Sinne des integrierten Pflanzenschutzes, wie z. B. Resistenzzüchtung und Sortenwahl, kulturtechnische Maßnahmen einschließlich Fruchtwechsel und angepasste Düngestrategien, Nützlingsförderung, usw. Sie wirken im System! Zudem sind biologische Verfahren deutlich beratungs- und überwachungsintensiver und erfordern eine gezielte Schulung im Umgang mit den Schaderregern und biologischen Präparaten. Diesen spezifischen Anforderungen muss in der universitären Lehre, der Landwirtschaftsausbildung und im Beratungswesen Rechnung getragen werden. Der fortschreitende Verlust chemischer Pflanzenschutzmittel, sei es durch Zulassungsbeschränkungen oder Resistenzentwicklungen gegen bestimmte Wirkstoffe oder durch die bewusste Ökologisierung der Pflanzenproduktion, wird den Bedarf an resilienten Anbausystemen und an verlässlichen biologischen Pflanzenschutzverfahren in den kommenden Jahren definieren und damit auch die Entwicklungslinien in der Kulturpflanzenforschung maßgeblich beeinflussen.
Die Autoren erklären, dass keine Interessenskonflikte vorliegen.
Albrecht, M., D. Kleijn, N.M. Williams, M. Tschumi, B.R. Blaauw, R. Bommarco et al., 2020: The effectiveness of flower strips and hedgerows on pest control, pollination services and crop yield: a quantitative synthesis. Ecology letters 23 (10), 1488–1498, DOI: 10.1111/ele.13576.
Bathon, H., 1999: Biologischer Pflanzenschutz mit Nützlingen. 1. In Deutschland angebotene Nützlingsarten. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 51, 25-31.
Batra, S.W.T., 1982: Biological Control in Agroecosystems. Science 215 (4529), 134-139, DOI: 10.1126/science.215.4529.134.
BIOCOMES, 2017: Control of tomato leaf miner and potato moths. Final Report at: http://www.biocomes.eu/wp-content/uploads/2017/11/WP4-potato-moths-and-tomato-leaf-miner.pdf (Access: 01.05.2021).
Boller, E.F., F. Häni, H.-M. Poehling, 2004: Ecological Infrastructures—Ideabook on Functional Biodiversity at the Farm Level. IOBC-WPRS (Hrsg.), Swiss Centre for Agricultural Extension and Rural Development (LBL), Lindau, Schweiz.
Biologische Reichsanstalt für Land- und Forstwirtschaft, 1906-1933: BRA-Schlupfwespenakte, Akten betreffend: Schlupfwespen 101-01(4), unveröffentlicht.
Cahenzli, F., L. Sigsgaard, C. Daniel, A. Herz, L. Jamar, M. Kelderer, S. Kramer Jacobsen, D. Kruczyńska, S. Matray, M. Porcel, M. Sekrecka, W. Świergiel, M. Tasin, J. Telfser, L. Pfiffner, 2019: Perennial flower strips for pest control in organic apple orchards - A pan-European study. Agriculture, Ecosystems & Environment 278, 43-53, DOI: 10.1016/j.agee.2019.03.011.
Candolfi, M.P., S. Blümel, R. Forster, F.M. Bakker, C. Grimm, S.A. Hassan, U. Heimbach, M.A. Mead-Briggs, B. Reber, R. Schmuck, H. Vogt, (Hrsg.), 2000: Guidelines to evaluate side-effects of plant protection products to non-target arthropods. Gent: International Organization for Biological and Integrated Control of Noxious Animals and Weeds, West Palearctic Regional Section (IOBC-WPRS). 158 Seiten.
Dieckhoff, C., S. Wenz, M. Renninger, A. Reißig, H. Rauleder, C.P.W. Zebitz, J. Reetz, O. Zimmermann, 2021: Add Germany to the list—Adventive Population of Trissolcus japonicus (Ashmead) (Hymenoptera: Scelionidae) emerges in Germany. Insects 12, 414, DOI: 10.3390/insects12050414.
Eilenberg, J., A. Hajek, C. Lomer, 2001: Suggestions for unifying the terminology in biological control. BioControl 46, 387–400, DOI: 10.1023/A:1014193329979.
Englert, C., A. Herz, A., 2016: Native predators and parasitoids for biological regulation of Drosophila suzukii in Germany. In: 17th Internationale Conference on Organic Fruit Growing: Proceedings to the Conference from 15.-17. February 2016, Hohenheim/Germany. Fördergemeinschaft Oekologischer Obstbau e. V. (FOEKO) (Hrsg.), 284-285.
Evans, H.F., 1994: The Control Window: A conceptual approach to using baculoviruses for forest pest control. Proc. VI International Colloquium of Invertebrate Pathology and Microbial Control, 380-384.
Franz, J.M., 1967: Beobachtungen Über das Verhalten der Raubwanze Perillus bioculatus (Fabr.) (Pentatomidae) gegenüber ihrer Beute Leptinotarsa decemlineata (Say) (Chrysomelidae). Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz 74, 1-13.
Franz, J.M., 1984: Welche Nutzorganismen sind in Europa für den biologischen Pflanzen- und Gesundheitsschutz verfügbar? Anzeiger für Schädlingskunde, Pflanzenschutz, Umweltschutz 57, 105-111.
Freier, B., H. Triltsch, M. Möwes, E. Moll, 2007: The potential of predators in natural control of aphids in wheat: Results of a ten-year field study in two German landscapes. BioControl 52, 775-788, DOI: 10.1007/s10526-007-9081-5.
Hase, A., 1925: Beiträge zur Lebensgeschichte der Schlupfwespe Trichogramma evanescens Westwood. Arbeiten der Biologischen Reichsanstalt 14, 171-224.
Hassan, S.A., 1998: Die Anwendung von Eiparasiten der Gattung Trichogramma im biologischen Pflanzenschutz in Deutschland – Geschichte, Erfolge und Aussichten für die Zukunft. Mitteilungen der Biologischen Bundesanstalt für Land- und Forstwirtschaft 346, 83-108.
Herz, A., F. Cahenzli, S. Penvern, L., Pfiffner, M. Tasin, L. Sigsgaard, 2019: Managing floral resources in apple orchards for pest control: ideas, experiences and future directions. Insects, 10 (8), 247, DOI: 10.3390/insects10080247.
Herz, A., R.G. Kleespies, D. Stephan, C. Ehrich, H. Pfitzner, 2020: Biologischer Pflanzenschutz als Ökosystemleistung im integrierten Kernobstanbau (Abschlussbericht BÖLN-Projekt Demoapfel, FKZ 11NA017). Quedlinburg, Julius Kühn-Institut, Bundesforschungsinstitut für Kulturpflanzen, Institut für Biologischen Pflanzenschutz. URL: https://orgprints.org/id/eprint/39244/.
Hussey, N.W., 1985: History of Biological Control in protected culture: Western Europe. In: Biological Pest Control: the glasshouse experience. Hussey, N.W., N. Scopters (Hrsg.), 11-22. Dorset, Blandford Press.
IPBES, 2018: Zusammenfassung für politische Entscheidungsträger des Regionalen Assessments zur biologischen Vielfalt und Ökosystemleistungen in Europa und Zentralasien der Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services (IPBES). Fischer, M., M. Rounsevell, A. Torre-Marin Rando, A. Mader, A. Church, M. Elbakidze, V. Elias, T. Hahn, P.A. Harrison, J. Hauck, B. Martín-López, I. Ring, C. Sandström, I. Sousa Pinto, P. Visconti, N.E. Zimmermann, M. Christie (Hrsg.). Bonn, Deutschland, IPBES-Sekretariat, 48 Seiten.
Jehle, J.A., S.M. Sayed, B. Wahl-Ermel, K. Eberle, 2006: Neues Apfelwicklergranulovirus-Isolat: Bekämpfung von resistenten Apfelwicklerpopulationen möglich? Obstbau 31, 320-322.
Jehle, J.A., A. Herz, B. Keller, R.G. Kleespies, E. Koch, A. Larem, A. Schmitt, D. Stephan, 2014: Statusbericht Biologischer Pflanzenschutz 2013. Berichte aus dem Julius Kühn-Institut 173, 117 S., DOI: 10.5073/berjki.2014.173.000.
Krieg, A., J.M. Franz, 1989: Lehrbuch der biologischen Schädlingsbekämpfung. Berlin und Hamburg, Paul Parey, 302 S.
Koch, E., A. Schmitt, D. Stephan, C. Kromphardt, M. Jahn, H.-J. Krauthausen et al., 2010: Evaluation of non-chemical seed treatment methods for the control of Alternaria dauci and A. radicina on carrot seeds. European Journal of Plant Pathology 127, 99–112, DOI: 10.1007/s10658-009-9575-3.
Koch, E., A. Herz, R.G. Kleespies, A. Schmitt, D. Stephan, J.A. Jehle, 2019: Statusbericht Biologischer Pflanzenschutz 2018. Berichte aus dem Julius Kühn-Institut 203, 125 S., DOI: 10.5073/berjki.2018.203.000.
Leuprecht, B., 1992: Biologische Bekämpfung von Liriomyza huidobrensis in Gemüsekulturen im Gewächshaus. Gesunde Pflanzen 44, 222-229.
Martin, E.A., M. Dainese, Y. Clough, A. Baldi, R. Bommarco, V. Gagic et al., 2019: The interplay of landscape composition and configuration: new pathways to manage functional biodiversity and agroecosystem services across Europe. Ecology letters 22 (7), 1083–1094, DOI: 10.1111/ele.13265.
Quednau, W., 1956: Die biologischen Kriterien zur Unterscheidung von Trichogramma-Arten. Zeitschrift für Pflanzenkrankheiten 63, 333-344.
Quednau, W., 1958: Über einige Orientierungsweisen des Eiparasiten Trichogramma (Hym. Chalcididae) auf Grund von Licht- und Schwerereizen. Anzeiger für Schädlingskunde 31, 83-85.
Ruppert, V., 1993: Einfluss blütenreicher Feldrandstrukturen auf die Dichte blütenbesuchender Nutzinsekten insbesondere der Syrphinae (Diptera: Syrphidae). Agrarökologie 8, Bern, Schweiz, Haupt-Verlag.
Schmitt, A., S. Kunz, S. Nandi, B. Seddon, A. Ernst, 2002: Use of Reynoutria sachalinensis plant extracts, clay preparations and Brevibacillus brevis against fungal diseases of grape berries. Proceedings of the 10th International Conference on Cultivation Technique and Phytopathological Problems in Organic Fruit-Growing and Viticulture (Föko: Weinsberg, Germany), pp. 146-151.
Schmutterer, H., J. Huber, 2005: Natürliche Schädlingsbekämpfungsmittel. Stuttgart, Ulmer Verlag. 264 S.
Schütte, F., J.M. Franz, 1961: Untersuchungen zur Apfelwicklerbekämpfung (Carpocapsa pomonella (L.)) mit Hilfe von Trichogramma embryophagum Hartig. Entomophaga 6, 237-247.
Seibold, S., M.M. Gossner, N.K. Simons, N. Blüthgen, J. Müller, D. Ambarlı et al., 2019: Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574 (7780), 671–674, DOI: 10.1038/s41586-019-1684-3.
van Lenteren, J.C., K. Bolckmans, J. Köhl, W.J. Ravensberg, A. Urbaneja, 2018: Biological control using invertebrates and microorganisms: plenty of new opportunities. BioControl 63, 39–59, DOI: 10.1007/s10526-017-9801-4.
Willer, H., J. Trávníček, C. Meier, B. Schlatter (Hrsg.), 2021: The World of Organic Agriculture – Statistics and Emerging Trends 2021. Research Institute of Organic Agriculture FiBL, Frick, and IFOAM – Organics International, Bonn (v20210301).
Zimmermann, G., 1998: Geschichte des Instituts für Biologischen Pflanzenschutz. In: 100 Jahre Pflanzenschutzforschung – Geschichte der Institute und Dienststellen der Biologischen Bundesanstalt, Teil 2. Laux, W. (Hrsg), Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft 344, 65-79.