

Journal für Kulturpflanzen, 74 (03-04). S. 63–74, 2022 | DOI: 10.5073/JfK.2022.03-04.04 | Eben et al.
Ausgewählte schädliche Neozoen im Obstbau – Überblick zur Situation und aktuellen Forschungsvorhaben zur Kirschessigfliege und invasiven Stinkwanzen
Selected invasive pests in fruiticulture – overview of the current situation and ongoing research projects on spotted wing drosophila and stink bugs
 | Der Autor/Die Autorin 2022 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 3. Dezember 2021/3. Februar 2022 |
Gebietsfremde invasive Schadinsekten haben im Obstbau im vergangenen Jahrzehnt große wirtschaftliche Schäden verursacht und den kommerziellen Obstanbau vor neue Herausforderungen gestellt. Die Gründe für die Ausbreitung dieser Insekten sind vielfältig. Regulierungsmaßnahmen zur Eindämmung dieser Neozoen benötigen Erfahrungen in verschiedenen Kulturpflanzen und umfangreiche Kenntnisse zum Verhalten der invasiven Arten. Für die Kirschessigfliege gibt es bereits erste wirksame Regulierungsstrategien, sowie eine Dekade an Erfahrung und somit umfangreiches Wissen zur Biologie, Ökologie und Genetik dieses Schadinsekts, welches für die Weiterentwicklung von Bekämpfungsmaßnahmen unabdingbar ist. Invasive Schadwanzen werden derzeit an verschiedenen Standorten intensiv untersucht. Potenziell wirksame, alternative Methoden zur Regulierung werden aktuell in Forschungsprojekten erarbeitet.
Biologische Schädlingsbekämpfung, Einnetzung, Invasive Schaderreger, Kirschessigfliege, Marmorierte Baumwanze, Grüne Reiswanze, Schlupfwespen
Foreign invasive species have caused considerable economic damage in fruiticulture during the past decade. Consequently, commercial fruit production is facing major, new challenges. Reasons for the spread of those pest insects are manifold. Appropriate control measures for the containment of invasive species depend on several years of experience with diverse fruit cultures and in-depth-knowledge of the insects´ behaviour. For Spotted Wing Drosophila, first efficient mechanisms for the control of fruit infestation were identified and are in use. Moreover, broad knowledge of biology, ecology, and genetics of this species is available and can be applied for the development of further control strategies. Research on invasive stink bugs is currently undertaken at different locations. Effective means for their population regulation are developed in those research projects.
Biological control, insect nets, invasive pests, Spotted Wing Drosophila, Brown Marmorated Stink Bug, Southern Green Stink Bug, parasitoids
Die schnelle Ausbreitung invasiver Schadinsekten ist derzeit eine der größten Herausforderungen im Obstbau in Deutschland sowie in allen anderen obstanbauenden europäischen Ländern. Internationaler Handel und Tourismus sind die häufigsten Wege der Einschleppung von gebietsfremden Arten (Bradshaw et al., 2016). Viele dieser oft polyphagen invasiven Schadinsekten sind an die klimatischen Bedingungen in den Anbaugebieten der neu besiedelten Regionen angepasst und können sich somit sehr schnell etablieren, zumal natürliche Feinde zur Populationsregulierung im neuen Verbreitungsgebiet fehlen (Venette & Hutchinson, 2021). Die fortschreitende globale Erwärmung begünstigt diesen Trend v. a. bei wärmeliebenden Arten. Eine Folge der Klimaerwärmung sind mildere Winter, die zu geringerer natürlicher Mortalität in den Populationen führen können und längere Wärmeperioden, welche die Ausbildung mehrerer Generationen pro Jahr begünstigen können (Gutierrez & Ponti, 2014; Skendžić et al., 2021). Beispiele hierfür sind die Kirschessigfliege, Drosophila suzukii Matsumura 1931 (Diptera: Drosophilidae) und invasive Stinkwanzen. Problematisch sind derzeit im deutschen Obstbau, v. a. im Kern-, Stein- und Beerenobstanbau, die Kirschessigfliege und zwei Arten invasiver Schadwanzen, die Marmorierte Baumwanze Halyomorpha halys (Stål 1855) und die Grüne Reiswanze, Nezara viridula (Linnaeus 1758) (Hemiptera: Pentatomidae). Im Folgenden wird daher auf diese Neozoen im Obst eingegangen, wobei der Fokus auf Erfahrungen der letzten Jahre im Obstanbau in Südwestdeutschland liegt. In der dort zu findenden, kleinräumig strukturierten Landschaft werden im allgemeinen verschiedene Obstsorten in räumlicher Nähe und zeitlich überlappenden Reifeperioden meist auf wenigen ha-großen Familienbetrieben kultiviert.
Die Kirschessigfliege, D. suzukii, hat sich seit ihrem Erstfund 2011 in Deutschland zu einem der wirtschaftlich wichtigsten Schädlinge im Stein- und Beerenobstanbau entwickelt (Vogt et al., 2012; LTZ Augustenberg, 2019a; b). In ihrem Ursprungsgebiet in Südost-Asien ist D. suzukii vor 2010 nicht als Schädling erwähnt worden (Haye et al., 2016). Diese Fliege nutzt, im Gegensatz zu den heimischen Fruchtfliegenarten, zur Eiablage reifende sowie erntereife gesunde Früchte (Atallah et al., 2014; Keesey et al., 2015), in denen sich die Larven entwickeln und die Früchte dadurch zum Kollabieren bringen. Die Generationsdauer von Ei bis zum adulten Tier ist kurz und beträgt unter günstigen Bedingungen etwa 10 bis 17 Tage (Tochen et al., 2014). An einer Süßkirsche können unter starkem Befallsdruck mehr als 30 Eier abgelegt werden, bei Fruchtbonituren wurden aus einer einzelnen Himbeere oder Brombeere regelmäßig um die 30, aber auch bis zu 90 und mehr Larven ausgewaschen (unveröffentlichte Daten, JKI und LTZ). Dadurch kann in kurzer Zeit ein Totalausfall der Ernte die Folge sein. Die Anwendung von Insektiziden an den nahezu reifen Früchten ist schwierig und nicht effizient. Dies zum einen, da die Mittel mit den geschützt innerhalb der Früchte fressenden Fliegenlarven nicht in direkten Kontakt treten und zum anderen wegen zulassungsbedingten Wartezeiten nach einer Anwendung kurz vor der Ernte oft nicht genutzt werden können. Deshalb ist je nach Pflanzenschutzmittel ein Einsatz nicht oder nur begrenzt möglich. Da in manchen Obstkulturen keine wirksamen Insektizide zugelassen sind, haben sich Anträge auf Notfallzulassungen nach Art 53/EU-VO 1107/2009 geeigneter Pflanzenschutzmittel in den letzten Jahren für eine Reihe von Obstarten als unumgänglich erwiesen. D. suzukii bevorzugt rote bis schwarze, weichschalige Früchte und kann etwa 80 verschiedene Pflanzenarten als Wirte nutzen (Poyet et al., 2015; Kenis et al., 2016), so finden die Fliegen während der gesamten Vegetationsperiode durchgehend geeignete Früchte zur Eiablage. In Deutschland können sich je nach Region bis zu fünf Generationen pro Jahr entwickeln (Wiman et al. 2014; Weber & Kockerols, 2016), wobei sich die aufeinanderfolgenden Generationen überlappen und daher in einer Obstanlage alle Entwicklungsstadien gleichzeitig auftreten (Asplen et al., 2015). Die unterschiedliche Empfindlichkeit dieser Stadien (Ei, Larve, Puppe, adulte Fliege) gegenüber klimatischen Bedingungen (Hamby et al., 2016; Eben et al., 2018; Köppler et al., 2019; Winkler et al., 2020; Jung et al., 2021) und Insektiziden (Harzer & Sauter, 2017) macht die Möglichkeiten der Populationsregulierung mit synthetischen Wirkstoffen schwierig. Grundlegendes Wissen zur Reproduktions- und Entwicklungsbiologie sowie zu circadianen Aktivitätsperioden (Eiablage, Paarungsverhalten) und zur jahreszeitlichen Abfolge der Wirtspflanzennutzung ist wesentlich für die Erarbeitung effizienter Bekämpfungsstrategien (Hamby et al., 2013; Asplen et al., 2015; Kirkpatrick et al., 2018; Van Timmeren et al., 2017; Shaw et al., 2019a). Erschwerend kommt hinzu, dass die begrenzte Wirksamkeit der Insektizide und somit die, auf einige wenige synthetische Wirkstoffe reduzierte Bekämpfung, langfristig zur Entstehung von resistenten Populationen führen wird (Gress & Zalom, 2019).
Weltweit wird in zahlreichen Forschungsgruppen seit Jahren intensiv nach praktikablen Alternativen zur Bekämpfung der Kirschessigfliege gesucht (Cha et al., 2012; Erland et al., 2015; Revadi et al., 2015; Lee et al., 2016; Wallingford et al., 2016; Mori et al., 2017; Renkema et al., 2017; Feng et al., 2018; Schetelig et al., 2018; Tonina et al., 2018; Klick et al., 2019; Cloonan et al., 2019; Eben et al., 2020; Spitaler et al., 2020). Dabei spielen für die Entscheidung über den Einsatz einer direkten Bekämpfungsmaßnahme während der Vegetationsperiode zunächst die Populationsstärke, die abiotischen Bedingungen, vor allem die Temperatur, sowie der Entwicklungsstand der Wirtsfrucht eine Rolle (Jung et al. 2021; Ørsted et al., 2021). Eine direkte Regulierung mit zulässigen Insektiziden kann somit nach Befallsrisiko vorgenommen werden, wodurch deren Einsatz auf das notwendige Maß begrenzt werden sollte (s. auch: https://www.isip.de/isip/servlet/isip-de/entscheidungshilfen/gartenbau). Regulierungsstrategien ohne Anwendung synthetischer Insektizide, wie der Einsatz verhaltensändernder Substanzen (Clymans et al., 2019; Rice et al. 2017), waren bisher nur unter Laborbedingungen erfolgreich und konnten in Freilandversuchen weder als Repellentstoffe gegen die Eiablage, noch als wirksame Kontakttoxine bestätigt werden. Reifende und reife Wirtsfrüchte sind stets attraktiver im Vergleich zu chemischen Stoffen, die aus diesem Grund auch nicht für den Massenfang tauglich sind (Fanning et al., 2017). Ebenso haben Versuche mit sterilen Männchen (Nikolouli et al., 2020) bisher nicht zu den gewünschten Reduktionen in den Fliegenpopulationen geführt. Bei hohem Befallsdruck und günstigen abiotischen Bedingungen in den Sommermonaten sind bei sehr attraktiven Wirtsfrüchten, wie z. B. Himbeeren, trotz Vergleichs auf mögliche sortentypische Resistenzen, keine signifikanten Sortenunterschiede in der Befallshäufigkeit erkennbar (Pinggera et al., 2018; Wöhner et al. 2021). Die Ergebnisse umfangreicher Befallsbonituren in den Jahren 2014 – 2021 an Kirschen haben gezeigt, dass bei hohem Befallsdruck die zu dem Zeitpunkt reifen Kirschen aller Sorten befallen werden (unveröffentlichte Daten JKI; LTZ Augustenberg, 2019b). Parameter wie Schalendicke oder Zuckergehalt von Süßkirschen hatten keinen signifikanten Einfluss auf die Anzahl der abgelegten Eier oder die Anzahl der sich daraus entwickelnden Larven (Hemer, 2017).
Ein Vergleich der Wirkung flüchtiger Substanzen aus verschiedenen Erdbeersorten als Hemmstoffe gegen die Eiablage von D. suzukii, fand durch gesteigerte Konzentration einer Duftstoffkomponente keine Hemmung der Eiablage, jedoch eine erhöhte Sterblichkeit der Fliegenembryonen (Bräcker et al., 2020). Diese Ergebnisse sind von Bedeutung für zukünftige Resistenzzüchtungen im Rahmen der Strategien zur nachhaltigen Schädlingsbekämpfung. Maßgeblich für den Populationsaufbau im Frühjahr sind die Anzahl der Kälte- und Frosttage im Winter, die zur Wintermortalität der Adulten führen (Stockton & Loeb, 2021). Die Entwicklungsdynamik der nachfolgenden Generationen wird durch die, in jedem Jahr variierenden, vorherrschenden Temperatur- und Feuchteverhältnisse in den frühen Sommermonaten, während der Reifezeit von Süßkirschen, beeinflusst (Jung et al., 2021; Eben et al., 2018; Leach et al., 2019; Wiman et al., 2016).
Die Wirksamkeit von Insektiziden gegen die Kirschessigfliege ist abhängig vom Wirkmechanismus der Präparate. Eine reine Kontaktwirkung, wie z. B. bei Natur-Pyrethrum, wirkt nur auf die adulten Fliegen bei direktem Kontakt. Der Einfluss auf die Befallsentwicklung ist somit sehr gering, da Eier und Larven in den Früchten nicht betroffen sind. Als Kontaktinsektizid wirkt auch das synthetische Pyrethroid Karate Zeon mit dem Wirkstoff Lambda-Cyhalothrin. Dagegen haben das Insektizid SpinTor mit dem Wirkstoff Spinosad sowie Exirel mit dem Wirkstoff Cyantraniliprole eine teilsystemische Wirkung und somit auch einen Effekt auf die Eier und die Larven der Kirchessigfliege (Shawer et al., 2018; Shaw et al., 2019b). Beim Einsatz von Insektiziden ist weiterhin deren Regen- sowie UV-Stabilität von Bedeutung für den zu erwartenden Behandlungserfolg (Van Timmeren & Isaacs, 2013). Die Anwendung der genannten Insektizide gegen die Kirschessigfliege ist nicht in allen betroffenen obstbaulichen Kulturen und nicht in jedem Jahr möglich. Für jede Kultur ist daher die Indikation und bei befristeten Notfallzulassungen nach Art. 53 der aktuelle Zulassungstand pro Jahr sowie die spezifische Wartezeit vor der Ernte (d. h. Rückstandsproblematik) zu beachten. Für die Anwendung im Privatgarten stehen keine Insektizide zur Verfügung.
In der Pflanzenschutzberatung sind seit einigen Jahren kulturtechnische und kulturhygienische Maßnahmen zur Regulierung der Kirschessigfliege etabliert (Kuske et al., 2016; Überblick in LTZ Augustenberg, 2019a; b; Weber & Kockerols, 2016; Wichura et al., 2018). Zur Überwachung des Auftretens der Fliegen v. a. zu Saisonbeginn wird das Monitoring mit gelochten Becherfallen empfohlen. Ab dem Beginn der Fruchtreife sollen regelmäßig visuelle Bonituren der Früchte auf vorhandene Eier der Kirschessigfliege erfolgen (Kirschen) bzw. beim Beerenobst kann der Fruchtbefall durch das Auswaschen der Larven in Salzwasser ermittelt werden (LTZ Augustenberg, 2019a; b; Vogt, 2020). Kurze Ernteintervalle, um zu vermeiden, dass reife Früchte über längere Zeit für die Eiablage zur Verfügung stehen, sowie Entfernen von Fallobst und möglichst schnelles Kühlen des Ernteguts auf Temperaturen von 1-3°C sind wichtig, um den Ernteverlust so gering wie möglich zu halten (Leach et al., 2018). Falls Fruchtbefall festgestellt wurde, sollten nicht marktfähige Früchte gepflückt und Larven bzw. Eier durch Vergären oder Solarisation abgetötet werden. Befallene Früchte müssen dazu in geschlossenen Behältern gelagert werden.
Die derzeit wirksamste, nachhaltigste und rein mechanische Bekämpfungsstrategie ist die Einnetzung der gesamten Obstanlage mit feinmaschigen Insektennetzen (0,8 × 0,8 mm oder 0,8 × 1,0 mm Maschenweite, bzw. < 1 mm2) (Weydert et al., 2014; Kuesel et al., 2019; Augel et al. 2020, https://droso-demo-netz.julius-kuehn.de) (Abb. 1). Die Netze müssen spätestens zum Farbumschlag der Früchte geschlossen werden. Im Beerenobst, v. a. bei Himbeeren, ist es wegen der fortlaufenden Blütenentwicklung erforderlich, unter den Netzen Bestäuber (Hummeln) einzusetzen. Bei Kirschen dagegen werden die Netze meist erst nach dem Fruchtansatz geschlossen. Erfolgt das Schließen früher, müssen auch hier Bestäuber eingesetzt werden.

Abb. 1. Beispiel einer eingenetzten Obstanlage. Eingenetzte und nicht-eingenetzte Himbeeranlage mit Regenkappen eines am Demonstrationsvorhaben zum „Einnetzen von Obstkulturen als Schutz gegen die Kirschessigfliege, Drosophila suzukii“ beteiligten Betriebes in NRW (Bildautorin: Silke Benz, LWK, NRW).
Zur Evaluierung der wirtschaftlichen und befallsreduzierenden Wirkung von Einnetzungen der Obstanlage wird unter der Leitung des Julius Kühn-Instituts, Institut für Pflanzenschutz in Obst und Weinbau (OW) in Dossenheim seit 02/2017 unter Beteiligung der LWK Nordrhein-Westfalen, der LWK Niedersachsen und des LTZ Augustenberg (Baden-Württemberg) ein vom BMEL gefördertes Modell- und Demonstrationsvorhaben durchgeführt (Demonstrationsvorhaben: „Einnetzen von Obstkulturen zu Schutz gegen die Kirschessigfliege, Drosophila suzukii“, Förderkennzeichen 2815MD010). Hauptziel dieses Vorhabens ist, das Einnetzen von Obstkulturen in der Praxis umzusetzen und als Standard-Regulierungsstrategie gegen D. suzukii zu verbreiten. Dabei werden auch die bundesweiten Ziele des Nationalen Aktionsplans für die nachhaltige Verwendung von Pflanzenschutzmitteln (NAP) berücksichtigt. Seit 31.07.2020 ist außerdem in Baden- Württemberg die Gesetzesnovelle im Naturschutzgesetz (NaturSchG) und im Landwirtschaft- und Landeskulturgesetz (LLG) zur Stärkung der Biodiversität in Kraft getreten, die den Ausbau des ökologischen Landbaus und eine Reduktion von chemisch-synthetischen Pflanzenschutzmitteln um 40-50 % (PflSchAnwVO) bis zum Jahr 2030 zum Ziel hat (https://mlr.baden-wuerttemberg.de/de/unsere-themen/biodiversitaet-und-landnutzung/biodiversitaetsgesetz/).
An dem Modell- und Demonstrationsvorhaben waren bis Ende 2019 insgesamt 22 Betriebe aus drei Bundesländern (BW, NI, NRW) beteiligt und bis Projektende im Dezember 2021 noch 15 Betriebe aus Baden-Württemberg und Nordrhein-Westfalen. Die Arbeiten an Süßkirschen und Beerenobstkulturen unter Netz wurden in jedem Bundesland von Projektbetreuern begleitet. In jedem der Betriebe wurden der technische Ablauf der Einnetzung und die angewandte Konstruktion validiert und optimiert. Zusätzlich erfolgten Erhebungen zur Auswirkung der Netze auf Nützlinge (v. a. Fressfeinde) und zum Auftreten weiterer Schaderreger, z. B. Spinnmilben und Fruchtschalenwickler, sowie durch Pilzbefall verursachte Krankheiten. Zur Erfassung möglicher Veränderungen des Mikroklimas durch das Einnetzen wurden Temperatur und relative Luftfeuchtigkeit kontinuierlich mittels Datenloggern in den eingenetzten Beständen gemessen (Abb. 2A, B).

Abb. 2. Daten zum Mikroklima in Obstanlagen auf einem Demonstrationsbetrieb. Absolute Temperatur (A) und relative Luftfeuchte (B) innerhalb einer eingenetzten Himbeeranlage (Netz) und der nicht eingenetzten Kontrollparzelle während einer Dreitagesperiode auf einem Betrieb in NRW. Die Daten wurden kontinuierlich mit Datenloggern erhoben.
Die betriebswirtschaftliche Bewertung der Einnetzungen erfolgte in einem Teilprojekt des Demonstrationsvorhabens durch das Julius Kühn-Institut, Institut für Strategien und Folgenabschätzung (SF) in Kleinmachnow.
Begleitet wird dieses Projekt durch intensive Öffentlichkeitsarbeit in Form von Hoftagen, Vorträgen auf Fachtagungen, Kurzfilmen auf YouTube, Faltblättern und Veröffentlichungen in Fachzeitschriften. Generell zeigten die Netze eine sehr gute Schutzwirkung gegen den Befall der Kirschessigfliege in jeder der untersuchten Kulturen. Innerhalb der Einnetzungen waren wenige bis keine Kirschessigfliegen zu finden und es trat kein oder nur vernachlässigbarer Fruchtbefall auf (Abb. 3A, B).
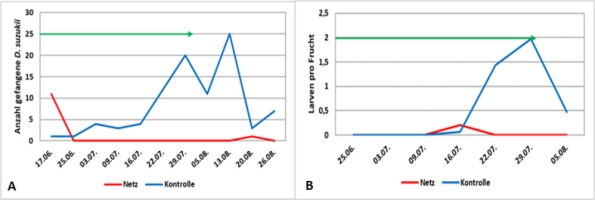
Abb. 3. Beispiel für Fallenfänge und Fruchtbefall durch die Kirschessigfliege in einem Demonstrationsbetrieb. Vergleichende Fallenfänge (A) und Fruchtbefall (B) in eingenetzten und nicht-eingenetzten Himbeeranlagen auf einem Betrieb in NRW (s. Abb. 1).
Die im Rahmen des Projektes produzierten und auf YouTube zu sehenden Video-Filme stellen mehrere am Projekt beteiligte Betriebe mit unterschiedlichen Systemen der Einnetzung vor und zeigen wichtige Aspekte des Einnetzens, die es zu beachten gilt, um die bestmögliche Wirkung zu erzielen. Ebenso wird die Methodik zur Überwachung des Auftretens der Kirschessigfliege (Adulte, Larvenbefall) vorgestellt und beschrieben. Video-Interviews mit Betriebsleitern geben einen sehr guten Einblick in die Praxis des Einnetzens. Ein animierter Erklärfilm erläutert, warum es wichtig ist, Einnetzungen zu etablieren. (https://www.youtube.com/playlist?list=PL1s9lNnnONtvHR0Kt49bFS6GE19FZvTrt).
Auf der Projektseite des Demovorhabens (https://droso-demo-netz.julius-kuehn.de) und auf dem Wissensportal Drosophila des JKI (https://drosophila.julius-kuehn.de/) werden umfangreiche Informationen zu Biologie, zur Verbreitung und zum Management der Kirschessigfliege bereitgestellt.
Eine positive Nebenwirkung der Netze war der Schutz gegen andere Schaderreger an den Früchten, wie z. B. die Kirschfruchtfliege. Zu beachten ist jedoch sowohl für die Kirschessigfliege als auch für andere Schaderreger am Obst, dass zum Zeitpunkt des Schließens der Netze die Gefahr besteht, dass Schädlinge bereits eingedrungen sind und sich schnell und ungehindert ausbreiten können, da z. B. nachfolgende Nützlinge ausgeschlossen werden. Falls dies der Fall ist, können spezifische Insektizide oder Nützlinge gezielt eingesetzt werden.
Das Auftreten der Kirschessigfliege wird vor und während der Reifezeiten der eingenetzten Früchte mit Hilfe von Essigfallen überwacht. Sind Kirschessigfliegen zum Zeitpunkt des Schließens der Netze bereits im Bestand, muss direkt nach dem Schließen der Netze eine Insektizidanwendung durchgeführt werden.
Als weiterer Baustein einer nachhaltigen Bekämpfungsstrategie gegen D. suzukii wird eine gezielte Freilassung von für diesen Zweck gezüchteten, wirtsspezifischen Parasitoiden untersucht. Dabei sind zwei Arten von Pupalparasitoiden von besonderem Interesse: die kosmopolitische Art Trichopria drosophilae (Hymenoptera: Diapriidae) (Abb. 4) und die ebenfalls weltweit verbreitete Erzwespe, Pachycrepoideus vindemiae (Hymenoptera: Pteromalidae) (Rossi Stacconi et al., 2019; Englert & Herz, 2019; Wolf et al., 2019).

Abb. 4. Puppenparasitoid bei der Eiablage. Weibchen der Schlupfwespe Trichopria drosophilae (Hymenoptera: Diapriidae) bei der Eiablage in eine Puppe von Drosophila suzukii (Diptera: Drosophilidae) (Bildautorin: Camilla Englert, JKI).
Der Fokus eines aktuellen Forschungsprojektes liegt dabei auf Freilassungen dieser Parasitoide in geschützten, d. h. eingenetzten Anlagen. Im Rahmen des im Frühsommer 2021 begonnenen und vom BMEL geförderten Projektes zur Anwendung von Pupalparasitoiden gegen die Kirschessigfliege unter der Leitung des Instituts für Biologischen Pflanzenschutz des JKI in Zusammenarbeit mit dem Institut für Pflanzenschutz in Obst- und Weinbau des JKI in Dossenheim, der Hochschule Geisenheim und der Fa. Katz Biotech AG wird untersucht, wie parasitische Schlupfwespen in eingenetzten Beerenkulturen effizient zur Regulierung von D. suzukii beitragen (Verbundprojekt: „Anwendung von Pupalparasitoiden zur biologischen Regulierung der Kirschessigfliege in der Praxis (ParaDrosu)“, Förderkennzeichen 281 880 5A19, 2021-2024). Das Ziel ist die Massenzucht von Pupalparasitoiden für die kommerzielle Anwendung in verschiedenen Kulturen unter Netz, wodurch langfristig gesehen der Insektizideinsatz zur Bekämpfung der Kirschessigfliege weiter reduziert und die Vermarktbarkeit der Früchte gesichert werden sollen. Es gibt zudem Hinweise aus der Forschung, dass diejenigen Pflanzenschutzmittel, die effizient gegen die Kirschessigfliege im Beerenobst eingesetzt werden, negative Wirkungen auf diese Pupalparasitoide haben (Schlesener et al., 2019). Um diese Frage beantworten zu können, werden im oben genannten Forschungsprojekt Laboruntersuchungen und Freilandstudien auf dem Versuchsfeld des JKI in Dossenheim sowie in Praxisbetrieben durchgeführt.
Bei den invasiven Schadwanzenarten sind es die Marmorierte Baumwanze, Halyomorpha halys, und die Grüne Reiswanze, Nezara viridula, die in der letzten Dekade zunehmend wirtschaftliche Probleme im Obstbau sowie im Garten- und Ackerbau verursachen und europaweit sowie im nordamerikanischen Raum zu einem vieldiskutierten Thema geworden sind (Leskey & Nielsen, 2018; Dieckhoff et al., 2020) (Abb. 5A, B). Diese beiden Schadwanzenarten sind aus (sub-) tropischen Regionen Asiens bzw. Afrika eingeschleppt worden und profitieren von den zunehmend wärmeren Klimabedingungen in Mitteleuropa (Werner, 2005; Haye & Zimmermann, 2017).

Abb. 5. Invasive Stinkwanzen auf Früchten. (A) Adulte Halyomorpha halys (Hemiptera: Pentatomidae) auf Himbeere (Bildautorin: Christine Dieckhoff, LTZ); (B) Ansammlung von H. halys Nymphen auf Nektarinen. Unterschiedliche Entwicklungsstadien von Nymphen der Marmorierten Baumwanze saugen an Nektarinen (Bildautorin: Kirsten Köppler, LTZ).
Sie zeichnen sich durch ein sehr breites Wirtspflanzenspektrum aus und befallen Arten aus dem Kern- und Steinobstbereich ebenso gerne wie diverses Beerenobst. Besonders beliebt sind Birne, Apfel und Pfirsich sowie Vertreter der Sonderkulturen, z. B. Kiwi (Todd, 1989; Leskey & Nielsen, 2018). Bei einem frühen Befall der Früchte kann es durch die Saugschäden zum Abstoßen oder zu Verkrüppelungen der sich entwickelnden Früchte kommen. Ein später Befall kann bei der Ernte, in Abhängigkeit von Kultur und Sorte, unter Umständen zunächst unentdeckt bleiben und sich erst in der Lagerung entwickeln (Acebes-Doria et al., 2016; Bergh et al., 2019). Eine Direktvermarktung der geschädigten Früchte ist in der Regel nicht mehr möglich. Besonders H. halys hat sich zu einem wirtschaftlich bedeutenden Schadorganismus in den neu besiedelten Obstanbaugebieten entwickelt. Apfelanbauer in den mittelatlantischen Regionen der USA hatten 2010, knapp 20 Jahre nach der Einschleppung von H. halys, erstmals wirtschaftliche Schäden in Höhe von 37 Mio. USD berichtet (Rice et al., 2014). Im Zuge der Bekämpfung der Schadwanzen in den Kulturen wurde bis zur vierfachen der sonst üblichen Menge an Insektiziden ausgebracht, was eine hohe ökologische Belastung darstellt (Leskey et al., 2012a). Für Italien wurde die Marmorierte Baumwanze erstmals 2012 beschrieben und hatte sich bereits ein Jahr später in mehreren wirtschaftlich bedeutenden Anbaugebieten Norditaliens ausgebreitet (Haye et al., 2015). Aus diesen Regionen werden seit 2014 zunehmend wirtschaftliche Schäden gemeldet (Köppler et al., 2020), die sich im Jahr 2019 (d. h. weniger als zehn Jahre nach der Einschleppung) infolge hoher Populationsdichten in Birnen, Pfirsichen und Nektarinen auf einen wirtschaftlichen Verlust von über 356 Mio. € ausweiteten (Maistrello et al., 2020). Diese Schaderregerentwicklung hatte zudem eine erhöhte Ausbringung an Pflanzenschutzmitteln in den betroffen Obstanbaugebieten zur Folge (Maistrello et al., 2017).
Aufgrund der Biologie und der Lebensweise der Schadwanzen, die sich durch eine hohe Mobilität in Zeit und Raum auszeichnen, ist eine chemische Bekämpfung grundsätzlich nur sehr schwer durchführbar. Nymphen wie adulte Tiere verstecken sich oft auf der Blattunterseite, wodurch sie vor Fraßfeinden und auch vor Insektizidapplikationen teilweise geschützt sind. Kontinuierliche Zuwanderungen von Individuen aus den umliegenden Rand- und Saumstrukturen vergrößern die Populationen an einem Standort laufend und erschweren so zusätzlich eine effektive Bekämpfung. Zudem zeichnet sich die Marmorierte Baumwanze durch eine sehr hohe Widerstandsfähigkeit gegen die meisten verfügbaren Wirkstoffe aus. In Deutschland (ebenso wie in der Schweiz und Österreich) sind derzeit keine wirksamen Pflanzenschutzmittel für den Obstbau zugelassen. Studien aus Nordamerika zeigten zum Beispiel eine gute Wirkung zur Regulierung der Marmorierten Baumwanze bei Wirkstoffen wie Dimethoat, Malathion, Permethrin, Chlorpyrifos und Endosulfan (Aigner et al., 2015; Leskey et al., 2012b; Leskey & Nielsen 2018). Diese Mittel haben in Deutschland und zum Teil auch EU-weit (Endosulfan, Chlorpyrifos) keine Zulassung mehr.
Einnetzung der Bestände, wie sie bereits gegen andere Schaderreger wie die invasive Kirschessigfliege durchgeführt werden, können auch einen gewissen Schutz gegen Schadwanzen bieten (Candian et al., 2018; Maistrello et al., 2020; Candian et al., 2021). Der Zeitpunkt der Einnetzung, eine dicht abschließende Konstruktion und regelmäßige Kontrolle der Integrität der Netze ist entscheidend für einen Erfolg dieser Maßnahmen. In Obstanbaugebieten in der Emilia-Romagna (Italien) wurden positive Erfahrungen mit Insektenschutznetzen mit einer Maschenweite von ca. 4 × 2 mm gemacht. An den Anlagenrändern angebracht können sie den Einflug der Wanzen aus den Saumbereichen reduzieren (Torggler, 2020). Aus Italien wird auch berichtet, dass das ursprünglich gegen Apfelwickler entwickelte Alt’Carpo-Insektenschutznetz erfolgreich gegen die Marmorierte Baumwanze eingesetzt wurde (Romet et al. 2010; Tavella, 2021).
Vorkommen und Dichte der Populationen von Schadinsekten in Obstbeständen können mithilfe von Fallen oder Fallensystemen ermittelt werden. Lockstofffallen sind hierbei wichtige Hilfsmittel. Für die Marmorierte Baumwanze wurde bereits ein wirksamer Lockstoff entwickelt, der auf dem Aggregationspheromon der adulten Tiere basiert (Khrimian et al., 2014). Besonders im Frühjahr und Herbst sind diese Pheromonfallen erfahrungsgemäß sowohl für Adulte als auch Nymphen besonders fängig. Während der Sommermonate allerdings haben reifende Früchte einer Vielzahl von Wirtspflanzen eine höhere Attraktivität für die Wanzen, was sich in den Fangzahlen der Pheromonfallen in dieser Zeit niederschlägt (LTZ – pers. Beobachtung).
Abgesehen von einer klassischen Monitoringstrategie können derartige Lockstoffe mit dem Einsatz chemisch-synthetischer Pflanzenschutzmittel in sog. „attract-and-kill“ Strategien kombiniert werden und so zur Bekämpfung von Schadpopulationen in den Beständen beitragen. In den USA wurde eine solche Strategie erfolgreich in kommerziellen Apfelanlagen eingesetzt (Morrison et al., 2019). In Deutschland wird die Umsetzung einer solchen Maßnahme durch den Mangel an effektiven Wirkstoffen und fehlende Zulassungen erschwert. Für die Grüne Reiswanze stehen zu diesem Zeitpunkt keine wirksamen Lockstoffe zur Verfügung.
Parasitoide, vor allem Arten in den Familien Scelionidae, Eupelmidae (Hymenoptera) und Tachinidae (Diptera), gehören zu den wichtigsten natürlichen Gegenspielern von Baumwanzen. Dabei sind es v. a. Arten der Gattungen Trissolcus (Hymenoptera: Scelionidae) (Jones, 1988; Orr, 1988) und Anastatus (Hymenoptera: Eupelmidae) sowie Telenomus (Hym.: Scelionidae), die erfolgreich Eigelege von Stinkwanzen parasitieren (Dieckhoff et al., 2017; Costi et al., 2019; Stahl et al., 2019a). Arten in der Gattung Trissolcus spp. sind auf eine oder einige wenige Wirtsarten aus derselben Gattung oder nahe verwandten Gattungen in derselben Ordnung spezialisiert. Sie stellen somit ideale Kandidaten für Bekämpfungsstrategien im Sinne des biologischen Pflanzenschutzes dar. In Deutschland parasitiert Trissolcus basalis erfolgreich die Grüne Reiswanze im Freiland ebenso wie im geschützten Anbau (unveröffentlichte Daten LTZ). Zwei mit der Marmorierten Baumwanze im Ursprungsland Asien vergesellschaftete Eiparasitoide, T. japonicus und T. mitsukurii, wurden in Europa erstmals 2017 sowohl in Italien (T. japonicus und T. mitsukurii) als auch in der Schweiz (T. japonicus) nachgewiesen und 2020 dann auch in Deutschland (T. japonicus) (Peverieri et al., 2018; Stahl et al., 2019b; Scaccini et al., 2020; Dieckhoff et al., 2021) (Abb. 6). Es ist davon auszugehen, dass diese Eiparasitoide zusammen mit ihrem Wirt verschleppt wurden. Mit Parasitierungsraten von bis zu 70 % ist T. japonicus im Ursprungsland ein wichtiger Gegenspieler von H. halys und zeigt auch in seinen neuen Ausbreitungsgebieten bereits hohe Parasitierungsraten gegenüber einheimischen Eiparasitoiden auf (Yang et al., 2009; Talamas et al. 2013; Zapponi et al., 2021).

Abb. 6. Eiparasitoid Trissolcus japonicus („Samuraiwespe“). Ein Männchen von T. japonicus (Hymenoptera: Scelionidae) kurz nach dem Schlupf auf einem Eigelege der Marmorierten Baumwanze (Hemiptera: Pentatomidae) (Bildautor: Olaf Zimmermann, LTZ).
In einem vom BMEL-geförderten Verbundprojekt „Monitoring und Modellierung klimasensitiver Schaderreger (ProgRAMM)“ (Laufzeit: 04/2021-01/2022, FKZ: 2818713A19) wurden exemplarisch verschiedene invasive Schadinsekten kartiert und deren potentielle Ausbreitung modelliert (Hess et al., 2020). Das Projekt hat die Kartierung von H. halys und N. viridula in Deutschland maßgeblich vorangebracht und konnte für die Marmorierte Baumwanze die Verbreitung vom Erstnachweis 2011 in Konstanz am Bodensee (Heckmann, 2012) bis nach Hamburg im Jahr 2018 dokumentieren (s. auch: https://www.neobiota-hamburg.de/de/arten). In diesem Projekt wurde ein deutschlandweites Monitoring-Netzwerk aufgebaut, auf das für Forschungsarbeiten zum Auftreten der invasiven Baumwanzen als Schädlinge in Obstkulturen und der Suche nach natürlichen Gegenspielern aufgebaut werden kann.
In dem, in diesem Frühjahr begonnenen, vom BMEL-geförderten Verbundprojekt „Entwicklung biologischer Pflanzenschutzstrategien gegen invasive nicht-geregelte Wanzenarten mit hohem Schadpotential (BC-InStink)“ (Laufzeit: 04/2021-03/2024, FKZ: 2818713A19) werden spezifische Pflanzenschutzstrategien gegen H. halys und N. viridula im Obstbau untersucht und entwickelt. Grundlage der Strategien soll der Einsatz natürlicher Gegenspieler sein. An diesem Verbundprojekt sind das LTZ Augustenberg (Gesamtkoordination), das JKI Dossenheim sowie die Fa. Katz Biotech AG beteiligt. Im Rahmen des mehrere Versuchsanlagen und Praxisbetriebe umfassenden Monitorings sowie mittels Bonituren und Ausbringung von Ködereigelegen an verschiedenen Standorten im Verbreitungsgebiet der Schadwanzen wird die Verbreitung von natürlichen Gegenspielern der Schadwanzen in Raum und Zeit untersucht. Ziel ist die Massenzucht geeigneter Gegenspieler für die kommerzielle Anwendung im Rahmen biologischer Pflanzenschutzstrategien. Weiterhin werden Studien durchgeführt, um wanzentypische Schäden von anderen in Obstanlagen häufig auftretenden Schadbildern abgrenzen zu können.
Für die vorgestellten invasiven Schadinsekten im Obst besteht aufgrund von derzeit fehlenden (Stinkwanzen) bzw. nur in geringem Umfang zugelassenen und bedingt wirksamen (Kirschessigfliege) Insektiziden umfassender Bedarf an Forschungsprojekten zur Entwicklung von alternativen, effizienten und nachhaltigen Regulierungsmechanismen. Vor dem Hintergrund des zunehmenden Wegfalls von Wirkstoffen im Zuge der sich EU-weit verschärfenden Zulassungsbedingungen (z. B. Anwenderschutz, cut off-Kriterien, Ökotoxizität), der geänderten Pflanzenschutz-Anwendungsverordnung, des bundesweiten Aktionsprogrammes zum Insektenschutz und der entsprechenden Änderungen im Naturschutzgesetz, sowie des Risikos einer Resistenzbildung der Schadinsekten gegen die wenigen verbliebenen Wirkstoffe, liegt die Zukunft der Schädlingsbekämpfung im biologischen Pflanzenschutz. Die Entwicklung entsprechender Pflanzenschutzstrategien ist daher unumgänglich für eine langfristige Regulierung der Populationen invasiver Schädlinge in allen Kulturbeständen. Dabei werden Strategien des biologischen Pflanzenschutzes in Kombination mit kulturspezifischen pflanzenbaulichen und anbautechnischen Maßnahmen zur Anwendung kommen. Es besteht aktuell dringender Forschungsbedarf, die bereits erarbeiteten biologischen und IP-Strategien mit Hilfe von konkreten, z. T. regional abgestimmten Maßnahmenkatalogen umzusetzen und dies wissenschaftlich zu begleiten.
Die Autorinnen und Autoren erklären, dass keine Interessenskonflikte vorliegen.
Acebes-Doria, A.L., T.C. Leskey, J.C. Bergh, 2016: Injury to apples and peaches at harvest from feeding by Halyomorpha halys (Stål) (Hemiptera: Pentatomidae) nymphs early and late in the season. Crop Protection 8, 58‑65, DOI: 10.1016/j.cropro.2016.06.022.
Aigner, J.D., J.F. Walgenbach, T.P. Kuhar, 2015: Toxicities of neonicotinoid insecticides for systemic control of brown marmorated stink bug (Hemiptera: Pentatomidae) in fruiting vegetables. Journal of Agricultural and Urban Entomology 31, 70-80.
Asplen, M.K.; G. Anfora, A. Biondi, D.S. Choi, D. Chu, K.M. Daane, P. Gibert, A.P. Gutierrez, K.A. Hoelmer, W.D. Hutchison, R. Isaacs, Z.L. Jiang, Z. Karpati, M.T. Kimura, M. Pascual, C.R. Philips, C. Plantamp, L. Ponti, G. Vetek, H. Vogt, V.M. Walton, Y. Yu, L. Zappala, N. Desneux, 2015: Invasion biology of spotted wing drosophila (Drosophila suzukii): a global perspective and future priorities. Journal of Pest Science 88, 469-494, DOI: doi.org/10.1007/s10340-015-0681-z.
Atallah, J., L. Teixeira, R. Salazar, G. Zaragoza, A. Kopp, 2014: The making of a pest: the evolution of a fruit-penetrating ovipositor in Drosophila suzukii and related species. Proceedings of the Royal Society of London, Series B 281, 20132840.
Augel, C., B. Boehnke, J. Wichura, J. Lindstaedt, J.-H. Wiebusch, A. Engel, S. Benz, J. Saltzmann, G. Eberhardt, H. Vogt, K. Köppler, 2020: Demonstration project "Exclusion netting for managing Spotted Wing Drosophila in fruit crops” – Results 2017 – 2019. Proceedings of the 19th International Conference on Organic Fruit-Growing from February 17th to 19th, 2020, University of Hohenheim, Germany (ed. Fördergemeinschaft Ökologischer Obstbau e. V., Weinsberg, Germany), pp. 166-169.
Bergh, J. C., S.V. Joseph, B.D. Short, M. Nita, T.C. Leskey, 2019: Effect of pre-harvest exposures to adult Halyomorpha halys (Hemiptera: Pentatomidae) on feeding injury to apple cultivars at harvest and during post-harvest cold storage. Crop Protection 124, 104872, DOI: 10.1016/j.cropro.2019.104872.
Bräcker, L.B., X. Gong, C. Schmid, C. Dawid, D. Ulrich, T. Phung, A. Leonhard, J. Ainswort, K. Olbricht, M. Parniske, N. Gompel, 2020: A strawberry accession with elevated methyl anthranilate fruit concentration is naturally resistant to the pest fly Drosophila suzukii. PloS one 15 (6), e0234040, DOI: 10.1371/journal.pone.0234040.
Bradshaw, C.J.A., B. Leroy, C. Bellard, D. Roíz, C. Albert, A. Fournier, M. Barbet-Massin, J.M. Salles, F. Simard, F. Courchamp, 2016: Massive yet grossly underestimated global costs of invasive insects. Nature Communications 7: 12986; DOI: 10.1038/ncomms1298.
Candian, V., M.G. Pansa, R. Briano, C. Peano, R. Tedeschi, 2018: Exclusion nets: a promising tool to prevent Halyomorpha halys from damaging nectarines and apples in NW Italy. Bulletin of Insectology 71 (1), 21‑30.
Candian, V., M.G. Pansa, K. Santoro, D. Spadaro, R. Briano, C. Peano, L. Tavella, R. Tedeschi, 2021: First Multi-Target Application of Exclusion Net in Nectarine Orchards: Effectiveness against Pests and Impact on Beneficial Arthropods, Postharvest Rots and Fruit Quality. Insects 12 (3), 210, DOI: 10.3390/insects12030210.
Cha, D. H., T. Adams, H. Rogg, P.J. Landolt, 2012: Identification and field evaluation of fermentation volatiles from wine and vinegar that mediate attraction of spotted wing drosophila, Drosophila suzukii. Journal of Chemical Ecology 38, 1419-1431.
Cloonan, K.R., J. Hernández-Cumplido, A.L. Viana de Sousa, D.G. Ramalho, H.J. Burrack, L. Della Rosa, L.M. Diepenbrock et al., 2019: Laboratory and field evaluation of host-related foraging odor-cue combinations to attract Drosophila suzukii (Diptera: Drosophilidae). Journal of Economic Entomology 112, 2850-2860, DOI: 10.1093/jee/toz224.
Clymans, R., V. Van Kerckvoorde, E. Banghes, W. Akkermans, A. Alhmedi, P. DeClercq, T. Beliën, D. Bylemans, 2019: Olfactory preference of Drosophila suzukii shifts between fruit and fermentation cues over the season: effects of physiological status. Insects 10, 200, DOI: 10.3390/insects10070200.
Costi, E., T. Haye, L. Maistrello, 2019: Surveying native egg parasitoids and predators of the invasive Halyomorpha halys in Northern Italy. Journal of Applied Entomology 143 (3), 299‑307, DOI: 10.1111/jen.12590.
Dieckhoff, C., K. Köppler, A. Reissig, H. Schneller, O. Zimmermann, 2020: Die Marmorierte Baumwanze und die Grüne Reiswanze – neue Schadwanzen im Obstbau. Öko-Obstbau, 1, 16‑20.
Dieckhoff, C., K.M Tatman, K.A. Hoelmer, 2017: Natural biological control of Halyomorpha halys by native egg parasitoids: a multi-year survey in northern Delaware. Journal of Pest Science, 90 (4), 1143‑1158, DOI: 10.1007/s10340-017-0868-6.
Dieckhoff, C., S. Wenz, M. Renninger, A. Reißig, H. Rauleder, C.P.W. Zebitz, J. Reetz, O. Zimmermann, 2021: Add Germany to the List—Adventive Population of Trissolcus japonicus (Ashmead) (Hymenoptera: Scelionidae) Emerges in Germany. Insects 12 (5), DOI: 10.3390/insects12050414.
Eben, A., M. Reifenrath, F. Briem, S. Pink, H. Vogt, 2018: Response of Drosophila suzukii (Diptera: Drosophilidae) to extreme heat and dryness. Agricultural and Forest Entomology 20, 113-121, DOI: 10.1111/afe.12235.
Eben, A., F. Sporer, H. Vogt, P. Wetterauer, M. Wink, 2020: Search for alternative control strategies of Drosophila suzukii (Diptera: Drosophilidae): Laboratory assays using volatile natural plant compounds. Insects 11, 811, DOI:10.3390/insects11110811.
Englert, C., A. Herz, 2019: Zur Bedeutung heimischer Drosophila-Parasitoide für die Regulierung von Drosophila suzukii – Vom Freiland über das Labor zum Freiland. In: Deutsche Gesellschaft für allgemeine und angewandte Entomologie, Tagung Halle (Saale) 11.–14. März, Tagungsband 45-46.
Erland, L.A.E., M.R. Rheault, S.S. Mahmoud, 2015: Insecticidal and oviposition deterrent effects of essential oils and their constituents against the invasive pest Drosophila suzukii (Matsumura) (Diptera: Drosophilidae). Crop Protection 78, 20-26, DOI: 10.1016/j.cropro.2015.08.013.
Fanning, P.D., M.J. Grieshop, R. Isaacs, 2017: Efficacy of biopesticides on spotted wing drosophila, Drosophila suzukii Matsumura in fall red raspberries. Journal of Agricultural Entomology 142, 26-32, DOI: 10.1111/jen.12462.
Feng, Y., R. Bruton, A. Park, A. Zhang, 2018: Identification of attractive blend for spotted wing drosophila, Drosophila suzukii, from apple juice. Journal of Pest Science 91, 1251-1267, DOI: 10.1007/s10340-018-1006-9.
Gress, B.E., F.G. Zalom, 2019: Identification and risk assessment of spinosad resistance in a California populaton of Drosophila suzukii. Pest Managment Science 75, 1270-1275, DOI: 10.1002/ps.5240.
Gutierrez, A.P., L. Ponti, 2014: Analysis of invasive insects: links to climate change. In: Ziska L.H., Dukes J.S., (eds.). Invasive Species and Global Climate Change. CABI Publishing, Wallingford, UK: 45-61, DOI: 10.1079/9781780641645.0045.
Hamby, K.A., R.S. Kwok, F.G. Zalom, J.C. Chiu, 2013: Integrating circadian activity and gene expression profiles to predict chronotoxicity of Drosophila suzukii response to insecticides. PLoS One: 8, e68472, DOI: 10.1371/journal.pone.0068472.
Hamby, K.A., D.E. Bellamy, J.C. Chiu, J.C. Lee, V.M. Walton, N.G. Wiman, R.M. York, A. Biondi, 2016: Biotic and abiotic factors impacting development, behaviour, phenology, and reproductive biology of Drosophila suzukii. Journal of Pest Science 89, 605-619, DOI: 10.1007/s10340-016-0756-5.
Harzer, U., J. Sauter, 2017: Bekämpfungsstrategien gegen Drosophila suzukii: Insektizide. URL: https://ltz.landwirtschaft-bw.de/pb/,Lde/Startseite/Ueber + uns/Publikationen + und + Ergebnisse, accessed: 17.11.2021.
Haye, T., O. Zimmermann, 2017: Etablierung der marmorierten Baumwanze, Halyomorpha halys (Stal, 1855), in Deutschland. Heteropteron 4,: 34‑37.
Haye, T., T. Gariepy, K. Hoelmer, J.-P. Rossi, J.-C. Streito, X. Tassus, N. Desneux, 2015: Range expansion of the invasive brown marmorated stinkbug, Halyomorpha halys: an increasing threat to field, fruit and vegetable crops worldwide. Journal of Pest Science 88 (4), 665‑673, DOI: 10.1007/s10340-015-0670-2.
Haye, T., P. Girod, A.G.S. Cuthbertson, X.G. Wang, K.M. Daane, K.A. Hoelmer, C. Baroffio, J.P. Zhang, N. Desneux, 2016: Current SWD IPM tactics and their practical implementation in fruit crops across different regions around the world. Journal of Pest Science 89, 643-651, DOI: 10.1007/s10340-016-0737-8.
Heckmann, R., 2012: Erster Nachweis von Halyomorpha halys (Stål, 1855)(Heteroptera: Pentatomidae) für Deutschland. Heteropteron 36: 17-18.
Hemer, S. 2017: Variety-depending susceptibility of cherries to Drosophila suzukii according to fruit firmness and other ripening parameters. MSc Thesis in Crop Protection, Göttingen University, Germany, pp. 40.
Hess, B., P. Baufeld, A. Raja Dominic, C. Menz, A. Reisig, J. Strassemeyer, T. Waldau, A. Wilstermann, O. Zimmermann, G. Schrader, 2020: Modellierung klimasensitiver Schadorganismen in der Pflanzengesundheit. Journal für Kulturpflanzen 72, 435-439, DOI:10.5073/JfK.2020.08.14.
Jones, W., 1988: World review of the parasitoids of the southern green stink bug, Nezara viridula (L.) (Heteroptera: Pentatomidae). Annals of the Entomological Society of America 70, 1‑33, DOI: 10.1093/aesa/81.2.262.
Jung, J., S. Alexander, S. Bauer, U. Harzer, B. Kleinhenz, K. Köppler, P. Racca, R. Rayher, C. Tebbe, C. Weyland, A. Winkler, 2021: SIMKEF – Das Entscheidungshilfesystem für die Kirschessigfliege: Validierungsergebnisse Befallsentwicklung in Brombeeren (Teil B), 63. Dt. PS-Tagung, Göttingen, Kurzfassungen.
Keesey, I.W., M. Knaden, B.S. Hansson, 2015: Olfactory specialization in Drosophila suzukii supports an ecological shift in host preference from rotten to fresh fruit. Journal of Chemical Ecology 41, 121-128 DOI: 10.1007/s10886-015-0544-3.
Kenis, M., L. Tonina, R. Eschen, B. Van der Slius, M. Sancassani, N. Mori, T. Haye, H. Helsen, 2016: Non-crop plants used as hosts by Drosophila suzukii in Europe. Journal of Pest Science, 89, 735-748, DOI: 10.1007/s10340-016-0755-6.
Khrimian, A., A. Zhang, D.C. Weber, H.-Y. Ho, J.R. Aldrich, K.E. Vermillion, M.A. Siegler, S. Shirali, F. Guzman, T.C. Leskey, 2014: Discovery of the Aggregation Pheromone of the Brown Marmorated Stink Bug (Halyomorpha halys) through the Creation of Stereoisomeric Libraries of 1-Bisabolen-3-ols. Journal of Natural Products, 77 (7), 1708‑1717 DOI: 10.1021/np5003753.
Kirkpatrick, D.M., H.L. Leach, P. Xu, K. Dong, R. Isaacs, L.J. Gut, 2018: Comparative antennal and behavioral responses of summer and winter morph Drosophila suzukii (Diptera: Drosophilidae) to ecologically relevant volatiles. Environmental Entomology 47, 700-706, DOI: 10.1093/ee/nvy046.
Klick, J., C.R. Rodriguez-Saona, J. Hernández Cumplido, R.J. Holdcraft, W.H. Urrutia, R.O. Da Silva, R. Borges, A. Nafra-Neto, M.P. Seagraves, 2019: Testing a novel attract-and-kill strategy for Drosophila suzukii (Diptera: Drosophilidae) management. Journal of Insect Science 19, 3, 1-6, DOI: 10.1093/jisesa/iey132.
Köppler, K., C. Dieckhoff, O. Zimmermann, A. Reissig, 2020: Bekämpfung der Marmorierten Baumwanze. Obstbau 7, 406‑408.
Köppler, K., J. Jung, U. Harzer, M. Püffeld, M. Gradl, C. Tebbe, A. Winker, P. Raca, B. Kleinhenz, 2019: Spotted wing drosophila: Extremely meteorosensitive – a base for the development of a Decision Support System: IOBC-Tagung , 20.-25. Januar 2019, Lissabon.
Kuesel, R., D. Scott Hick, K. Archer, A. Sciligo, R. Bessin, D. Gonthier, 2019: Effecs of fine-mesh exclusion netting on pests of blackberry. Insects 10, 249, DOI: 10.3390/insects10080249.
Kuske, S., L. Kaiser, A. Wichura, R.W.S. Weber, 2016: Integrierte Bekämpfung der Kirschessigfliege. Schweizer Zeitschrift für Obst- und Weinbau 125, 8-11.
Leach, L., J. Moses, E. Hanson, P. Fanning, R. Isaacs, 2018: Rapid harvest schedules and fruit removal as non-chemical approaches for managing spotted wing drosophila. Journal of Pest Science 91, 219-226, DOI: 19.1007/s10340-017-0873-9.
Leach, H., S. Van Timmeren, W. Wetzel, R. Isaacs, 2019: Predicting within- and between-year variation in activity of the invasive spotted wing drosophila (Diptera: Drosophilidae) in a temperate region. Environmental Entomology 48, 1223-1233.
Lee, J.C., D.T. Dalton, K.A. Swoboda-Bhattarai, D.J. Bruck, H.J. Burrack, B.C. Strik, J.M. Woltz, V.M. Walton, 2016: Characterization and manipulation of fruit susceptibility to Drosophila suzukii. Journal of Pest Science 89, 771-780.
Leskey, T.C., A.L. Nielsen, 2018: Impact of the Invasive Brown Marmorated Stink Bug in North America and Europe: History, Biology, Ecology, and Management. Annual Review of Entomology 63 (1), 599‑618, DOI: 10.1146/annurev-ento-020117-043226.
Leskey, T.C., D. H. Lee, B.D. Short, S.E. Wright, 2012a: Impact of insecticides on the invasive Halyomorpha halys (Hemiptera: Pentatomidae): analysis of insecticide lethality. Journal of Economic Entomology 105, 1726-1735.
Leskey, T.C., B.D. Short, B.R. Butler, S.E. Wright, 2012b: Impact of the Invasive Brown Marmorated Stink Bug, Halyomorpha halys (Stål), in Mid-Atlantic Tree Fruit Orchards in the United States: Case Studies of Commercial Management. Psyche: A Journal of Entomology 1‑14, DOI: 10.1155/2012/535062.
LTZ Augustenberg, 2019a: Maßnahmenplan Kirschessigfliege: Beerenobst, InvaProtect – Nachhaltiger Pflanzenschutz gegen invasive Schaderreger im Obst- und Weinbau, INTERREG V Oberrhein, 2019, URL: www.ltz-augustenberg.de.
LTZ Augustenberg, 2019b: Maßnahmenplan Kirschessigfliege: Steinobst, InvaProtect – Nachhaltiger Pflanzenschutz gegen invasive Schaderreger im Obst- und Weinbau, INTERREG V Oberrhein, 2019, URL: www.ltz-augustenberg.de.
Maistrello, L., S. Caruso, M.G. Tommasini, 2020: Bioecology and management of Halyomorpha halys in fruit orchards in Southern Europe. ECOFRUIT 2020-19th International Conference on Organic Fruit Growing. Foedergemeinschaft Oekologischer Obstbau e. V. (FOEKO).
Maistrello, L., G. Vaccari, S. Caruso, E. Costi, S. Bortolini, L. Macavei, G. Foca, A. Ulrici, P.P. Bortolotti, R. Nannini, L. Casoli, M. Fornaciari, G.L. Mazzoli, P. Dioli, 2017: Monitoring of the invasive Halyomorpha halys, a new key pest of fruit orchards in northern Italy. Journal of Pest Science 90 (4), 1231‑1244, DOI: 10.1007/s10340-017-0896-2.
Mori, B.A., A.B. Whitener, Y. Leinweber, S. Revadi, E.H. Beers, P. Witzgall, P.G. Becher, 2017: Enhanced yeast feeding following mating facilitates control of the invasive fruit pest Drosophila suzukii. Journal of Applied Ecology 54, 170-177, DOI: 10.1111/1365-2664.12688.
Morrison, W. R., B.R. Blaauw, B.D. Short, A.L. Nielsen, J.C. Bergh, G. Krawczyk, Y.-L. Park, B. Butler, A. Khrimian, T.C. Leskey, 2019: Successful management of Halyomorpha halys (Hemiptera: Pentatomidae) in commercial apple orchards with an attract-and-kill strategy: Attract-and-kill to manage H. halys. Pest Management Science 75 (1), 104‑114, DOI:10.1002/ps.5156.
Nikolouli, K., F. Sassú, L. Mouton, C. Stauffer, K. Bourtzis, C. Cáceres, 2020: Combining sterile and incompatile insect techniques for the population suppression of Drosophila suzukii. Journal of Pest Science 93: 647-661, DOI: 10.1007/s10340-020-01199-6.
Orr, D.B., 1988: Scelionid wasps as biological control agents: a review. Florida Entomologist 71 (4), 506‑529, DOI: 10.2307/3495011.
Ørsted, M., J. Lye, P.A. Umina, J.L. Maino, 2021: Global analysis of the seasonal abundance of the invasive pest Drosophila suzukii reveal temperature extremes determine population activity potential. Pest Managment Science 77, 4555-4563, DOI: 10.1002/ps.6494.
Peverieri, G. S., E. Talamas, M.C. Bon, L. Marianelli, I. Bernardinelli, G. Malossini, L. Benvenuto, P.F. Roversi, K. Hoelmer, 2018: Two Asian egg parasitoids of Halyomorpha halys (Stål) (Hemiptera, Pentatomidae) emerge in northern Italy: Trissolcus mitsukurii (Ashmead) and Trissolcus japonicus (Ashmead) (Hymenoptera, Scelionidae). Journal of Hymenoptera Research 67, 37‑53, DOI: 10.3897/jhr.67.30883.
Pinggera, J., Wöhner, T., Hanke, M.-V., 2018: Evaluation of soft fruit genetic resources for resistance to the Spotted Wing Drosophila (Drosophila suzukii). Journal für Kulturpflanzen 70, 67-68.
Poyet, M., V. Le Roux, P. Gibert, A. Meirland, G. Prevost, P. Eslin, O. Chabrerie, 2015: The wide potential trophic niche of the Asiatic fruit fly Drosophila suzukii: the key of ist invasion success in temperate Europe? PLoS One 10, e0142785, DOI: 10.1371/journal.pone.0142785.
Renkema, J.M., R. Buitenhuis, R.H. Hallett, 2017: Reduced Drosophila suzukii infestation in berries using deterrent compounds and laminate polymer flakes. Insects 8, 117, DOI: 10.3390/insects8040117.
Revadi, S., S. Vitagliano, M.V. Rossi Stacconi, S. Ramasamy, S. Mansourian, S. Carlin, U. Vrhovsek, P.G. Becher, V. Mazzoni, O. Rota-Stabelli, S. Angeli, T. Dekker, G. Anfora, 2015: Olfactory responses of Drosophila suzukii females to host plant volatiles. Physiological Entomology 40, 54-64, DOI: 10.111/phen.12088.
Rice, K. B., C.J. Bergh, E.J. Bergmann,D.J. Biddinger, C. Dieckhoff, G. Dively, H. Fraser, T. Gariepy, G. Hamilton, T. Haye, A. Herbert, K. Hoelmer, C.R. Hooks, A. Jones, G. Krawczyk G. et al., 2014: Biology, Ecology, and Management of Brown Marmorated Stink Bug (Hemiptera: Pentatomidae). Journal of Integrated Pest Management 5 (3), 1‑13, DOI: 10.1603/IPM14002.
Rice, K.B., B.D. Short, T.C. Leskey, 2017: Development of an attract-and-kill strategy for Drosophila suzukii (Diptera: Drosophilidae): Evaluation of attracticidal spheres under laboratory and field conditions. Journal of Economic Entomology 110 (2), 353-542, DOI: 10.1093/jee/tow319.
Romet L., G. Severac, F. Warlop, 2010: Overview of “ALT’CARPO” concept and its development in France. Ecofruit – 14th International Conference on Cultivation Technique and Phytopathological Problems in Organic Fruit-Growing, Fördergemeinschaft Ökologischer Obstbau e. V. Weinsberg 14, 176-182.
Rossi Stacconi, M.V.; A. Grassi, C. Ioriatti, G. Anfora, 2019: Augmentative releases of Trichopria drosophilae for the suppression of early season Drosophila suzukii populations. BioControl 64, 9-19, DOI: 10.1007/s10526-018-09914-0.
Scaccini, D., M. Falagiarda, F. Tortorici, I. Martinez-Sañudo, P. Tirello, Y. Reyes-Domínguez, A. Gallmetzer, L. Tavella, P. Zandigiacomo, C. Duso, A. Pozzebon, 2020: An Insight into the Role of Trissolcus mitsukurii as Biological Control Agent of Halyomorpha halys in Northeastern Italy. Insects 11 (5), 306, DOI: 10.3390/insects11050306.
Schetelig, M.F., K.-Z. Lee, S. Otto, L. Talmann, J. Stökl, T. Degenkolb, A. Vilcinskas, R. Halitschke, 2018: Environmentally sustainable pest control options for Drosophila suzukii. Journal of Applied Entomology 142 (1-2), 3-17, DOI: 10.1111/jen.12469.
Schlesener, D.C.H., J. Wollmann, J. De Bastos Pazini, A.C. Padilha, A.D. Grützmacher, F.R. Mello Garcia, 2019: Insecticide toxicity to Drosophila suzukii (Diptera: Drosophilidae) parasitoids: Trichopria anastrephae (Hymenoptera: Diapriidae) and Pachycrepoideus vindemmiae (Hymenoptera: Pteromalidae). Journal of Economic Entomology 112, 1197-1206, DOI: 10.1093/jee/toz033.
Shaw, B., Brain, P., Wijnen, H., Fountain, M.T., 2019a: Implications of sub-lethal rates of insecticides and daily time of application on Drosophila suzukii lifecycle. Crop Protection 121, 182–194, DOI: 10.1016/j.cropro.2019.04.006.
Shaw, B., S. Hemer, M.F.L. Cannon, F. Rogai, M.T. Fountain, 2019b: Insecticide control of Drosophila suzukii in commercial sweet cherry crops under cladding. Insects 10, 196, DOI: 10.3390/insects10070196.
Shawer, R., L. Tonina, P. Tirello, C. Duso, N. Mori, 2018: Laboratory and field trials to identify effective chemical control strategies for integrated management of Drosophila suzukii in European cherry orchards. Crop Protection 103, 73–80, DOI: 10.1016/j.cropro.2017.09.010.
Skendžić, S., M. Zovko, I. Pajač živković, V. Lešić, D. Lemić, 2021: The impact of climate change on agricultural insect pests. Insects 12, 440, DOI: 10.3390/insects12050440.
Spitaler, U., F. Bianchi, D. Eisenstecken, I. Castellan, S. Angeli, N. Dordevic, P. Robatscher, R.F. Vogel, E.H. Hoschiers, S. Schmidt, 2020: Yeast species affects feeding and fitness of Drosophila suzukii adults. Journal of Pest Science 93, 1295–1309, DOI: 10.1007/s10340-020-01266-y.
Stahl, J. M., D. Babendreier, T. Haye, 2019a: Life history of Anastatus bifasciatus, a potential biological control agent of the brown marmorated stink bug in Europe. Biological Control 12, 178‑186, DOI: 10.1016/j.biocontrol.2018.10.016.
Stahl, J., F. Tortorici, M. Pontini, M.-C. Bon, K. Hoelmer, C. Marazzi, L. Tavella, T. Haye, 2019b: First discovery of adventive populations of Trissolcus japonicus in Europe. Journal of Pest Science 92 (2), 371‑379, DOI: 10.1007/s10340-018-1061-2.
Stockton, D.G., G.M. Loeb, 2021: Winter warm-up frequency and the degree of temperature fluctuations affect survival outcomes of spotted-wing drosophila winter morphotypes. Journal of Insect Physiology 131, 104246, DOI: 10.1016/j.jinsphys.2021.104246.
Talamas, E., M. Buffington, K. Hoelmer, 2013: New synonymy of Trissolcus halyomorphae Yang. Journal of Hymenoptera Research 33, 113‑117, DOI: 10.3897/jhr.33.5627.
Tavella, L., 2021: Invasive Schadorganismen. Das Beispiel Marmorierte Baumwanze. Obstbau Weinbau 4, 19-22.
Tochen, S., D.T. Dalton, N. Wiman, C. Hamm, P.W. Shearer, V.M. Walton, 2014: Temperature-related development and population parameters for Drosophila suzukii (Diptera: Drosophilidae) on cherry and blueberry. Environmental Entomology 43, 501-510, DOI: 10.1603/EN13200.
Todd, J. W., 1989: Ecology and behavior of Nezara viridula. Annual Review of Entomology 34, 273‑292, DOI: 10.1146/annurev.en.34.010189.001421.
Tonina, L., A. Grassi, S. Caruso, M. Mori, A. Gottardello, G. Anfora, F. Giomi, G. Vaccari, C. Ioriatti, 2018: Comparison of attractants for Drosophila suzukii monitoring in sweet cherry orchards in Italy. Journal of Applied Entomology 142, 8-25, DOI: 10.1111/jen.12416.
Torggler, B., 2020: Welches System hält Baumwanzen am besten fern? Besseres Obst 1, 4-6
Van Timmeren, S., R. Isaacs, 2013: Control of spotted wing drosophila, Drosophila suzukii, by specific insecticides and by conventional and organic crop protection programs. Crop Protection 54, 126-133, DOI: 10.1016/j.cropro.2013.08.003.
Van Timmeren, S., L. Horejsi, S. Larson, K. Spink, P. Fanning, R. Isaacs, 2017: Diurnal activity of Drosophila suzukii (Diptera: Drosophilidae) in highbush blueberry and behavioral response to irrigation and application of insecticides, Environmental Entomology 46, 1106–1114, DOI:10.1093/ee/nvx131.
Venette, R.C., W.D. Hutchinson, 2021: Invasive insect Species: Global Challenges, Strategies & Opportunities. Frontiers in Insect Science 1, 650520, DOI: 10.3389/finsc.2021.650520.
Vogt, H., C. Hoffmann, P. Baufeld, 2012: Ein neuer Schädling, die Kirschessigfliege, Drosophila suzukii (Matsumura), bedroht Obst- und Weinkulturen. Entomologische Nachrichten und Berichte 56, 191-196.
Vogt, H. 2020: Ein Winzling lehrt das Fürchten. Die invasive Kirschessigfliege – ein bedeutender Schädling. Biologie in Unserer Zeit 4 (50), DOI: 10.1002/biuz.202010710.
Wallingford, A.K., H.L. Connelly, G.D. Brind'Amour, M.T. Boucher, A. Mafra-Neto, G.M. Loeb, 2016: Field evaluation of an oviposition deterrent for management of spotted-wing drosophila, Drosophila suzukii, and potential nontarget effects. Journal of Economic Entomology 109, 1779-1784, DOI: 10.1093/jee/tow116.
Weber, R.W.S., M. Kockerols, 2016: Die Kirschessigfliege im Steinobst an der Niederelbe 2016. Mitteilungen des Obstbauversuchsringes des Alten Land 71, 303-307.
Werner, D. J., 2005: Nezara viridula (Linnaeus, 1758) in Köln und Deutschland (Heteroptera, Pentatomidae). Heteropteron 21, 29‑30.
Weydert, C., G. Charlot, J.-F. Mandrin, 2014: Insect-proof nets to protect cherry trees from Drosophila suzukii and Rhagoletis cerasi. IOBC wprs, Integrated production of fruit crops (IFP) meeting, Vienna (Austria), October 6-9, 2014. Abstract & Poster.
Wichura, A., A.-P. Entrop, F. Koschnick, 2018: Kirschessigfliege (Drosophila suzukii) im Beerenobst: Bekämpfungsmaßnahmen. Mitteilungen des Obstbauversuchsringes des Alten Land 73, 275-282.
Wiman, N.G., V.M. Walton, D.R. Dalton, G. Anfora, H.J. Burrack, J.C. Chiu, K.M. Daane, A. Grassi, B. Miller, S. Tochen, X. Wang, C. Ioratti, 2014: Integrating temperature-dependent life table data into a matrix projection model for Drosophila suzukii population estimation. PloS One 9, 9, e106909, DOI: 10.1371/journal.pone.0106909.
Wiman, N.G., D.T. Dalton, G. Anfora, A. Biondi, J.C. Chiu, K.M. Daane, B. Gerdeman, A. Gottardello, K.A. Hamby, R. Isaacs, A. Grassi, C. Ioriatti, J.C. Lee, B. Miller, M.V. Rossi Stacconi, P.W. Shearer, L. Tanigoshi, X. Wang, V.M. Walton, 2016: Drosophila suzukii population response to environment and management strategies. Journal of Pest Science 89, 653-665, DOI: 10.1007/s10340-016-0757-4.
Winkler, A, J. Jung, B. Kleinhenz, P. Racca, 2020: A review on temperature and humidity effects on Drosophila suzukii population dynamics. Agricultural and Forest Entomology 22, 179-192, DOI: 10.1007/s10340-016-0757-04.
Wöhner, T., J. Pingerra, E. Fritzsche, A. Peil, M.-V. D. Pinczinger, M.-V. Hanke, 2021: Insights into the susceptibility of raspberries to Drosophila suzukii oviposition. Journal of Applied Entomology 145 (3), 182-190, DOI: 10.1111/jen.12839.
Wolf, S., S. Boycheva-Woltering, J. Romeis, J. Collatz, 2019: Trichopria drosophilae parasitizes Drosophila suzukii in seven common non-crop fruits. Journal of Pest Science, DOI: 10.1007/s10340-019-01180-y.
Yang, Z.-Q., Y.-X. Yao, L.-F. Qiu, Z.-X. Li, 2009: A New Species of Trissolcus (Hymenoptera: Scelionidae) Parasitizing Eggs of Halyomorpha halys (Heteroptera: Pentatomidae) in China with Comments on Its Biology. Annals of the Entomological Society of America 102 (1), 39‑47, DOI: 10.1603/008.102.0104.
Zapponi, L., F. Tortorici, G. Anfora, S. Bardella, M. Bariselli, L. Benvenuto, I. Bernardinelli, A. Butturini, S. Caruso, R. Collar, E. Costie, P. Culatti, E. Di Bella, M. Falagiarda, L. Giovannini et al., 2021: Assessing the Distribution of Exotic Egg Parasitoids of Halyomorpha halys in Europe with a Large-Scale Monitoring Program. Insects 12 (4), 316, DOI: 10.3390/insects12040316.