

Journal für Kulturpflanzen, 74 (03-04). S. 75–84, 2022 | DOI: 10.5073/JfK.2022.03-04.05 | Koch und Petschenka
Exogene Anwendung von RNA zur umweltfreundlichen Bekämpfung von Schadinsekten
Exogenous application of RNA for the eco-friendly control of insect pests
 | Der Autor/Die Autorin 2022 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 17. Januar 2022/1. März 2022 |
In Anbetracht der hohen gesellschaftlichen Forderungen nach nachhaltigen und umweltschonenden Pflanzenschutzverfahren, stellt das Sprühen von RNA-basierten Wirkstoffen eine innovative und vielversprechende Alternative zu konventionellen chemisch-synthetischen Pflanzenschutzmitteln dar. Dabei vermitteln die sequenzspezifischen und somit maßgeschneiderten RNAs nicht nur eine hohe Selektivität, sondern lassen sich zudem sehr schnell adaptieren. Dadurch sind sie, verglichen mit der langwierigen, herkömmlichen Wirkstoffentwicklung, schneller verfügbar. Trotz der vielfältigen Vorteile und des dringenden Bedarfs an Alternativen, stehen wir erst am Anfang des Transfers von RNA Sprays ins Freiland. Hier diskutieren wir die damit verknüpften wissenschaftlich-technischen, gesellschaftlichen und wirtschaftlichen Herausforderungen. Zudem zeigen wir die offenen Forschungsfragen auf, die es zu adressieren gilt, um RNA-basierte Pflanzenschutzmittel zeitnah zu etablieren. Zuletzt führen wir aktuelle Beispiele zu innovativen Lösungsansätzen aus der Forschung an, die die Weiterentwicklung von RNA Sprays für die Kontrolle von Schadinsekten in der Pflanzenproduktion zum Ziel haben. Teile dieses Artikels wurden bereits in einem breiter angelegten englischsprachigen Übersichtsartikel (Rank & Koch 2021) dargestellt und werden hier in einen detaillierteren Kontext eingebettet. Durch die Übersetzung ins Deutsche sollen sie zudem einem erweiterten Leserkreis zugänglich gemacht werden.
RNAi, RNA Spray, RNAi-basierter Pflanzenschutz, nachhaltiger Pflanzenschutz, RNA Biopestizide
Under the perspective of high social demands for sustainable and environmentally friendly crop protection, RNA sprays represent an innovative and promising alternative to conventional synthetic pesticides. Due to sequence specificity, custom-made RNAs not only provide high selectivity but can also be easily adapted to target different species. Consequently, they can be available more quickly compared to the time-consuming development of conventional synthetic pesticides. Despite the multiple benefits and the desperate need for alternatives, field application of RNA sprays is still in its infancy. Here, we discuss the challenges resulting from scientific-technical, social and economic demands. In addition, we identify open research questions that need to be addressed to establish RNAi-based products in a timely manner. Moreover, we highlight recent examples of innovative solutions, which could inspire further optimization of RNA sprays for the control of insect pests in the field. Parts of this article have already been presented in a broader review article (Rank & Koch 2021) and are embedded here into a more detailed context. The presentation in German should also make them accessible to a broader readership.
RNAi, RNA Spray, RNAi-based plant protection, sustainable plant protection, RNA Biopesticides
Kulturpflanzen werden von einer Vielzahl tierischer Schädlinge attackiert. Die durch Arthropoden (Insekten und Milben) herbeigeführten jährlichen Ernteverluste werden auf 18-20 % (> 470 Milliarden USD) geschätzt (Sharma et al., 2017). Neben konventionellen Pflanzenschutzmaßnahmen, wie dem Einsatz chemisch-synthetischer Pflanzenschutzmittel, sind alternative Kontrollstrategien erforderlich, vor allem im Hinblick auf den Umweltschutz und die ständig ansteigenden Zahlen von Resistenzen vieler Schadinsekten gegenüber zugelassenen Wirkstoffen (Alyokhin et al., 2008; Van Leeuwen et al., 2010; Kwon et al., 2016).
Die Einschränkung verfügbarer insektizider Wirkstoffe und Pflanzenschutzmittel (z. B. durch das Verbot der Neonicotinoide) verschärft das Problem, da Wirkstoffe nur noch bedingt rotiert werden können. Insbesondere vor dem Hintergrund des drastischen Biodiversitätsverlustes gewinnt die Forderung nach einer pestizidfreien Landwirtschaft zum Schutz von Nichtzielorganismen und der Umwelt an Bedeutung. Dabei wird der Einsatz von chemisch-synthetischen Pflanzenschutzmitteln als eine der wichtigsten Ursachen des Artensterbens gesehen (Wagner et al., 2021). Vor diesem Hintergrund gilt es neue, innovative Konzepte und Strategien für eine nachhaltigere Pflanzenproduktion zu entwickeln. Der Schutz der Biodiversität hat dabei höchste Priorität und ist von größter gesellschaftspolitischer Relevanz. Er ist Ziel landes1-, bundes2- EU3,4- und UN5,6-weiter Bioökonomiestrategien und des Europäischen „Green Deal“7. Dafür soll der Einsatz chemisch-synthetischer Pflanzenschutzmittel in der Europäischen Union bis 2030 um 50 % reduziert werden. Um diese Ziele zu erreichen, bedarf es innovativer Lösungsansätze und Alternativen, wobei RNA Interferenz (RNAi)-basierte Methoden als besonders vielversprechend gelten (OECD, 2020).
RNAi bezeichnet Genregulationsmechanismen, bei denen kurze, nicht-kodierende RNA-Moleküle, die Expression komplementärer Zielgene unterdrücken (gene silencing). Dabei beruht das Prinzip RNAi-basierter Pflanzenschutztechnologien auf dem molekularen Mechanismus des post-transkriptionellen gene silencing (Abb. 1).
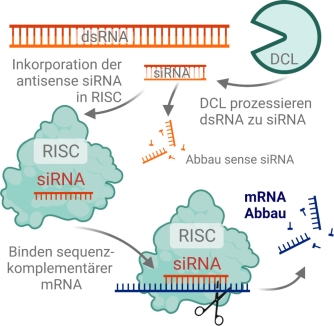
Abb. 1. Das RNAi-vermittelte post-transkriptionelle gene silencing (PTGS) beginnt mit der Zerlegung eines doppelsträngigen Vorläufer-dsRNA-Moleküls in kleine, 21-24 Nukleotide (nt) kurze small interfering (si)RNA Duplets durch ein RNAseIII-ähnliches Enzym genannt Dicer (DCL). Das PTGS findet im Zytoplasma der Zelle statt, wo die doppelsträngigen siRNAs in einen sogenannten RNA-induced silencing complex (RISC) inkorporiert werden. Dieser Multienzym-Komplex beinhaltet ein als Argonaute bezeichnetes Protein, welches sowohl über eine RNA-Binde-Domäne als auch über endonukleolytische Aktivität verfügt. In einer ATP-abhängigen Reaktion wird die siRNA durch RISC entwunden, woraus ein als sense und ein als antisense bezeichneter Strang hervorgehen. Während der sense-Strang, welcher sequenz-identisch mit der zelleigenen mRNA ist, degradiert wird, verbleibt der antisense-Strang an den RISC gebunden und kann nun via komplementärer Basenpaarung spezifisch an endogene Ziel-Transkripte binden und deren Degradierung einleiten. Created with Biorender.com.
Sequenzbasierte Wirkstoffe wie RNAs stellen insbesondere hinsichtlich ihrer Spezifität und der damit verbundenen Schonung von Nichtzielorganismen eine vielversprechende Alternative zu chemisch-synthetischen Pflanzenschutzmitteln dar. Zahlreiche Studien konnten die Effektivität RNAi-basierter Pflanzenschutztechnologien zur Kontrolle von Pathogenen und Schadinsekten in der Landwirtschaft und im Gartenbau bereits eindrucksvoll unter Beweis stellen (Überblick siehe: Koch & Kogel, 2014; Gaffar & Koch, 2019; Rank & Koch, 2021). Mithilfe dieser Technologie lassen sich Schadinsekten mit einer Wirksamkeit von durchschnittlich 50 % kontrollieren (max. Effektivität >80 %) (Koch & Wassenegger, 2021).
Diese Faktoren haben die Entwicklung RNAi-modifizierter Pflanzen bis zur Marktreife vorangetrieben (De Schutter et al., 2022). Das erste Produkt, der „SmartStax Pro“ Mais (Mon87411, Bayer) wurde 2017 von den US-Behörden und zuletzt 2021 auch von den chinesischen Behörden zugelassen. Dieser gentechnisch veränderte Mais exprimiert einerseits das CP4-EPSPS-Protein, welches eine erhöhte Toleranz gegenüber glyphosathaltigen Herbiziden bedingt und andererseits das aus Bacillus thuringiensis (Bt) stammende Cry3Bb1-Protein sowie eine doppelsträngige RNA (DvSnf7-dsRNA), welche Resistenz gegen Maiswurzelbohrer (Diabrotica spp.) verleihen. „SmartStax Pro“ wird Landwirten in den USA ab 2022 zur Verfügung stehen. In Europa hat der „SmartStax Pro“ Mais eine Marktzulassung für alle Verwendungszwecke (bspw. Einfuhr von Mon8741-haltigen Produkten) außer dem Anbau8.
Während der Anbau und der Verzehr von GV-Pflanzen in weiten Teilen der Welt (USA, Brasilien, Argentinien, Kanada und Indien) etabliert ist (91 % des globalen GVO-Anbaus), findet in Europa, mit Ausnahme von Spanien und Portugal, kein Anbau von gentechnisch veränderten Kulturpflanzen statt9. Neben gesellschaftlichen Vorbehalten kommt hinzu, dass die Generierung von GV-Pflanzen sehr kompliziert ist und deren Zulassung immense Kosten verursacht. Insbesondere deshalb ist die exogene, GVO-freie Applikation von dsRNA so erstrebenswert. Bei dem sogenannten „spray-induced gene silencing“ Verfahren (Koch et al., 2016; Wang et al., 2016) werden vor allem doppelsträngige RNAs (dsRNAs), die RNAi auslösen, auf Pflanzen gesprüht. Diese dsRNAs werden dann durch Schaderreger direkt gefressen oder es werden aus den Wirtspflanzen dort gebildete siRNAs aufgenommen (Abb. 2), wodurch das RNAi-vermittelte gene silencing im Zielorganismus dessen Tod oder Schwächung bewirkt.
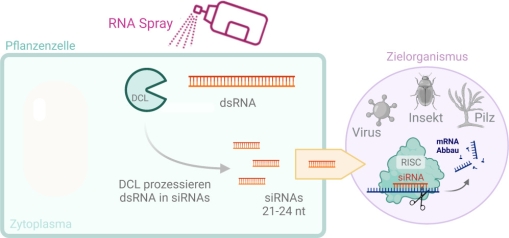
Abb. 2. Prinzip Spray-induced gene silencing. Created with BioRender.com
Dabei wird das Prinzip der exogenen dsRNA- und siRNA-Applikation (z. B. durch Injektion oder Verfütterung) gegen verschiedene Organismen (darunter Schadinsekten und Milben) seit vielen Jahren routinemäßig beispielsweise zur Aufklärung von Genfunktionen oder zur Identifizierung geeigneter RNAi-Zielgene für den Pflanzenschutz (oftmals in Hochdurchsatzverfahren) angewandt (Lü et al., 2020; Máximo et al., 2020; Mehlhorn et al., 2020).
Beim Sprühen von dsRNA differenziert man im Hinblick auf die unterschiedlichen Ernährungsweisen von Schadinsekten (stechend-saugend vs. kauend-beißend) im Wesentlichen zwischen zwei Expositionsrouten. RNA-Wirkstoffe, welche vor allem dahingehend modifiziert wurden, dass sie eine hohe Oberflächenstabilität und -anhaftung zeigen, können dabei als besonders wirksam gegen blattfressende Schadinsekten (bspw. Kartoffelkäfer) gesehen werden. Im Gegensatz dazu müssen gegen stechend-saugende Schadinsekten (bspw. Blattläuse oder Zikaden) gerichtete dsRNAs/siRNAs so optimiert werden, dass eine bestmögliche Aufnahme ins Blattinnere (Apoplast/Interzellularraum) sowie eine zelluläre Aufnahme (Phloem und Xylem) und eine systemische Ausbreitung in der Pflanze gewährleistet ist. Diese RNA-Wirkstoffe müssen zunächst vor dem Abbau durch pflanzeneigene Ribonukleasen geschützt werden, um eine möglichst langanhaltende Persistenz entlang der Transportwege innerhalb der Pflanze zu garantieren, bevor sie beispielsweise durch pflanzensaftsaugende Schadinsekten aufgenommen werden. Mit Aufnahme in den Zielorganismus, muss der RNA-Wirkstoff wenigstens so lange stabil sein und vor Abbau geschützt werden, bis er an seinen Wirkungsort, d. h. die Ziel-mRNA in den Insektenzellen gelangt ist. Derzeit versuchen Wissenschaftler*innen daher, sukzessive verschiedenste Parameter zu optimieren, um die RNA Spray Technologie kontinuierlich praxistauglicher zu machen, d. h. zugunsten höherer Effektivität und Selektivität weiterzuentwickeln. In diesem Zusammenhang ist das größte Potential sicher im Bereich der Formulierung und der Darreichungsform zu erwarten.
Eine kürzlich veröffentlichte Studie dokumentiert die Effektivität von RNA Sprays gegen Henosepilachna vigintioctopunctata („Hadda beetle“) (Wu et al., 2021), einer herbivoren Marienkäferart, die beispielsweise in Indien eine Rolle als Schädling vor allem an Nachtschatten- und Kürbisgewächsen spielt. Das Sprühen von in E. coli hergestellten dsRNAs, die gegen die für einen Ecdyson-Rezeptor (EcR-Gen) des Marienkäfers kodierende mRNA gerichtet waren, war auf Kartoffelpflanzen sehr effizient. Durch die Applikation nahm die Mortalität der Marienkäferlarven zu, wodurch eine deutliche Reduktion der Blattschäden erreicht wurde (Wu et al., 2021). Zwei weitere Studien bestätigten den erfolgreichen Einsatz der RNAi Technologie gegen H. vigintioctopunctata und unterstreichen das Potential RNAi-basierter Wirkstoffe als eine nachhaltige Alternative zum konventionellen chemischen Pflanzenschutz bei der Kontrolle von Schadinsekten (Lü et al., 2020, 2021).
Ein weiterer Schädling, der durch RNA Sprays effektiv bekämpft werden kann, ist der Kartoffelkäfer, Leptinotarsa decemlineata (Mehlhorn et al., 2020), eines der wirtschaftlich bedeutsamsten Schadinsekten an Kartoffeln (Hare, 1990). Im Fokus der 2020 veröffentlichten Studie stand der Vergleich der RNAi Sensitivität 14 verschiedener L. decemlineata Populationen aus Europa (Deutschland, Niederlande, Portugal, Spanien, Italien, Ungarn, Ukraine, Rumänien). Interessanterweise fanden die Autoren auf Populationsebene nur eine geringe Variabilität der durch RNAi verursachten Phänotypen. Lediglich eine spanisch-stämmige Population zeigte eine erhöhte Widerstandfähigkeit gegenüber der RNA Applikation, wobei die Käfer dennoch molekular responsiv waren; das heißt die Expression des Zielgens Actin war mit ca. 80%iger Verminderung vergleichbar mit dem Transkriptlevel der übrigen analysierten Kartoffelkäfer-Genotypen (Mehlhorn et al., 2020). Diese Studie liefert damit erste, wertvolle Erkenntnisse zur Variation von RNAi auf Populationsebene und verspricht eine universelle Anwendbarkeit von RNA-Biopestiziden auf alle Populationen eines Schaderregers. Gleichzeitig verspricht die Studie die Übertragbarkeit auf Schadinsekten vom Labor ins Freiland. In diesem Zusammenhang dokumentiert eine kürzlich veröffentliche Studie die Wirksamkeit einer 490 bp dsRNA, welche die Proteasom Untereinheit Beta Typ 5 des Kartoffelkäfers targetiert (Rodrigues et al., 2021). Diese Studie ist nicht nur ein weiterer Beleg für die Effektivität von RNA Sprays, vielmehr handelt es sich um das erste marktreife RNA Biopestizid überhaupt. Die vom Unternehmen GreenLight Biosciences entwickelte dsRNA „Ledprona“ befindet sich aktuell in der Begutachtung durch die Environmental Protection Agency (EPA, USA), wobei GreenLight Biosciences das Testen des Ledprona Wirkstoffes (CAS No. 2433753-68-3) an Kartoffeln in Freilandversuchen in 11 Bundesstaaten der USA im Zeitraum von einem Jahr (Beginn 01. April 2022) beantragt hat10.
Exogen applizierte RNAs werden zunächst über die Blätter der Nahrungspflanzen aufgenommen, bevor sie sich dort über das Vaskulargewebe weiter verteilen (Koch et al., 2016; Biedenkopf et al., 2020). Dieser Umstand legt nahe, dass vor allem an Blättern fressende oder saugende Schadinsekten mit gesprühten RNAs effizient kontrolliert werden können (Abb. 3).
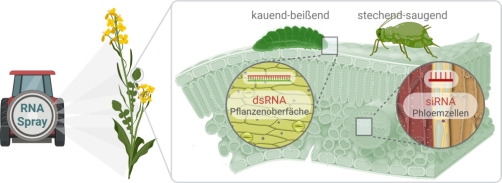
Abb. 3. Vergleich RNA Aufnahme zwischen verschiedenen Typen der Nahrungsaufnahme. Created with BioRender.com
Um auch Schadinsekten beispielsweise an Knospen, Blüten oder Ähren bekämpfen zu können, ist daher die Frage entscheidend, inwiefern auch andere Pflanzenorgane gesprühte RNAs aufnehmen oder ob blattapplizierte RNAs in andere Teile der Pflanze transportiert werden oder sich dort ggf. sogar anreichern. Dies ist relevant, da eine Vielzahl wichtiger Schadinsekten auch Blüten oder Früchte befallen. In diesem Zusammenhang konnte eine 2021 veröffentlichte Studie zeigen, dass die Verfütterung von mit dsRNA-beschichteten Rapsknospen die Überlebensrate des Rapsglanzkäfers Brassicogethes aeneus erheblich beeinträchtigte (Willow et al., 2020).
Im Vergleich zur systemischen Applikation, ist die Aufnahme von mit RNA besprühten Pflanzengeweben wahrscheinlich unmittelbarer zu realisieren, da hier die technische Herausforderung auf die Gewährleistung der RNA Stabilität und die Adhärenz auf der Pflanzenoberfläche beschränkt ist. Dabei müssen die RNAs vor Umwelteinflüssen, wie beispielsweise Abbau durch UV-Strahlung oder Abwaschen durch Regen geschützt werden. Die weit größere Herausforderung besteht darin, exogen applizierte RNAs zusätzlich nach Aufnahme in die Pflanze und in den Zielorganismus zu stabilisieren. Außerdem muss gewährleistet sein, dass sowohl ausreichend RNA in die pflanzlichen/tierischen Zellen aufgenommen wird als auch anschließend frei im Cytoplasma vorliegt (endosomal escape). Deshalb müssen die zugrundeliegenden molekularen Mechanismen genau verstanden werden, um Strategien zur Optimierung, beispielsweise Formulierungen, daraus abzuleiten.
Die Bekämpfung von stechend-saugenden Insekten durch RNA Sprays erfordert die Aufnahme in die pflanzlichen Zellen und die systemische Verteilung der RNA über das Phloem (Abb. 3). In diesem Zusammenhang konnte nach Sprühen einer fluoreszenzmarkierten dsRNA auf Gerstenblätter und anschließender Konfokalmikroskopie der Blattlängsschnitte die applizierte RNA in Parenchymzellen des Phloems, Geleitzellen und Mesophyllzellen sowie in Trichomen und Spaltöffnungen gefunden werden (Koch et al., 2016). Obwohl verschiedene Studien den systemischen Transport gesprühter RNAs nachweisen konnten (Koch et al., 2016; Konakalla et al., 2016; Kaldis et al., 2018; Biedenkopf et al., 2020), ist weiterhin unklar, inwiefern Verdünnungseffekte der transportierten RNAs deren Wirksamkeit beeinträchtigen. Deshalb ist es besonders relevant, dass die Transportrouten aufgeklärt werden, um zu klären, ob beispielsweise die Konzentration von Phloem-lokalisierten RNAs ausreicht, um nach Aufnahme durch phloemsaftsaugende Schadinsekten wie Blattläuse ein gene silencing zu induzieren. In diesem Zusammenhang konnte bereits gezeigt werden, dass das Sprühen von dsRNA gegen das SHP-Gen der Getreideblattlaus Sitobion avenae, eine RNAi-bedingte 50%ige Reduktion der mRNA Transkriptmenge des Zielgens zur Folge hatte (Biedenkopf et al., 2020). Allerdings wurden diese Experimente an abgeschnittenen Gerstenblättern durchgeführt, wobei die Blattläuse nur wenige Zentimeter von der RNA Applikationsstelle entfernt saugten. Demzufolge war die lokale Konzentration der RNA vermutlich entsprechend hoch und nicht repräsentativ für RNA Konzentrationen weiter weg von der Applikationsstelle (entfernte Blattetagen, Stängel und Wurzeln). Umso entscheidender sind Beobachtungen aus der gleichen Studie, dass sich die gesprühte RNA innerhalb von drei Tagen nach Applikation auf Gerstenblätter über die Stängel bis zum Wurzelgewebe verteilte (Biedenkopf et al., 2020). Dies ist besonders relevant für die Bekämpfung von wurzelfressenden bodenbürtigen Schaderregern, da die direkte Bodenapplikation von RNA bislang immer deren unmittelbaren Abbau zur Folge hatte (Dubelman et al., 2014; Parker et al., 2019; Bachman et al., 2020; Qiao et al., 2021). Dennoch ist auch hier fraglich, inwiefern der systemische Transport und die damit einhergehende Verdünnung eine mehrmalige RNA Applikation notwendig machen könnte. Angesichts dieser Unklarheiten plädieren einige Wissenschaftler*innen dafür, Symbiosen von Pflanzen und Bakterien zu nutzen und postulieren, dass biotechnologisch modifizierten Symbionten als Vektoren zur dauerhaften dsRNA Produktion in Pflanzen eingesetzt werden könnten (Whitten et al., 2016; Whitten & Dyson, 2017).
Es ist wichtig zu betonen, dass auch die Bekämpfung von stechend-saugenden Schadinsekten durch RNA Sprays nicht zwangsläufig die Aufnahme der RNA in die Nahrungspflanzen erfordert (Thairu et al., 2017; Niu et al., 2019; Linyu et al., 2021). Aufgrund von Schwierigkeiten bei der oralen Verabreichung von dsRNA an Blattläuse haben Wissenschaftler*innen eine Methode zur RNAi-Induktion in der Erbsenblattlaus Acyrthosiphon pisum entwickelt, die auf dem Besprühen der Blattläuse selbst beruht (Niu et al., 2019). Ähnliches wurde in einer kürzlich publizierten Studie gezeigt (Linyu et al., 2021). Die Autoren verwendeten eine Nanopartikel-basierte Technologie, sogenannte Nanocarrier SPc (Star Polycation) für eine verbesserte transdermale Passage und effizientere Aufnahme in die Zielzellen der Blattlaus Aphis gossypii (Linyu et al., 2021). Beide Studien implizieren eindrucksvoll die Sensitivität und Effektivität von RNA-Blattlaussprays, wodurch eine Aufnahme in die Pflanze (und damit die Ungewissheit über Persistenz, Perfusionsgrad und Verdünnung) obsolet wird. Möglicherweise stellen derartige Verfahren einen vielversprechenden Ansatz für die direkte Behandlung eines Blattlausbefalls dar, wenngleich weniger zweckmäßig als Präventivmaßnahme. Trotz des Potenzials muss zunächst untersucht werden, inwieweit Blattlaussprays unter Realbedingungen wirksam sind und inwiefern sich dieser Ansatz (transdermale Formulierungen) auf andere Schadinsekten übertragen lässt oder sich von anderen Kontaktinsektiziden abgrenzt. Darüber hinaus könnte die Entwicklung von Formulierungen, welche die Steuerung der transdermalen Passage vielleicht sogar in einem schädlingsspezifischen Kontext ermöglichen, im Kontext der Selektivität zur Vermeidung von Off-Target-Effekten sehr interessant sein.
Der Mangel an zuverlässigen Daten aus Freilandversuchen oder unter simulierten Freilandbedingungen erschwert Vorhersagen zur Effektivität von RNA Sprays im Freiland. Aus diesem Grund werden verschiedene Szenarien angenommen und neue Herausforderungen der Applikation von RNA unter Realbedingungen antizipiert. Dabei sind verschiedene Aspekte miteinander verknüpft. Zum Beispiel werden die Konzentrationen der zu sprühenden RNA Wirkstoffe je nach Pflanzenspezies variieren, weil bestimmte Pflanzeneigenschaften die RNA Aufnahme und Stabilität (z. B. Cuticula, Stomatadichte) sowohl begünstigen als auch erschweren werden. Davon wird nicht nur die Auftragsmenge, sondern vielmehr auch die Applikationshäufigkeit abhängen, was sich unmittelbar auf die Kostenkalkulation auswirken wird. Außerdem werden die jeweiligen Standort- und Umweltbedingungen die Wirksamkeit unmittelbar beeinflussen. Des Weiteren unterscheiden sich im Freiland gewachsene Pflanzen deutlich von Pflanzen, die unter kontrollierten Bedingungen angezogen wurden. Dabei ist es sehr wahrscheinlich, dass Unterschiede in Morphologie, Physiologie bis hin zur (Epi)Genetik die Sensitivität gegenüber RNA Sprays beeinflussen. All dies sind Zusammenhänge, die wir gerade erst beginnen, zu verstehen.
Weitere Herausforderungen liegen in der Ökonomie und Wirtschaftlichkeit dieser neuen Technologie im Vergleich zu herkömmlichen Pflanzenschutzmitteln. Bis vor wenigen Jahren kostete bereits die Produktion von wenigen Gramm dsRNA über 100.000 US-Dollar. Seitdem sind die Synthesekosten drastisch gesunken. Aktuellen Schätzungen zufolge wird es schon bald möglich sein, dsRNA für unter zwei US-Dollar pro Gramm zu produzieren11. Damit ist aber noch nicht garantiert, dass RNA Sprays mit den Preisen gängiger Pflanzenschutzmittel konkurrieren können. Der Preis für gängige Fungizide bei einmaliger Anwendung liegt bei ca. 17 bis 55 US-Dollar/ha. Für eine effektive Behandlung sind in Laborversuchen (Gerste-Fusarium) eine Menge von 10 μg dsRNA für eine Fläche von 50 cm2 nötig. Würde man diese Aufwandsmenge auf einen Hektar Fläche hochrechnen, wären ca. 20 g dsRNA erforderlich. Bei Produktionskosten von 2 US-Dollar/g würde der Preis für eine einmalige Spritzanwendung mit reiner (nicht-formulierter) dsRNA somit bei ca. 40 US-Dollar/ha, und damit vergleichbar zu gängigen Fungiziden, liegen. Wäre eine längere Schutzwirkung (bis zu 3 Wochen) durch spezifische Formulierungen (bspw. BioClay (Mitter et al., 2017) gegeben, könnte sich der Einsatz von RNA Sprays sogar als rentabler herausstellen, da gängige Fungizide gegen viele Schaderreger keinen Langzeitschutz bieten. Bestenfalls gelingt es, die Herstellungskosten der RNA Wirkstoffe weiter zu reduzieren, sodass Auftragsmenge und -häufigkeit (abhängig von Kultur und Erreger) sowie Rentabilität im Vergleich zu chemisch-synthetischen Pestiziden sogar günstiger werden.
Allein die Senkung der Produktionskosten wird jedoch nicht ausreichen, da auch die Menge an ausgebrachter RNA minimiert werden soll, um mögliche Risiken für Umwelt, Anwender oder Verbraucher zu vermeiden. Deshalb ist es entscheidend, dass wir die Mechanismen und Faktoren, die die Aufnahme, den Transport, die Stabilität und den Abbau von gesprühten RNAs bestimmen, möglichst detailliert aufschlüsseln. Damit können wir nicht nur die Effektivität erhöhen, sondern vielmehr präzise die erforderliche Mindestkonzentration ermitteln. Hierbei wird vor allem die Entwicklung innovativer Formulierungen der Wirkstoffe in Abhängigkeit von der Kulturpflanze und dem zu bekämpfenden Schaderreger einen entscheidenden Beitrag leisten.
Mit Hilfe neuester Formulierungen werden RNAs verkapselt, wodurch eine gerichtete Aufnahme in die Zielzellen (der Pflanze und/oder des Schaderregers) und die Freisetzung im Zellinneren ermöglicht wird. Dabei sind Formulierungen zur Verkapselung oder zum Verpacken von RNA besonders elegant, weil sie auf vielfältige Weise für verschiedene Problemstellungen ggf. eine unmittelbare Lösung bieten. Zunächst werden die RNAs vor schädigenden Umweltfaktoren (z. B. UV-Strahlung) abgeschirmt, wodurch sich ihre Langlebigkeit im Vergleich zu „nackten“ RNAs wesentlich erhöht (Rank & Koch 2021). In diesem Kontext können auch Organismen auf eine duale Weise genutzt werden. Transformierte Zellen von E. coli werden beispielsweise nicht nur für die kostengünstige Produktion von dsRNA verwendet, sondern stellen gleichsam auch eine Schutzhülle für die produzierte RNA dar (Lü et al., 2020; Máximo et al., 2020; Wang et al., 2021; Wu et al., 2021). Bei ausreichender Kapselgröße, kann zudem auch die Aufnahme von dsRNA in die Pflanze verhindert werden. Damit kann die Prozessierung der dsRNA durch pflanzliche Dicer (Endonuklease) umgangenen werden, was in einigen berichteten Fällen eine Steigerung der Effektivität zur Folge hatte. Zum Beispiel resultierte die Expression von dsRNA in Chloroplasten (Dicer-freie Organellen) gegen das ß-Actin Gen von L. decemlineata in einer gesteigerten Mortalität der Larven (Zhang et al., 2015). Auch bei der Kontrolle des Getreidepilzes Fusarium graminearum hat sich gezeigt, dass die Aufnahme von dsRNA und deren Prozessierung durch die pilzlichen Dicer selbst (und nicht durch die pflanzlichen) eine wichtige Voraussetzung für das Silencing der Zielgene im Pilz darstellt (Koch et al., 2016; Gaffar et al., 2019). Darüber hinaus kann das Verkapseln auch nach zellulärer Aufnahme vor dem enzymatischen Abbau durch Ribonukleasen oder anderen destabilisierenden Bedingungen (z. B. extremer pH-Wert) in der Pflanze und/oder dem Schadinsekt schützen. Von verschiedenen Insekten weiß man bereits, dass sie über die Fähigkeit verfügen, dsRNA abzubauen (Singh et al., 2017), wofür Nukleasen verantwortlich sind (Peng et al., 2018). Zusätzlich ist der Abbau von dsRNA im Darm der Insekten besonders hoch (Peng et al., 2018). Durch Chitosan-basierte Nanopartikel konnte jedoch dsRNA vor Abbau durch Nukleasen und den Einflüssen des Darm-pH in Raupen des Eulenfalters Helicoverpa armigera geschützt werden (Kolge et al., 2021). Darüber hinaus können weitere dsRNAs mitverpackt werden, um beispielsweise Negativregulatoren des RNAi Mechanismus sowie Enzyme des Fremdstoffwechsels (bspw. P450 s, oder ABC Transporter) herunterzuregulieren (Sharma et al., 2021; Wang et al., 2021). Damit könnte man ebenso wie durch Beigabe von Nukleaseinhibitoren die Wirksamkeit gesprühter RNAs erhöhen.
Weiterhin kann über die Kapsel die Blattanhaftung verbessert und damit das Abwaschen durch Bewässerungsmaßnahmen oder Regen vermindert werden. So können bisher bereits geringe Niederschlagsmengen ein fast vollständiges Abwaschen von Pflanzenschutzverbindungen herbeiführen (Hunsche et al., 2011) und somit ihre Wirksamkeit drastisch mindern. In diesem Zusammenhang konnte durch vorausgegangene Studien das große Potential von sogenannten Mikrogelen zur regenfesten Anbindung von Zielsubstanzen an Pflanzenoberflächen bereits verdeutlicht werden (Meurer et al., 2017). In einem aktuell durch das Bundesministerium für Ernährung und Landwirtschaft-geförderten Drittmittelprojekt (Akronym: ho[RtikulturNA]12) sollen, um eine möglichst lang andauernde Schutzwirkung von applizierten RNA Biopestiziden unter Freilandbedingungen zu erzielen, die dsRNAs in Mikrogel-Container verpackt werden, um diese vor äußeren Einflüssen wie Regen oder UV-Strahlung, aber auch RNA-abbauenden Enzymen (Ribonukleasen) zu schützen13.
Neben der Erhöhung der Stabilität gegenüber Umweltfaktoren oder der vorzeitigen Prozessierung durch Dicer, kann durch das Verkapseln auch die Selektivität unter Freilandbedingungen verbessert werden. Insbesondere die Formulierung auf Nanomaterialbasis kann helfen, die Selektivität zu erhöhen, nicht nur durch Abschirmung der dsRNA von der Umwelt, sondern auch durch Bereitstellung einer zielortspezifischen RNA-Freisetzung oder Selektivität, die durch Lockstoffe erleichtert wird, die in die Kapselhülle eingearbeitet werden, so dass die Kapseln nach dem attract-and-kill Prinzip funktionieren.
Trotz der Entwicklung von „Ledprona“ und der zahlreichen Proof-of-Concept-Studien, die das Potenzial von RNA Wirkstoffen im Pflanzenschutz verdeutlichen, ist die Anwendung im Freiland noch immer wenig erprobt. Damit zusammenhängend stehen wir vor komplexen und vielschichtigen wissenschaftlich-technischen (Stabilität, Selektivität und breite Anwendbarkeit) sowie gesellschaftspolitischen (Akzeptanz, Zulassung und Regulierung) Herausforderungen. Um diesen Anforderungen zu entsprechen, wurden erhebliche Fortschritte in der Weiterentwicklung von RNA Sprays erzielt, beispielsweise durch Nanotechnologie-basierte Formulierungen, deren Entwicklung nun aufgrund der Nachfrage und dem Bedarf an mRNA Impfstoffen rasant voranschreitet. Davon kann auch der RNA Spray-basierte Pflanzenschutz profitieren, zumal viele der bereits verwendeten Formulierungen durch die medizinische Anwendung inspiriert wurden. Allerdings muss das Verhalten von nanoformulierten RNAs unter Realbedingungen noch untersucht und beurteilt werden. Außerdem benötigen wir dringend mehr Forschung zur Persistenz und Bioabbaubarkeit von gesprühten RNAs, um eine adäquate Risikobewertung durchführen zu können. Zur optimalen Wirksamkeit sollen einerseits die RNAs möglichst stabil und langlebig und andererseits schnell und rückstandlos abbaubar sein, um die Umwelt nicht zu belasten. Hierfür bedarf es innovativer Lösungsansätze, welche u. a. in der Fusion oder dem Transfer verschiedener Technologien liegen.
Der Bedarf an neuen Verfahren zur Reduktion chemisch-synthetischer Pflanzenschutzmittel und zum Schutz der Biodiversität ist enorm und angesichts der immer lauter werdenden gesellschaftspolitischen Forderungen sollten Alternativen möglichst schnell verfügbar sein. Im Zuge dessen drängen sich etliche Fragen aus unterschiedlichen Perspektiven auf – hinsichtlich der Handhabung durch potenzielle Anwender*innen u. a.:
Wann, wie oft und in welchen Mengen müssen die RNAs ausgebracht werden?
Gibt es besondere Anforderungen für die Handhabung und Lagerung von RNA Wirkstoffen?
Was werden RNA Biopestizide kosten?
Für welche Kulturen und Schaderreger werden Wirkstoffe verfügbar sein?
Weitere Fragen entstehen seitens der Umwelt- und Verbraucherschützer*innen:
Ist der Verzehr von RNA-behandelten Erzeugnissen unbedenklich?
Werden die Lebensmittel teurer sein?
Welche Auswirkungen hat das Sprühen von RNA für lokale Ökosysteme?
Werden sich die RNAs im Boden oder im Wasser anreichern?
Aus unternehmerischer Sicht:
Was wird die Zulassung von RNA Wirkstoffen kosten?
Wie werden diese reguliert?
Ist mit Resistenzentwicklung zu rechnen?
Werden RNA Wirkstoffe öffentlich akzeptiert?
Einige der Fragen oder Bedenken können wir schon heute adressieren. Zum Beispiel ob und welche Risiken vom Verzehr von mit RNA behandelten Lebensmitteln oder daraus gewonnenen Erzeugnissen ausgehen. Grundsätzlich besitzen die aufgenommenen RNAs genregulatorisches Potenzial, denn sie binden komplementäre mRNAs und interferieren mit deren Translation in ein funktionelles Protein. Die Frage ist also, ob die RNAs im Menschen oder anderen Nichtzielorganismen unspezifische, nicht-intendierte sogenannte off-target Effekte hervorrufen können. In diesem Zusammenhang sammelte und beurteilte ein kürzlich publizierter Übersichtsartikel die Beweise für und gegen die Übertragung von mit der Nahrung aufgenommenen miRNAs aus Pflanzen, Fleisch und Milch und deren genregulatorische Funktion (Mar-Aguilar et al., 2020; del Pozo-Acebo et al., 2021). Die Autoren kamen zu dem Schluss, dass die Übertragung von miRNAs aus der Nahrung ins Blut nicht schlüssig und belastbar dargelegt wurde und, dass die Hauptursache für die kontroverse Beurteilung durch nicht reproduzierbare Daten zustande kommt. Derzeit stuft die Europäischen Behörde für Lebensmittelsicherheit (EFSA) das Sprühen von RNA als sicher ein (Dávalos et al., 2019). Die Risiken einer dysfunktionalen Genexpression ausgelöst durch den Verzehr von RNAi-Produkten beim Menschen sei gering. Das entscheidende Argument war, dass nach der oralen Aufnahme von RNA zu viele biologische und physikalische Barrieren überwunden werden müssten, weshalb es wahrscheinlicher ist, dass sie, bevor sie eine potenzielle off-Target mRNA binden, abgebaut werden (Schiemann et al., 2019; Kleter, 2020). Allerdings mangelt es bislang an wissenschaftlich fundierten und belastbaren Daten zur Umwelt-, Verbraucher- und Anwendersicherheit von RNA Sprays, insbesondere deren neuartigen Formulierungen. Erste, vorläufige Daten zum Verbleib in der Umwelt (Persistenz und Abbaubarkeit) von gesprühten dsRNAs deuten auf einen schnellen Abbau, also geringe Persistenz nach Bodenaufnahme hin (Parker et al., 2019; Bachman et al., 2020).
Außerdem wurden erste, wichtige Erkenntnisse im Zusammenhang mit der Wahrscheinlichkeit von Resistenzbildungen erzielt. Eine erste Studie wurde 2018 von Monsanto (Khajuria et al., 2018) veröffentlicht, mit dem Ziel mögliche Resistenzmechanismen gegen dsRNAs in Insekten zu charakterisieren. Dabei wurde eine Population des Maiswurzelbohrers Diabrotica virgifera virgifera gezielt auf eine dsRNA(DvSnf7)-Resistenz selektiert. Die Resistenz manifestierte sich darin, dass die Tiere die Mais-exprimierte DvSnf7 dsRNA nicht über den Darm aufnehmen konnten. Diese Aufnahmeunfähigkeit war sequenzunabhängig und zeigte sich auch nach Injektion der dsRNA in die Hämolymphe. Die Erkenntnisse dieser Studie bildeten die Grundlage zur Entwicklung des gentechnisch-modifizierten Mais SmartStaxPro, wobei der Resistenzentwicklung durch die „smarte“ Kombination verschiedener Wirkstoffe mit unterschiedlichem mode-of-action entgegengewirkt werden soll (s. o.). Darüber hinaus kam eine Folgestudie zu dem Schluss, dass das Auftreten von Resistenzen durch exogene RNA Applikation im Vergleich zu HIGS-basierter Exposition sehr viel wahrscheinlicher sei (Mishra et al., 2021), wodurch RNA Biopestizide wie „Ledprona“ verglichen mit SmartStaxPro vermeintlich schlechter abschneiden. Inwiefern die künstlich selektierten Resistenzen die natürlichen Entwicklungen abbilden, bleibt jedoch unklar. Darüber hinaus bleibt offen, inwiefern diese Szenarien für andere Schadinsekten, die weniger schnell Wirkstoffresistenzen ausbilden als der Maiswurzelbohrer (Meinke et al., 2021) und der Kartoffelkäfer (Alyokhin et al., 2008) zutreffen würden.
Trotz erster wichtiger Erkenntnisse sind noch viele Fragen offen und müssen zunächst durch weitere Studien und in Zusammenarbeit mit den verantwortlichen Behörden, Interessenverbänden und der Politik erarbeitet werden. Dabei müssen die Vorteile dieser Technologie in Abgrenzung zu bereits bestehenden Verfahren deutlicher herausausgestellt werden. Ein entscheidendes Argument für die Anwendung von RNA Sprays liegt insbesondere in der hohen Selektivität und der Möglichkeit mit Sequenz-basierten Wirkstoffen sehr schnell und präzise auf neue oder plötzlich auftretende Krankheitserreger sowie damit verbundene Epidemien reagieren zu können (z. B. Schilfglasflügelzikade). Wie wichtig dies ist, wurde uns durch das Auftreten der Virusvariante SARS-CoV-2 2020 bewusst, wobei sich die Schwere und Konsequenz von Epidemien unmittelbar auf Bereiche der Nahrungsmittelproduktion übertragen lässt. Die Vorteile von Biopestiziden auf RNA Basis werden allerdings nur dann Bestand haben, wenn diese ein modifiziertes und kürzeres Zulassungsverfahren durchlaufen. Wenngleich diese Möglichkeit seitens der EU besteht/eingeräumt wird (EC, 2009), existiert aktuell kein spezifisches Leitliniendokument zur Beurteilung von RNA-basierten Wirkstoffen (Schenkel & Gathmann, 2021). Möglicherweise wird „Ledprona“ hier den Weg für die zukünftige Zulassung weiterer RNA Biopestizide ebnen (Rodrigues et al., 2021), wobei die Risikobeurteilung vermutlich zunächst auf Einzelfallbasis stattfinden wird. Gründe hierfür sind spezifische Entwicklungen, wie bspw. der Einsatz spezifisch-entwickelter Formulierungen die RNA Stabilität und die zelluläre Aufnahme topisch applizierter RNAs verbessern sollen sowie die Kombination verschiedener RNA Wirkstoffe, wodurch neue Frage hinsichtlich des Umweltverhaltens (z. B. Abbaubarkeit, Anreicherung) entstehen, die es von Fall zu Fall zu beantworten gilt.
Aus den genannten Gründen sehen sich Wissenschaftler*innen weltweit in der Verantwortung, bestehende Konzepte vor den aktuellen Herausforderungen (nachhaltiges, biobasiertes Wirtschaften, Schonung natürlicher Ressourcen und der Umwelt, Stärkung der Biodiversität) neu zu beurteilen. Vor allem wird es darauf ankommen, dass wir unser Wissen zu den zugrundeliegenden molekularen Mechanismen weiter vertiefen und neue Erkenntnisse kontinuierlich und unmittelbar in die Weiterentwicklung integrieren.
Dieser Artikel steht im Kontext zweier durch den Bund und eines durch das Land Baden-Württemberg geförderten Drittmittelprojekte. Wir bedanken uns explizit bei den Fördermittelgebern des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) (Förderkennzeichen: 2819NA060), des Ministeriums für Ernährung, Ländlichen Raum und Verbraucherschutz Baden-Württemberg (MLR) (Förderkennzeichen: BWFE120181) und dem QS-Wissenschaftsfonds Obst, Gemüse und Kartoffeln (Akronym: RNAbait).
Die Autoren/die Autorinnen erklären, dass keine Interessenskonflikte vorliegen.
Alyokhin, A., M. Baker, D. Mota-Sanchez, G. Dively, E. Grafius, 2008: Colorado Potato Beetle Resistance to Insecticides. American Journal of Potato Research 85, 395–413. DOI: 10.1007/s12230-008-9052-0.
Bachman, P., J. Fischer, Z. Song, E. Urbanczyk-Wochniak, G. Watson, 2020: Environmental Fate and Dissipation of Applied dsRNA in Soil, Aquatic Systems, and Plants. Frontiers in Plant Science 11, 21, DOI: 10.3389/fpls.2020.00021.
Biedenkopf, D., T. Will, T. Knauer, L. Jelonek, A.C.U. Furch, T. Busche, A. Koch, 2020: Systemic spreading of exogenous applied RNA biopesticides in the crop plant Hordeum vulgare. ExRNA 2, 12, DOI: 10.1186/s41544-020-00052-3.
Dávalos, A., R. Henriques, M.J. Latasa, M. Laparra, M. Coca, 2019: Literature review of baseline information on non-coding RNA (ncRNA) to support the risk assessment of ncRNA-based genetically modified plants for food and feed. EFSA Supporting Pubications 16, 1688E, DOI: 10.2903/sp.efsa.2019.EN-1688.
De Schutter, K., C.N.T. Taning, L. Van Daele, E.J.M. Van Damme, P. Dubruel, G. Smagghe, 2022: RNAi-Based Biocontrol Products: Market Status, Regulatory Aspects, and Risk Assessment. Frontiers in Insect Science 1, 22. DOI: 10.3389/finsc.2021.818037.
del Pozo-Acebo, L., M.-C. López de las Hazas, A. Margollés, A. Dávalos, A. García-Ruiz, 2021: Eating microRNAs: pharmacological opportunities for cross-kingdom regulation and implications in host gene and gut microbiota modulation. British Journal of Pharmacology 178, 2218–2245, DOI: 10.1111/bph.15421.
Dubelman, S., J. Fischer, F. Zapata, K. Huizinga, C. Jiang, J. Uffman, S. Levine, D. Carson, 2014: Environmental Fate of Double-Stranded RNA in Agricultural Soils. PLoS One 9, e93155, DOI: 10.1371/journal.pone.0093155.
EC, 2009: Regulation (EC) no. 1107/2009 of the European parliament and of the Council of 21 October 2009 concerning the placing of plant protection products on the market and repealing Council Directives 79/117/EEC and 91/414/EEC. Official Journal of the European Union 309, 1–50.
Gaffar, F.Y., J. Imani, P. Karlovsky, A. Koch, K.-H. Kogel, 2019: Different Components of the RNA Interference Machinery Are Required for Conidiation, Ascosporogenesis, Virulence, Deoxynivalenol Production, and Fungal Inhibition by Exogenous Double-Stranded RNA in the Head Blight Pathogen Fusarium graminearum. Frontiers in Microbiology 10, 1–13, DOI: 10.3389/fmicb.2019.01662.
Gaffar, F. Y., A. Koch, 2019: Catch me if you can! RNA silencing-based improvement of antiviral plant immunity. Viruses 11, DOI: 10.3390/v11070673.
Hare, J.D., 1990: Ecology and Management of the Colorado Potato Beetle. Annual Reviews of Entomology 35, 81–100, DOI: 10.1146/annurev.en.35.010190.000501.
Hunsche, M., A. Alexeenko, L. Damerow, G. Noga, 2011: Rain-induced removal of copper from apple leaves: Influence of rain properties and tank-mix adjuvants on deposit characteristics at the micro scale. Crop Protection 30, 495–501, DOI: 10.1016/j.cropro.2010.11.028.
Kaldis, A., M. Berbati, O. Melita, C. Reppa, M. Holeva, P. Otten, A. Voloudakis, 2018: Exogenously applied dsRNA molecules deriving from the Zucchini yellow mosaic virus (ZYMV) genome move systemically and protect cucurbits against ZYMV. Molecular Plant Pathology 19, 883–895, DOI: 10.1111/mpp.12572.
Khajuria, C., S. Ivashuta, E. Wiggins, L. Flagel, W. Moar, M. Pleau, K. Miller, Y. Zhang, P. Ramaseshadri, C. Jiang, T. Hodge, P. Jensen, M. Chen, A. Gowda, B. McNulty, C. Vazquez, R. Bolognesi, J. Haas, G. Head, T. Clark 2018: Development and characterization of the first dsRNA-resistant insect population from western corn rootworm, Diabrotica virgifera virgifera LeConte. PLoS One 13, e0197059, DOI: 10.1371/journal.pone.0197059.
Kleter, G.A., 2020: Food safety assessment of crops engineered with RNA interference and other methods to modulate expression of endogenous and plant pest genes. Pest Management Science 76, 3333–3339, DOI: 10.1002/ps.5957.
Koch, A., D. Biedenkopf, A. Furch, L. Weber, O. Rossbach, E. Abdellatef, L. Linicus, J. Johannsmeier, L. Jelonek, A. Goesmann, V. Cardoza, J. McMillan, T. Mentzel, K.-H. Kogel, 2016: An RNAi-Based Control of Fusarium graminearum Infections Through Spraying of Long dsRNAs Involves a Plant Passage and Is Controlled by the Fungal Silencing Machinery. PLoS Pathogens 12, 1–22, DOI: 10.1371/journal.ppat.1005901.
Koch, A., K.H. Kogel, 2014: New wind in the sails: Improving the agronomic value of crop plants through RNAi-mediated gene silencing. Plant Biotechnology Journal 12, 821–831, DOI: 10.1111/pbi.12226.
Koch, A., M. Wassenegger, 2021: Host-induced gene silencing – mechanisms and applications. New Phytologist 231, 54–59, DOI: 10.1111/nph.17364.
Kolge, H., K. Kadam, S. Galande, V. Lanjekar, V. Ghormade, 2021: New Frontiers in Pest Control: Chitosan Nanoparticles-Shielded dsRNA as an Effective Topical RNAi Spray for Gram Podborer Biocontrol. ACS Applied Bio Materials 4, 6, 5145–5157, DOI:10.1021/acsabm.1c00349.
Konakalla, N.C., A. Kaldis, M. Berbati, H. Masarapu, A.E. Voloudakis, 2016: Exogenous application of double-stranded RNA molecules from TMV p126 and CP genes confers resistance against TMV in tobacco. Planta 244, 961–969, DOI: 10.1007/s00425-016-2567-6.
Kwon, D. H., J.H. Park, P.A. Ashok, U. Lee, S.H. Lee, 2016: Screening of target genes for RNAi in Tetranychus urticae and RNAi toxicity enhancement by chimeric genes. Pesticide Biochemistry and Physiology 130, 1–7, DOI: 10.1016/j.pestbp.2015.11.005.
Linyu, W., Z. Lianjun, L. Ning, G. Xiwu, L. Xiaoning, 2021: Effect of RNAi targeting CYP6CY3 on the growth, development and insecticide susceptibility of Aphis gossypii by using nanocarrier-based transdermal dsRNA delivery system. Pesticide Biochemistry and Physiology 177, 104878, DOI: 10.1016/j.pestbp.2021.104878.
Lü, J., Z. Liu, W. Guo, M. Guo, S. Chen, H. Li, C. Yang, Y. Zhang, H. Pan, 2020: Feeding delivery of dsHvSnf7 is a promising method for management of the pest Henosepilachna vigintioctopunctata (Coleoptera: Coccinellidae). Insects 11, DOI: 10.3390/insects11010034.
Lü, J., C. Yang, Z. Liu, A.M. Vélez, M. Guo, S. Chen, B. Qiu, Y. Zhang, X. Zhou, H. Pan, 2021: Dietary RNAi toxicity assay suggests α and γ subunits of HvCOPI as novel molecular targets for Henosepilachna vigintioctopunctata, an emerging coccinellid pest. Journal of Pest Science 94, 1473–1486, DOI: 10.1007/s10340-021-01350-x.
Mar-aguilar, F., A. Arreola-triana, D. Mata-cardona, V. Gonzalez-villasana, C. Rodríguez-padilla, 2020: Evidence of transfer of miRNAs from the diet to the blood still inconclusive. PeerJ 8, e9567, DOI: 10.7717/peerj.9567.
Máximo, W.P.F., J.L. Howell, K. Mogilicherla, M. Basij, S.C.R.R. Chereddy, S.R. Palli, 2020: Inhibitor of apoptosis is an effective target gene for RNAi-mediated control of Colorado potato beetle, Leptinotarsa decemlineata. Archives of Insect Biochemistry and Physiology 104, 1–11, DOI: 10.1002/arch.21685.
Mehlhorn, S.G., S. Geibel, G. Bucher, R. Nauen, 2020: Profiling of RNAi sensitivity after foliar dsRNA exposure in different European populations of Colorado potato beetle reveals a robust response with minor variability. Pesticide Biochemistry and Physiology 166, 104569; DOI: 10.1016/j.pestbp.2020.104569.
Meinke, L.J., D. Souza, B.D. Siegfried, 2021: The Use of Insecticides to Manage the Western Corn Rootworm, Diabrotica virgifera virgifera, LeConte: History, Field-Evolved Resistance, and Associated Mechanisms. Insects 12, DOI: 10.3390/insects12020112.
Meurer, R.A., S. Kemper, S. Knopp, T. Eichert, F. Jakob, H.E. Goldbach, U. Schwaneberg, A. Pich, 2017: Biofunctional Microgel-Based Fertilizers for Controlled Foliar Delivery of Nutrients to Plants. Angewandte Chemie International Edition 56, 7380–7386, DOI: 10.1002/anie.201701620.
Mishra, S., J. Dee, W. Moar, J.D. Beattie, J. Baum, N.P. Dias, A. Alyokhin, A. Buzza, S.I. Rondon, M. Clough, S. Menasha, R. Groves, J. Clements, K. Ostlie, G. Felton, T. Waters, W.E. Snyder, J.L. Jurat-Fuentes, 2021: Selection for high levels of resistance to double ‑ stranded RNA (dsRNA) in Colorado potato beetle (Leptinotarsa decemlineata Say) using non ‑ transgenic foliar delivery. Scientific Reports, 1–12, DOI: 10.1038/s41598-021-85876-1.
Mitter, N., E.A. Worrall, K.E. Robinson, P. Li, R.G. Jain, C. Taochy, S.J. Fletcher, B.J. Carroll, G.Q. (Max) Lu, Z. Ping Xu, 2017: Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses. Nature Plants 3, DOI: 10.1038/nplants.2016.207.
Niu, J., W.-J. Yang, Y. Tian, J.-Y. Fan, C. Ye, F. Shang, B.-Y. Ding, J. Zhang, X. An, L. Yang, T.-Y. Chang, O. Christiaens, G. Smagghe, J.-J. Wang 2019: Topical dsRNA delivery induces gene silencing and mortality in the pea aphid. Pest Management Science 75, 2873–2881, DOI: 10.1002/ps.5457.
OECD, 2020: Considerations for the Environmental Risk Assessment of the Application of Sprayed or Externally Applied dsRNA-based Pesticides. Series on Pesticides No. 104, ENV/JM/MONO (2020) 26 (Paris).
Parker, K.M., V. Barragán Borrero, D.M. van Leeuwen, M.A. Lever, B. Mateescu, M. Sander, 2019: Environmental Fate of RNA Interference Pesticides: Adsorption and Degradation of Double-Stranded RNA Molecules in Agricultural Soils. Environmental Science & Technology 53, 3027–3036, DOI: 10.1021/acs.est.8b05576.
Peng, Y., K. Wang, W. Fu, C. Sheng, Z. Han, 2018: Biochemical Comparison of dsRNA Degrading Nucleases in Four Different Insects. Frontiers in Physiology 9, 624, DOI: 10.3389/fphys.2018.00624.
Qiao, L., C. Lan, L. Capriotti, A. Ah-Fong, J. Nino Sanchez, R. Hamby, J. Heller, H. Zhao, N.L. Glass, H.S. Judelson, B. Mezzetti, D. Niu, H. Jin, 2021: Spray-induced gene silencing for disease control is dependent on the efficiency of pathogen RNA uptake. Plant Biotechnology Journal 19 (9), 1756-1768, DOI: 10.1111/pbi.13589.
Rank, A.P., A. Koch, 2021: Lab-to-Field Transition of RNA Spray Applications – How Far Are We? Frontiers in Plant Science 12, 2243, DOI: 10.3389/fpls.2021.755203.
Rodrigues, T.B., S.K. Mishra, K. Sridharan, E.R. Barnes, A. Alyokhin, R. Tuttle, W. Kokulapalan, D. Garby, N.J. Skizim, Y.-w. Tang, B. Manley, L. Aulisa, R.D. Flannagan, C. Cobb, K.E. Narva, 2021: First Sprayable Double-Stranded RNA-Based Biopesticide Product Targets Proteasome Subunit Beta Type-5 in Colorado Potato Beetle (Leptinotarsa decemlineata). Frontiers in Plant Science 12, 728652, DOI: 10.3389/fpls.2021.728652.
Schenkel, W., A. Gathmann, 2021: Regulatory aspects of RNAi in plant production. In Mezzetti, B., J.B. Sweet, L. Burgos (eds.). RNAi for Improved Crop Performance Plant Improvement and Protection, Oxfordshire, CABI, 154–168, DOI: 10.1079/9781789248890.0154.
Schiemann, J., A. Dietz-Pfeilstetter, F. Hartung, C. Kohl, J. Romeis, T. Sprink, 2019: Risk Assessment and Regulation of Plants Modified by Modern Biotechniques: Current Status and Future Challenges. Annual Review of Plant Biology 70, 699–726, DOI: 10.1146/annurev-arplant-050718-100025.
Sharma, S., R. Kooner, R. Arora, 2017: Insect Pests and Crop Losses. In Arora, R., S. Sandhu (eds.). Breeding Insect Resistant Crops for Sustainable Agriculture, Singapore, Springer, 45–66, DOI: 10.1007/978-981-10-6056-4_2.
Sharma, P., S. Kumar, R.K. Delong, 2021: Nanomaterials for Agricultural and Ecological Defense Applications: Active Agents and Sensors. WIREs Nanomedicine and Nanobiotechnology 13 (5), e1713, 1–18, DOI: 10.1002/wnan.1713.
Singh, I.K., S. Singh, K. Mogilicherla, J.N. Shukla, S.R. Palli, 2017: Comparative analysis of double-stranded RNA degradation and processing in insects. Scientific Reports 7, 17059, DOI: 10.1038/s41598-017-17134-2.
Thairu, M.W., I.H. Skidmore, R. Bansal, E. Nováková, T.E. Hansen, H. Li-Byarlay, S.A. Wickline, A.K. Hansen, 2017: Efficacy of RNA interference knockdown using aerosolized short interfering RNAs bound to nanoparticles in three diverse aphid species. Insect Molecular Biology 26, 356–368, DOI: 10.1111/imb.12301.
Van Leeuwen, T., J. Vontas, A. Tsagkarakou, W. Dermauw, L. Tirry, 2010: Acaricide resistance mechanisms in the two-spotted spider mite Tetranychus urticae and other important Acari: A review. Insect Biochemistry and Molecular Biology 40, 563–572, DOI: 10.1016/j.ibmb.2010.05.008.
Wagner, D.L., E.M. Grames, M.L. Forister, M.R. Berenbaum, D. Stopak, 2021: Insect decline in the Anthropocene: Death by a thousand cuts. Proceedings of the National Academy of Sciences (PNAS) 118, e2023989118, DOI: 10.1073/pnas.2023989118.
Wang, K., B. Li, Y. Yu, J. Wei, J. Zhu, J. Wang, F. Lin, H. Xu, 2021: Bacterial Rdl2 dsRNA increased the insecticidal activity of GABAR blockers and allosteric modulators against Plutella xylostella. bioRxiv, DOI: 10.1101/2021.03.24.436736.
Wang, M., A. Weiberg, F.-M. Lin, B.P.H.J. Thomma, H.-D. Huang, H. Jin, 2016: Bidirectional cross-kingdom RNAi and fungal uptake of external RNAs confer plant protection. Nature Plants 2, 16151, DOI: 10.1038/nplants.2016.151.
Whitten, M., P. Dyson, 2017: Gene silencing in non-model insects: Overcoming hurdles using symbiotic bacteria for trauma-free sustainable delivery of RNA interference. BioEssays 39, 1600247, DOI: 10.1002/bies.201600247.
Whitten, M.M.A., P.D. Facey, R. Del Sol, L.T. Fernández-Martínez, M.C. Evans, J.J. Mitchell, O.G. Bodger, P.J. Dyson, 2016: Symbiont-mediated RNA interference in insects. Proceedings of the Royal Society B Biological Sciences 283, 20160042, DOI: 10.1098/rspb.2016.0042.
Willow, J., L. Soonvald, S. Sulg, R. Kaasik, A.I. Silva, C. Nji Tizi Taning, O. Christiaens, G. Smagghe, E. Veromann, 2020: First Evidence of Bud Feeding-Induced RNAi in a Crop Pest via Exogenous Application of dsRNA. Insects 11 (11), 769, DOI: 10.3390/insects11110769.
Wu, J.J., L.L. Mu, W.N. Kang, L.J. Ze, C.H. Shen, L. Jin, A. Ali Anjum, G.-Q. Li, 2021: RNA interference targeting ecdysone receptor blocks the larval–pupal transition in Henosepilachna vigintioctopunctata. Insect Science 28, 419–429, DOI: 10.1111/1744-7917.12777.
Zhang, J., S.A. Khan, C. Hasse, S. Ruf, D.G. Heckel, R. Bock, 2015: Full crop protection from an insect pest by expression of long double-stranded RNAs in plastids. Science 347 (6225), 991-994, DOI: 10.1126/science.1261680.
Fußnoten:
Landesstrategie: Ministerium für Ernährung, Ländlichen Raum und Verbraucherschutz Baden-Württemberg (baden-wuerttemberg.de) | |
Nationale Bioökonomiestrategie | Bioökonomie.de (biooekonomie.de) | |
A sustainable bioeconomy for Europe – Publications Office of the EU (europa.eu) | |
Biodiversitätsstrategie für 2030 (europa.eu) | |
Sustainable Food and Agriculture | Food and Agriculture Organization of the United Nations (fao.org) | |
Report of the Open-ended Working Group on the Post-2020 Global Biodiversity Framework on its second meeting (cbd.int) | |
Europäischer Grüner Deal | EU-Kommission (europa.eu) | |
Genetically Modified Organisms (europa.eu) | |
Global Status of Commercialized Biotech/GM Crops: 2019 – ISAAA Brief 55-2019 | ISAAA.org | |
Federal Register, Volume 86 Issue 116 (Monday, June 21, 2021) (govinfo.gov) | |
Themenservice: Detailansicht: Universität Hohenheim (uni-hohenheim.de) | |
BLE – Projektsuche |