

Journal für Kulturpflanzen, 74 (07-08). S. 176–184, 2022 | DOI: 10.5073/JfK.2022.07-08.03 | Koch et al.
Isolierung und Charakterisierung von pilzlichen Erregern des Schwarzen Rindenbrandes an Apfelbäumen mit Hilfe des „Apfeltests“
Isolation and Characterization of fungal causal agents of black bark disease of apple using the “apple test”
 | Der Autor/Die Autorin 2022 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 12. Februar 2022/13. Juli 2022 |
In den letzten, häufig von Trockenheit geprägten Jahren hat sich der Schwarze Rindenbrand an Apfel- und Birnenbäumen in verschiedenen Teilen Deutschlands zunehmend zu einem Problem entwickelt. Ziel der vorliegenden Arbeit war es daher, methodische Grundlagen zur Isolierung der Erreger aus Apfelbäumen und ihrer Charakterisierung im Labor zu erarbeiten. Die Experimente beinhalteten die klassische Isolierung durch Auslegen von erkranktem Gewebe auf Agarmedien sowie ein in der Literatur als „Apfeltest“ beschriebenes Verfahren, bei dem befallene Rinde in Apfelfrüchte gesteckt wird. In der Folge reichern sich Pathogene im Gewebe an und können aus den entstehenden Faulstellen isoliert werden.
Aus dem Stammholz eines im Wipfelbereich welkenden Baumes wurden nach Auslegen auf Agarmedium Trametes versicolor, Diaporthe eres sowie Diplodia seriata (bekannt als einer von mehreren Erregern des Schwarzen Rindenbrandes) isoliert. Diese Art wurde auch nach Auslegen befallener Rinde auf Kartoffel-Dextrose-Agar erhalten, ebenso wie Diplodia malorum. Durch Einstecken befallener Rindenstücke in Apfelfrüchte wurden weitere Isolate von D. malorum, drei Isolate von Diplodia bulgarica sowie Lambertella corni-maris, Penicillium sp. und Sclerotinia sclerotiorum gewonnen. Im Biotest mit künstlicher Inokulation mit Reinkulturen riefen die drei letztgenannten Isolate, alle Diplodia-Isolate sowie Diaporthe eres Fruchtfäulen hervor. Die Diplodia-Arten wurden darüber hinaus hinsichtlich der Geschwindigkeit des Hyphenwachstums und der Sporenmorphologie charakterisiert.
Apfel, Rindenkrankheiten, Ködertest, Diplodia spp., Diaporthe eres, Lambertella corni-maris
During the previous years characterized by summer-drought, black canker disease of apple and pear has become a problem in different parts of Germany. The aim of the current work was therefore to develop basic techniques for isolation of the inciting pathogens from apple trees and their characterization in the laboratory. The experiments included the standard isolation of putative pathogens by placing symptomatic tissue on agar media as well as a method described in the literature as „apple test”. For the latter, symptomatic bark pieces are inserted into apple fruits and colonization of the apple tissue is visible as rotting spots. Candidate pathogens can be easily isolated from the colonized apple tissue.
After placement of tissue from the trunk of the top of an apple tree expressing wilt symptoms, Trametes versicolor, Diaporthe eres and Diplodia seriata (one of several agents known to cause black canker disease) were isolated. Together with Diplodia malorum, the latter species was also obtained after placement of symptomatic bark pieces on potato dextrose agar. Insertion of diseased bark into apple fruits led to the isolation of further isolates of D. malorum, three isolates of Diplodia bulgarica, Lambertella corni-maris, Penicillium sp. and Sclerotinia sclerotiorum. After inoculation with pure cultures into apple fruits, the latter three, all Diplodia-isolates and Diaporthe eres were pathogenic and caused fruit rots. The Diplodia isolates were further characterised regarding speed of hyphal growth and spore morphology.
Apple, trunk diseases, bait method, Diplodia spp., Diaporthe eres, Lambertella corni-maris
Verschiedene bakterielle und pilzliche Erreger sind in der Lage, an Ästen und Stämmen von Apfelbäumen Rindenkrankheiten hervorzurufen (Ficke et al., 1984). Die Hauptschädigung am Baum sind Veränderungen in Form von Nekrosen im Rindenparenchym (Lindner, 2008), verbunden mit Verschwärzungen der Stammoberfläche, für die auch der Begriff Rindenbrand geläufig ist. Im fortgeschrittenen Stadium der Krankheit kommt es zum Ablösen der Borke, Vermorschungen des Holzes und Absterbeerscheinungen.
Ein in Deutschland seit einigen Jahren zunehmend auftretendes Schadbild ist der Schwarze Rindenbrand an Apfel und Birne. In Baden-Württemberg und Südhessen erreichte die Pilzkrankheit ein größeres Ausmaß in Folge des Hitzesommers 2003. Zu Anfang waren insbesondere auf Streuobstwiesen massive Schäden an den Bäumen zu verzeichnen, seit 2018 sind auch Bio-Erwerbsanlagen betroffen (Hinrichs-Berger, 2020). Als Verursacher des Schwarzen Rindenbrandes stehen Pilze der Gattung Diplodia im Fokus. Die an Rosaceen vorkommenden Diplodia-Arten sind sehr divers. Phillips et al. (2012) ordneten die Isolate vom Apfel vier Arten zu, Diplodia seriata, Diplodia intermedia, Diplodia bulgarica und Diplodia malorum. Nach diesen Autoren ist für viele der früher als Diplodia mutila bezeichneten Isolate vom Apfel die Einordnung als D. malorum zutreffender. In Baden-Württemberg waren von 88 Diplodia-Isolaten aus Rindenbrandsymptomen von Apfel und Birne fast 60 % der Art D. bulgarica zugehörig, gefolgt von D. seriata, D. malorum, Diplodia juglandis und D. mutila (Zugschwerdt et al., 2021). Während D. bulgarica in diesen Untersuchungen erstmals an Kernobst in Deutschland nachgewiesen wurde (Hinrichs-Berger et al., 2021), gibt es für D. seriata und D. mutila frühere Beschreibungen, allerdings teilweise unter synonymen Bezeichnungen (Senula & Ficke, 1983; Weiler & Kennel, 1986; Lindner, 2009; Weber & Dralle, 2013). Viele Diplodia-Arten können an Kern- und Steinobst Fruchtfäulen hervorrufen. So bezieht sich die Erstbeschreibung von D. malorum auf Pilzmaterial von der Schale fauler Äpfel und Birnen (Fuckel, 1870), und sowohl D. seriata als auch D. bulgarica wurden als Verursacher von Fruchtfäulen an Äpfeln beschrieben (Trapman et al., 2008; Díaz et al., 2019; Vučković et al., 2021).
Zur Biologie und Epidemiologie der Rindenbranderreger sind noch viele Fragen offen. Sie betreffen etwa die Rolle anderer Wirte (Cloete et al., 2011), die Ausbreitung des Inokulums in den Anlagen sowie den Einfluss prädisponierender Faktoren wie Hitzestress auf den Befall. Für viele dieser Arbeiten ist es erforderlich, die Erreger zu isolieren und in Reinkultur darzustellen. Soweit sporulierende Fruktifikationsorgane vorhanden sind, können die Sporen evtl. direkt auf Nährmedien ausgestrichen werden (Hinrichs-Berger et al., 2021), was die Isolierung erheblich erleichtert. Fehlen Sporen, so ist das Standardverfahren das Auslegen befallener Pflanzenteile auf Agarmedien. Es hat aber den Nachteil einer in der Regel geringen Selektivität, so dass neben den Pathogenen auch Saprophyten wachsen können. Senula & Ficke (1983) stellten eine Methode zur Isolation vor, bei der erkrankte Rindenstücke in unreife Äpfel gesteckt („implantiert“) werden. Im Prinzip handelt es sich um ein Köderverfahren, dessen Selektivität darin besteht, dass das lebende Gewebe des Apfels Saprophyten ausschließt und vorhandenen Fruchtpathogenen die Besiedlung ermöglicht. Somit ist eine vergleichsweise schnelle Herstellung von Reinkulturen möglich. Bei der Isolierung aus befallenem Rindengewebe zeigten sich aber bei einigen Erregern Unterschiede in der Nachweissicherheit, und auch der Reifezustand und die Apfelsorte hatten einen Einfluss. Trotz dieser Einschränkungen kommen die Autoren zu dem Schluss, dass der Test die gleiche Nachweissicherheit für Rindenbranderreger besitzt wie die klassischen Methoden der Isolierung über Nährböden. Nach Angaben der Autoren eignete sich der „Apfeltest“ außer zur Isolierung auch zur Diagnose: nach Inokulation von Äpfeln mit Reinkulturen von neun verschiedenen pilzlichen Rindenbranderregern [darunter D. seriata; beschrieben als Physalospora cydoniae Arnaud. (Sphaeropsis malorum Peck.)] entwickelten sich Fruchtfäulen sowie die Fruktifikationsorgane der Erreger, was eine schnelle Identifikation ermöglichte.
Die Anwendung des „Apfeltests“ wurde in weiteren Arbeiten beschrieben (Senula 1985, Senula & Ficke 1985), unseres Wissens gibt es aber keine publizierten Untersuchungen, bei denen die Isolierung von Erregern des Schwarzen Rindenbrandes im Mittelpunkt standen. Ziel der vorliegenden Arbeit war es daher, das von Senula und Ficke beschriebene Verfahren für diese Erregergruppe zu überprüfen. Dabei stand nicht die Quantifizierung der Erreger im Vordergrund, sondern die prinzipielle Eignung der Methode. Darüber hinaus sollten Erkenntnisse zum Umgang mit den Erregern, insbesondere zur Identifikation, gewonnen werden. Neben wenigen Isolierungen durch Auslegen beinhalteten die Experimente vor allem die Isolierung durch Einstecken von erkranktem Pflanzengewebe in Apfelfrüchte sowie die Überprüfung der Pathogenität durch Inokulation von Äpfeln mit Material aus Reinkulturen.
Die Proben stammten von einem ca. 4 m hohen Baum in einem Hausgarten im Landkreis Darmstadt-Dieburg (Südhessen), der im Wipfelbereich starke Welkesymptome zeigte und im oberen Bereich deutliche Nekrosen und Schwarzfärbungen der Rinde aufwies. In ca. 3 m Höhe wurde der Stamm in diesem Bereich mit einer Säge durchtrennt, und durch einen zweiten Schnitt eine Baumscheibe (ca. 3 cm dick, Durchmesser ca. 15 cm) abgesägt. Von letzterer wurde eine der Schnittflächen gründlich mit Wasser gewaschen, mit Natriumhypochlorid (1 %) besprüht und anschließend mit sterilem Wasser gewaschen. Nach Abtrocknen der Oberfläche wurden mit einem Skalpell ca. 1 × 10 mm lange Stücke von verschiedenen Stellen der Oberfläche ausgeschnitten und auf Kartoffel-Dextrose-Agar (PDA + A) ausgelegt.
Für die Isolierung aus Rinde wurde Material von ca. 5 Jahre alten Apfelbäumen einer Streuobstwiese aus der gleichen Region verwendet. Von sechs beprobten Bäumen zeigte einer einen Anfangsbefall und fünf einen fortgeschrittenen Befall mit dem Schwarzen Rindenbrand. Die Probenahme erfolgte in den Monaten Mai – Oktober 2021. Zunächst wurde mit einem scharfen Messer die oberflächliche Borke (sofern vorhanden) entfernt. Anschließend wurde aus den an das gesunde Gewebe angrenzenden, dunkelbraunen Schichten mit einem scharfen Messer ca. 3 mm dicke und 25 × 30 – 50 mm große Stücke geschnitten und in Haushalts-Frischhaltedosen bei 15 – 18°C aufbewahrt (Abb. 1 A, B, C). Die Weiterverarbeitung erfolgte, sofern nicht anders vermerkt, am gleichen Tag oder innerhalb der folgenden Tage.

Abb. 1. Isolierung durch Auslegen der Rinde auf Agarmedium oder Einstecken in Apfelfrüchte. A: Baumstamm mit Rindenbrand im Frühstadium; B: Fortgeschrittener Befall, die Rinde wurde teilweise entfernt; B1: Typische scharfe Abgrenzung zwischen befallenem und gesundem Holz; C: Für die Inokulation verwendetes Rindenmaterial; D: Rindenstücke auf PDA + A mit auswachsenden Hyphen von Diplodia malorum (Aufnahme 3 dpi); E: Äpfel mit Faulstellen im Bereich der eingesteckten Rindenstücke (Aufnahme 8 dpi); D: Apfel mit eingesteckten Rindenstücken aber ohne Infektion (Aufnahme 8 dpi). dpi = Tage nach Inokulation
Bei dem Baum mit Anfangsbefall wurden für die Isolierung die Methoden des sofortigen Auslegens auf Agarmedium sowie, nach ca. sechswöchiger Lagerung der Rindenstücke, die des Auslegens und des Einsteckens in Apfelfrüchte (siehe unten) angewendet. Bei dem erstgenannten Verfahren wurden aus den oben beschriebenen Holzstücken kleinere, ca. 1 mm dicke und ca. 5 × 5 mm große Stücke ausgeschnitten und auf PDA + A ausgelegt (Abb. 1 D).
Im Falle der Bäume mit fortgeschrittenem Befall wurde nur das Verfahren des Einsteckens von Rindenstücken in Apfelfrüchte angewendet. Anfang August bis Mitte Oktober 2021 wurden hierfür frisch geerntete, noch unreife Äpfel der Sorten `Boskoop´, `Topas´ und `Brettacher´ verwendet. Für später durchgeführte Inokulationen und Bioteste (siehe `Biotest an Äpfeln´ unten) wurden im Supermarkt gekaufte Früchte der Sorte `Granny Smith´ aus konventioneller Produktion verwendet. Die Früchte wurden durch oberflächliches Besprühen mit einem haushaltsüblichen Desinfektionsmittel desinfiziert und mit Küchenpapier abgetrocknet. Mit einem sauberen Messer wurden pro Apfel ein bis zwei ca. 1 cm tiefe Kerbschnitte gemacht, in die jeweils ein Rindenstück (ca. 3 × 5 × 30 mm) gesteckt wurde. Die inokulierten Äpfel wurden einzeln oder zu zweit in 15 × 15 cm großen Papiertüten im Dunkeln bei ca. 20°C aufbewahrt. Nach Auftreten von Symptomen im Bereich der eingesteckten Rinde (Abb. 1 E, F) wurden aus den Befallsstellen ca. 3 × 3 × 3 mm große Stücke ausgeschnitten und auf PDA + A gelegt.
Für die Bioteste wurde in den Versuchen mit Stamm- und Astisolaten jeweils ein Satz von vier Streuobst-Äpfeln (`Boskoop´, `Topas´, `Brettacher´ und eine weitere, nicht bekannte Sorte) verwendet, die Versuche mit Rindenisolaten wurden an Einzelfrüchten der Sorte `Granny Smith´ durchgeführt (siehe vorherigen Absatz). Die Äpfel wurden, wie oben beschrieben, oberflächlich desinfiziert, und pro Apfel wurden mit einem Skalpell zwei bis vier Vertiefungen von ca. 5 × 5 × 5 mm ausgeschnitten. Diese wurden anschließend mit bewachsenem Agar aus Petrischalen oder mit Material aus den Faulstellen anderer Äpfel aufgefüllt und mit transparentem Büroklebeband überklebt. Die so inokulierten Früchte wurden wie beschrieben in Papiertüten oder Gefrierbeuteln im Dunkeln inkubiert oder alternativ im Abstand von ca. 50 cm bei 20°C unter Schwarzlichtlampen (Dauerlicht) gelegt.
PDA-Platten wurden mittig mit einem bewachsenen Agarstück beimpft und bei 20°C im Dunkeln inkubiert. Beginnend am folgenden Tag, wurde im Abstand von 24 Stunden der radiäre Zuwachs der Hyphen an vier Stellen pro Platte angezeichnet und vermessen. Aus den vier erhaltenen Messwerten wurde die stündliche Wachstumsrate für jede Platte ermittelt. Aus den Wachstumsraten von jeweils drei Platten pro Isolat wurde der Mittelwert und die Standardabweichung errechnet.
Zur Induktion der Pyknidienbildung wurden die folgenden Agarmedien verwendet: PDA, PDA halb konzentriert (“0.5 PDA“) mit aufgelegten autoklavierten Zahnstochern oder Apfelholz (pro Petrischale jeweils ein Zahnstocher bzw. ein ca. 5 cm langes, längsgeteiltes Stück von 5 – 10 mm starken, vorjährigen Trieben) oder SNA (Nirenberg, 1976) mit aufgelegten Zahnstochern. Die Platten wurden mittig mit den Pilzen beimpft und bei 20°C unter Schwarzlicht aufgestellt. Nach Einsetzen der Sporulation wurden Pyknosporen entnommen und in Wasser im Hellfeld oder Interferenzkontrast eines Durchlichtmikroskops fotografiert. Die Sporenmaße wurden mit Hilfe der Software des Mikroskops (ZEN; Zeiss) ermittelt. Dafür wurde die Länge und Breite von jeweils 60 Sporen pro Isolat vermessen und Mittelwerte und Standardabweichungen berechnet. Pyknidien wurden unter einem Stereomikroskop fotografiert.
Die molekulare Identifikation der Isolate erfolgte normalerweise aus Reinkulturen auf Petrischalen. Dafür wurde eine stecknadelkopfgroße Menge Pilzmaterial aus etwa 14 Tage alten, auf PDA gewachsenen Reinkulturen mit einem Spatel in 1,5 ml Eppendorfgefäße überführt. Im Falle der Diplodia-Isolate BI 7452, BI 7453, BI 7454, BI 7455 und BI 7456 wurde parallel Gewebe aus Faulstellen von Äpfeln verwendet, die acht Tage zuvor mit Reinkulturen dieser Isolate inokuliert worden waren (vergl. „Biotest an Früchten“). Für die DNA-Isolierung wurden ca. 5 × 5 × 5 mm große Stücke aus den Faulstellen ausgeschnitten. Das Material aus den Faulstellen sowie das Mycel von den Petrischalen wurde mit einem Kunststoff-Pistill direkt in den Eppendorf-Gefäßen zerkleinert. Danach erfolge die DNA-Isolierung mit Hilfe des DNeasy Plant Mini Kits (Qiagen, Hilden, Deutschland) nach Angaben des Herstellers, die reine DNA wurde in 50 μl eluiert. Für eine sichere Identifikation wurde die molekulare Bestimmung der oben genannten Diplodia-Isolate über zwei Genorte durchgeführt, zum einen über den ITS-Bereich (internal transcribed spacer) mit den Primern ITS1 und ITS4, zum anderen über den EF-1a (elongation factor 1-alpha)-Lokus mit den Primern EF1-986R und EF1-728F, wie bei Phillips et al. (2012) beschrieben. Für alle anderen Pilzisolate erfolgte die Bestimmung ausschließlich mit Hilfe der ITS-Primer. Die PCR-Reaktion erfolgte mit einer Standard Taq-Polymerase (Axon Labortechnik, Kaiserslautern, Deutschland) unter folgenden Bedingungen: Denaturierung für 5 min bei 95°C, Amplifikation mit 40 Zyklen (30 sec 95°C, 30 sec 54°C für 50 sec für ITS; bzw. 30 sec 95°C, 30 sec 50°C und 30 sec 72°C für EF-1a), gefolgt von einer finalen Extension für 10 min bei 72°C. Nach Überprüfung mit Gel-Elektrophorese und Aufreinigung der PCR-Produkte mit dem ExoSAP-IT PCR Product Cleanup-Kit (Thermo Fisher Scientific, Massachusetts, USA) erfolgte die Sequenzierung (Microsynth, Göttingen, Deutschland) von jeweils mindestens zwei PCR-Produkten je Isolat. Für die Darstellung der Sequenzen und für Sequenzvergleiche wurde das Programm Geneious Prime (Auckland, Neuseeland) verwendet. Die Identifikation wurde über eine BLAST-Suche mit Standard-Einstellungen durchgeführt. Die höchste Übereinstimmung erfolgte anhand des E-values.
Bei den aus der Baumscheibe erhaltenen Reinkulturen dominierte Trametes versicolor, außerdem wurden D. seriata (BI 7440) und Diaporthe eres (BI 7441) (Abb. 2 A, B) gefunden. Im Biotest an Apfelfrüchten mit Material von bewachsenen PDA-Platten erwiesen sich D. seriata und Diaporthe eres als sehr pathogen. Acht Tage nach der Inokulation hatten die Faulstellen bei allen Äpfeln einen Durchmesser von mehr als 2 cm (Tab. 1) erreicht.
Tab. 1. Übersicht der aus Stammholz durch Auslegen auf Nährmedium isolierten Pilze und ihre Pathogenität im Biotest
Isolatnummer | Ergebnis der molekularen Artbestimmung | Größe der Faulstellen im Biotest a |
– | Trametes versicolor | n.u. b |
BI 7440 | Diplodia seriata (GU121876.1, 100 %) | > 2 cm |
BI 7441 | Diaporthe eres | > 2 cm |
a Je eine Frucht von `Topas´, `Boskoop´, `Brettacher´ und einer unbekannten Sorte;
b n.u. = nicht untersucht
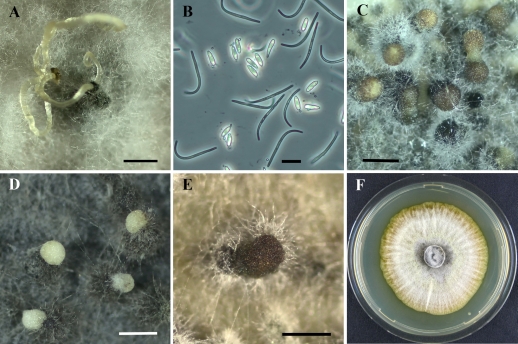
Abb. 2. A – B Diaporthe eres BI 7441; A: Sporenranken (Cirren), B: Alpha-Konidien und fadenförmige Beta-Konidien. C: Pyknidien von Diplodia bulgarica BI 7453; D – E: Diplodia malorum BI 7455; D: Pyknidien mit austretenden hyalinen Konidien; E: Pyknidium mit dunklen Konidien. F: Lambertella corni-maris auf PDA (8dpi). Maßstabsbalken: A, C, D, E = 500 μm; B = 10 μm.
Das Material für die Inokulationen stammte von insgesamt sechs Apfelbäumen, von denen einer einen Anfangsbefall und fünf einen fortgeschrittenen Befall mit Rindenbrand aufwiesen (Abb. 1A, B). Aus dem Baum mit Anfangsbefall wurden nach Auslegen von Rinde auf PDA + A D. seriata und D. malorum isoliert. Diplodia malorum konnte auch noch nach ca. sechswöchiger Lagerung der Rindenstücke isoliert werden, und zwar sowohl durch Auslegen auf Agar als auch durch Einstecken in Apfelfrüchte. Für die Isolierungen aus den anderen fünf Bäumen wurde nur das Verfahren des Einsteckens von Rindenstücken in Apfelfrüchte angewendet. Damit wurden mehrere Isolate von D. malorum und D. bulgarica erhalten, von denen die in Tab. 2 genannten als typische Vertreter ausgewählt wurden. Lambertella corni‑maris, Penicillium sp. und Sclerotinia sclerotiorum wurden je einmal isoliert (Tab. 2).
Tab. 2. Übersicht der aus Rinde isolierten Pilze
Isolat- | Ergebnis der molekularen Artbestimmung | Sporenmaße [μm] a | Mycel- | Durchmesser der Faulstellen im Biotest [mm] c | ||
Höchste BLAST-Hits (ITS; Acc.no und Identität) | Höchste BLAST Hits (EF-1a; Acc.no und Identität) | Übereinstimmung | ||||
BI 7452 d | D. bulgarica (MT239082.1, 99 %)/D. mutila (MN634023.1, 99 %) | D. bulgarica (MN485770.1, 100 %) | Diplodia bulgarica | 27.7 ± 1.52 × 14.0 ± 1.00 | 3.9 ± 0.31 | 26.5 |
BI 7453 d | D. bulgarica (MT239082.1, 99 %)/D. mutila (MN634023.1, 99 %) | D. bulgarica (MN485770.1, 100 %) | Diplodia bulgarica | 25.4 ± 2.01 × 14.9 ± 1.03 | 4.8 ± 0.53 | 16.3 |
BI 7454 d | D. bulgarica (MT239082.1, 99 %)/D. mutila (MN634023.1, 99 %) | D. bulgarica (MN485770.1, 100 %) | Diplodia bulgarica | 24.1 ± 2.03 × 14.0 ± 0.72 | 4.8 ± 0.99 | 30.0 |
BI 7455 e | D. malorum (MH863354.1, 100 %) | D. malorum (MT671214.1, 100 %)/D. africana (MT671211.1) | Diplodia malorum | 29.8 ± 1.43 × 12.9 ± 0.79 | 6.7 ± 0.13 | 30.0 |
BI 7456 e | D. seriata (MT587393.1, 100 %) | D. seriata (MN633982.1, 100 %) | Diplodia seriata | 25.1 ± 1.98 × 10.6 ± 0.89 | 10.5 ± 0.53 | 27.5 |
BI 7457 d | Lambertella corni-maris (AB926093.1) | n.u. f | - | - | 3.1 ± 0.03 | 34.8 |
-d | Penicillium sp. g | n.u. | n.u. | 36.5 | ||
-d | Sclerotinia sclerotiorum g | n.u. | n.u. | n.u. | ||
a Länge × Breite; Mittelwerte und Standardabweichungen von je 60 Sporen
b Mittelwerte und Standardabweichungen von je 3 Petrischalen
c Sorte Granny Smith. Gemessen 8 dpi. Mittelwert von 2 Äpfeln mit je einer Befallsstelle
d Isoliert durch Einstecken von Rinde in Äpfel
e Isoliert durch Auslegen auf PDA
f n.u. = nicht untersucht
g morphologische Bestimmung
Für die molekulare Identifikation der Diplodia-Isolate in Tabelle 2 mit der PCR wurde zum einen Material zunächst aus den Befallsstellen auf PDA übertragen und aus den sich daraus entwickelnden Pilzkulturen die DNA extrahiert. Zusätzlich wurde ein weiteres Verfahren überprüft, indem aus den Befallsstellen von künstlich mit Reinkulturen inokulierten Apfelfrüchten faules Gewebe entnommen und direkt für die DNA-Extraktion und die folgende PCR-Reaktion verwendet wurde. Dabei wurde stets die für die Beimpfung verwendete Diplodia-Art nachgewiesen. In keinem Fall gab es Verunreinigungen durch andere Mikroorganismen oder durch sonstige Inhibitoren aus dem Apfelmaterial, die die PCR oder die darauffolgende Sequenzierung gestört hätten. Somit wurden auf beiden Wegen identische Ergebnisse erzielt.
In einigen Fällen führte das BLAST-Ergebnis eines Lokus (ITS oder EF) bei den Diplodia-Isolaten zu zwei gleich wahrscheinlichen Ergebnissen, d. h. zu zwei Arten mit jeweils hundertprozentiger Übereinstimmung. Da jedoch zwei Genorte verwendet wurden, konnte nach dem Ausschlussverfahren für alle Isolate die Art zweifelsfrei molekular bestimmt werden (Tab. 2).
Im Pathogenitätstest an Apfelfrüchten wurden bei allen geprüften Sorten die Befallsstellen etwa drei Tage nach der Inokulation sichtbar und nahmen im weiteren Zeitverlauf schnell an Größe zu, so dass nach 2 – 3 Wochen große Bereiche der Frucht betroffen waren. Es deutete sich an, dass die Faulstellen auf der Sorte Boskoop eher kleiner und auf den Sorten `Brettacher´ und `Granny Smith´ eher etwas größer waren.
Auch nach mehrwöchiger Lagerung von mit D. malorum oder D. bulgarica inokulierten Äpfeln wurden auf den Faulstellen keine Pyknidien gebildet, weder nach Lagerung im Dunkeln in Papiertüten oder Gefrierbeuteln, im Tageslicht noch unter Schwarzlicht. Nach Inokulation der Apfelfrüchte mit D. seriata BI 7440 und BI 7456 wurden in wenigen Fällen Pyknidien beobachtet, die auch auf großen Bereichen der Faulstellen in hoher Dichte auftraten, aber, wenn überhaupt, nur ganz wenige Sporen aufwiesen.
Die Isolate von D. bulgarica sporulierten nach zwei- bis dreiwöchigem Aufstellen unter Schwarzlicht auf 0.5 PDA mit aufgelegtem Apfelholz, meist am oder in der Nähe des Holzes. Sporulation wurde auch auf PDA-Platten beobachtet, die zwei Wochen im Dunkeln gewachsen waren und anschließend unter Schwarzlicht aufgestellt wurden (Abb. 2 C). Bei D. bulgarica ließen sich drei Stämme unterscheiden. Diplodia bulgarica BI 7453 und BI 7454 waren einander sehr ähnlich hinsichtlich Sporenmaßen und Mycelwachstum und unterschieden sich von D. bulgarica BI 7452 durch ein schnelleres Mycelwachstum und kürzere Sporen (Tab. 2). Diplodia bulgarica BI 7453 ließ sich von BI 7454 anhand der dunkel gefärbten, vergleichsweise kleinen Faulstellen im Apfeltest abgrenzen (Abb. 3).

Abb. 3. Charakteristika von Diplodia-Isolaten. Oben: Kolonie auf PDA; Mitte: Konidien; Unten: Faulstellen auf Granny Smith, 7 Tage nach Inokulation mit Petrischalenmaterial. A: Diplodia bulgarica BI 7452; B: D. bulgarica BI 7453; C: D. bulgarica BI 7454; D: Diplodia malorum BI 7455; E: Diplodia seriata BI 7456. Maßstabsbalken: Konidien = 20 μm; Faulstellen = 1 cm.
Diplodia malorum wurde in dieser Untersuchung mehrfach isoliert, als repräsentativer Vertreter wurde nur ein Isolat (BI 7455; isoliert aus Apfelfrucht) fortgeführt. Diplodia malorum BI 7455 kam unter Schwarzlicht ca. drei Wochen nach Inokulation auf PDA, auch ohne aufgelegtes Apfelholz oder Zahnstocher, zur Sporulation. Die Sporen waren hyalin und unseptiert oder dunkel mit einem, gelegentlich auch zwei Septen (Abb. 3 D). Daneben gab es Übergangsformen. Auf dem Nährboden lagen hyaline und dunkle Sporen von BI 7455 häufig in getrennten Häufchen (Abb. 2 D, E), traten aber auch in Mischung auf. Die von BI 7455 hervorgerufenen Faulstellen waren wie die von D. bulgarica BI 7453 tief dunkel gefärbt.
Von den aus Rinde isolierten Pilzen war D. seriata 7456 das am schnellsten wachsende Isolat (Tab. 2). Wie auch D. seriata 7440 (aus Stammholz) bildete es auf PDA viel Mycel und kaum Pyknidien, aber auf SNA mit aufgelegten Zahnstochern wurden am Holz einige sporulierende Pyknidien gebildet. Die Konidien waren schmaler als die der anderen Diplodia-Isolate und erschienen vergleichsweise dunkel (Abb. 3 E), was vermutlich auf die stark strukturierte Konidienwand zurückzuführen war. Auch bei D. seriata BI 7440 wurden gelegentlich septierte Sporen beobachtet. Nach dem Ausstreichen von Sporen sporulierten alle Diplodia-Isolate meist schneller als nach Übersetzen von Mycel.
Lambertella corni-maris (Abb. 2 F) und Penicillium sp. bildeten große Faulstellen, die heller waren als die von D. malorum und D. bulgarica. Außerdem war das befallene Gewebe häufig eingesunken und weicher als nach Infektion mit D. malorum und D. bulgarica. Letzteres galt insbesondere für Penicillium sp. Das Isolat von S. sclerotiorum wurde nach Feststellung der Identität in keine weiteren Untersuchungen einbezogen.
Im Stammholz eines sichtlich geschädigten Baumes wurde Diplodia seriata (= Botryosphaeria obtusa; Phillips et al., 2007) gefunden, eine Art, die als Verursacher von Rindenschäden an Äpfeln, Birnen und Pfirsichen weltweit auftritt (Sessa et al., 2016) und auch in Deutschland in Rindenbrandsymptomen nachgewiesen wurde (Hinrichs-Berger, 2020). Daneben konnten wir Diaporthe eres isolieren, ein weiterer holzzerstörender Pilz, der weltweit an verschiedenen Gehölzen, darunter Apfel und anderen Obstarten, schädigt (Santos et al., 2017; Sessa et al., 2017). In einer Untersuchung zu Pilzen auf Schnittholz in Apfelanlagen gehörten sowohl B. obtusa als auch Diaporthe eres zu den am häufigsten gefundenen Schadpilzen (Weiler & Kennel, 1986). Die Schädigung des von uns untersuchten Stammholzes war wohl ganz wesentlich auf den ebenfalls isolierten Pilz T. versicolor (Schmetterlingstramete), ein typischer Weißfäulepilz an Apfelholz (Blaschke & Nannig, 2013), zurückzuführen. Es ist zu vermuten, dass der Rindenbefall mit D. seriata und Diaporthe eres der Wegbereiter für die nachfolgende Etablierung von T. versicolor war.
Aus der Rinde symptomatischer Bäume konnten wir neben D. seriata auch D. malorum und D. bulgarica isolieren. Da eine Artbestimmung in der Gattung Diplodia basierend auf morphologischen Merkmalen häufig nicht zweifelsfrei möglich ist, wurde hier auf die in Phillips et al. (2012) beschriebenen zwei Genorte ITS und EF-1a für die Artbestimmung zurückgegriffen. Mit Hilfe der zwei Genorte war die Artbestimmung für die untersuchten Isolate eindeutig, die Verwendung nur eines Lokus wäre hier nicht ausreichend gewesen.
Eine gängige Methode zur Förderung der Sporulation von Diplodia-Arten ist deren Kultur auf Wasseragar oder halb konzentriertem PDA mit aufgelegten Kiefernadeln (Phillips et al., 2012) oder auch Pappelholz (Phillips et al., 2007). In unseren Versuchen wurde die Fähigkeit zur Sporulation stark vom Pilzisolat bestimmt. Abhängig vom Isolat waren alle geprüften Medien mehr oder weniger gut zur Induktion der Pyknidienbildung geeignet. Wichtig war vor allem das Aufstellen der Platten unter Schwarzlicht.
Die von uns ermittelten Sporengrößen stimmten bei D. malorum und D. seriata hinreichend gut mit den Angaben in der Literatur überein (Lopes, 2008; Phillips et al., 2013). Bei den drei als D. bulgarica identifizierten Isolaten entsprach die Sporenlänge den Literaturangaben, allerdings war die Breite häufig geringer, so dass der resultierende Längen:Breiten-Quotient abwich (eigene Untersuchung: 1,7 – 2,0; Phillips et al., 2013: 1,5). Die morphologischen Unterschiede zwischen den drei D. bulgarica-Isolaten spiegelten sich nicht in den hier sequenzierten Bereichen wider, vielmehr waren letztere bei allen drei Isolaten komplett identisch. Es können natürlich in anderen Sequenz-Bereichen, die wir hier nicht untersucht haben, Unterschiede auftreten. Wie auch von Trapman et al. (2008) berichtet, traten bei D. seriata vereinzelt septierte Konidien auf. Auch die beobachtete dunkle, stark strukturierte Konidienwand ist in Übereinstimmung mit den Angaben in der Literatur (Trapman et al., 2008; Phillips et al., 2013). Es ist bekannt, dass die Konidien der Botryosphaeriaceae eine beträchtliche Variabilität aufweisen, nicht nur zwischen Gattungen und Arten, sondern auch innerhalb der Art (Phillips et al., 2013). Beispielsweise variierten bei Lopes (2008) die Längen:Breiten-Quotienten bei verschiedenen Isolaten von D. malorum zwischen 1.8 und 2.1, und auf der Petrischale waren die Konidien durchweg länger als auf natürlichem Substrat. Auch bei Berücksichtigung weiterer Kriterien wie Sporenfarbe und Septierung ist bei dieser Pilzgruppe daher die Artunterscheidung nur anhand der Sporenmorphologie kaum möglich. In Übereinstimmung mit der Literatur war das Hyphenwachstum von D. seriata bei uns schneller als das von D. malorum, während die drei Isolate von D. bulgarica den langsamsten täglichen Hyphenzuwachs hatten (Lopes, 2008; González‐Domínguez et al., 2017).
Mit der vorliegenden Arbeit sollte überprüft werden, ob sich das von Senula & Ficke (1983) beschriebene Verfahren, Rindenbranderreger durch Einstecken befallener Rindenstücke in Apfelfrüchte zu isolieren, auf den Schwarzen Rindenbrand anwenden lässt, und ob die Methode zur Feststellung der Pathogenität geeignet ist. Bereits wenige Tage nach der Inokulation traten um die eingesteckten Rindenstücke herum Befallsstellen auf, aus denen Material entnommen und auf Agar übertragen werden konnte. Häufig erwiesen sich die resultierenden Isolate schon als Reinkulturen, die dann im nächsten Schritt mit Hilfe der PCR identifiziert wurden. Von den durch Einstecken in Apfelfrüchte isolierten Arten sind D. malorum und D. bulgarica als Rindenbranderreger bekannt, was die prinzipielle Eignung der Methode zeigt. Ob das Verfahren zu exakt den gleichen Ergebnissen kommt wie die Isolierung durch Auslegen auf Agar muss in weiteren, vergleichenden Untersuchungen geklärt werden. Da die Methode ein Köderverfahren für Fruchtpathogene ist, war es nicht unerwartet, dass mit S. sclerotiorum, Penicillium sp. und L. corni‑maris weitere Phytopathogene gefunden wurden, die in der Lage sind, Apfelfrüchte zu infizieren (van der Walt et al., 2010; Morales et al., 2010; Weber & Dralle, 2013; Wiseman et al., 2015).
Im Biotest an Apfelfrüchten konnte für die Diplodia-Arten, Diaporthe eres sowie Penicillium sp. und L. corni‑maris die Pathogenität bestätigt werden. Dabei spielte die Herkunft (Stamm oder Rinde) und die Art der Isolierung (Auslegen der Rinde auf Agar oder Einstecken in Apfelfrüchte) keine Rolle. Grundsätzlich waren die verwendeten Apfelsorten sowohl für den Biotest als auch für die Isolierung durch Einstecken von Rindenstücken geeignet, allerdings deuteten sich leichte Unterschiede in der Anfälligkeit an. Der Reifegrad der Äpfel (kurz vor Pflückreife bis Genussreife) hatte anscheinend keinen Einfluss auf das Ergebnis. Unabhängig von der Art des Inokulums (Material von der Petrischale oder aus Faulstellen) war der Biotest sehr gut reproduzierbar und Sekundärinfektionen mit anderen Pilzen kein Problem.
Senula & Ficke (1983) berichten, dass die verschiedenen von ihnen untersuchten Rindenbranderreger (einschließlich D. seriata; siehe Einleitung) auf den Äpfeln sporulierten und somit leicht zu identifizieren waren. Obwohl die gleiche Methodik angewendet wurde, war das mit den von uns verwendeten Apfelsorten und unter unseren Versuchsbedingungen nicht der Fall. In einem „praktikablen“ Zeitraum von 2 – 3 Wochen wurden lediglich von D. seriata gelegentlich Pyknidien gebildet, allerdings fast immer ohne Sporen. Den von den Autoren beschriebenen Vorteil, die Pathogene direkt auf dem Apfel identifizieren zu können, konnten wir somit nicht bestätigen. Trotz der erforderlichen Zwischenkultur auf der Petrischale erwies sich das Verfahren in unseren Versuchen dennoch als sehr gut geeignet für die Isolierung von Rindenbranderregern. Da sowohl die Symptomentwicklung auf dem Apfel als auch (nach Überimpfen auf die Petrischale) die Anzucht der für die PCR erforderlichen Mycelmasse nur wenig Zeit benötigten, waren im günstigen Fall für den gesamten Test von der Probenahme bis zur Identifikation nur ca. 2 Wochen erforderlich.
Das Verfahren wäre noch einfacher und kürzer, wenn die PCR direkt mit Material aus den Befallsstellen durchgeführt werden könnte. Dass dies prinzipiell möglich ist, konnten wir am Beispiel von fünf Diplodia-Isolaten zeigen, allerdings waren die Äpfel mit Reinkulturen beimpft worden. Wie oben beschrieben, deuteten unsere Ergebnisse darauf hin, dass nach Inokulation mit Rinde im Apfel häufig nur eine Art angereichert wird. Es steht zu erwarten, dass in diesen Fällen der direkte PCR-Nachweis möglich sein sollte.
Unser Dank gilt Herrn Dipl. Biol. Sebastian Hübner für seine Hilfe bei der molekularen Identifikation der Isolate sowie Frau Dr. Sabine Kind, JKI, Institut für Pflanzenschutz in Obst und Weinbau (Dossenheim) für die Durchsicht des Manuskripts und wertvolle Hinweise.
Der Autor und die Autorinnen erklären, dass keine Interessenskonflikte vorliegen.
Blaschke, M., A. Nannig, 2013: Pilze am Wildapfel. S. 51 – 54 in: Beiträge zum Wildapfel. LWF Wissen 73. Bayerische Landesanstalt für Wald- und Forstwirtschaft. URL: https://www.lwf.bayern.de/service/publikationen/lwf_wissen/059180/index.php.
Cloete, M., P.H. Fourie, U. Damm, P.W. Crous, L. Mostert, 2011: Fungi associated with die-back symptoms of apple and pear trees, a possible inoculum source of grapevine trunk disease pathogens. Phytopathologia Mediterranea 50 (Supplement), 176-S190, DOI: 10.14601/Phytopathol_Mediterr-9004.
Díaz, G.A., B.A. Latorre, E. Ferrada, M. Lolas, 2019: Identification and characterization of Diplodia mutila, D. seriata, Phacidiopycnis washingtonensis and Phacidium lacerum obtained from apple (Malus × domestica) fruit rot in Maule Region, Chile. European Journal of Plant Pathology 153 (1), 211-225, DOI: 10.1007/s10658-018-01640-8.
Ficke, W., A. Senula, U. Kastirr, H.J. Schaefer, 1984: Infektionsversuche mit Rindenbranderregern. Archives of Phytopathology and Plant Protection 20 (1), 53-66, DOI: 10.1080/03235408409437637.
Fuckel, L., 1870: Symbolae Mycologicae: Beiträge zur Kenntnis der Rheinischen Pilze. Jahrbücher des Nassauischen Vereins für Naturkunde, 23 (24), 1-459.
González-Domínguez, E., A. Alves, M. León, J. Armengol, 2017: Characterization of Botryosphaeriaceae species associated with diseased loquat (Eriobotrya japonica) in Spain. Plant Pathology 66 (1), 77-89, DOI: 10.1111/ppa.12556.
Hinrichs-Berger, J., 2020: Auf dem Sprung in Erwerbsanlagen: Der Schwarze Rindenbrand an Kernobst. Obstbau 5, 286-287.
Hinrichs-Berger, J., K. Zegermacher, G. Zgraja, 2021: First report of Diplodia bulgarica causing black canker on apple (Malus domestica) and pear (Pyrus communis) in Germany. New Disease Reports 43 (1), DOI: 10.1002/ndr2.12004.
Lindner, L., 2008: Rindenkrankheiten im Apfelanbau. Der Obstbau 9, 253-257.
Lopes, J.F.D.S.R.R., 2008: Resolving cryptic species complexes in Diplodia. Master Thesis, Universität Lissabon. URL: https://www.repository.utl.pt/handle/10400.5/198.
Morales, H., S. Marín, A.J. Ramos, V. Sanchis, 2010: Influence of post-harvest technologies applied during cold storage of apples in Penicillium expansum growth and patulin accumulation: A review. Food Control 21 (7), 953-962, DOI: 10.1016/j.foodcont.2009.12.016.
Nirenberg, H.I., 1976: Untersuchungen über die morphologische und biologische Differenzierung in der Fusarium Sektion Liseola. Mitteilungen aus der Biologischen Bundesanstalt für Land- und Forstwirtschaft 169, 58-70, DOI: https://doi.org/10.5073/20210624-085725.
Phillips, A.J., P.W. Crous, A. Alves, 2007: Diplodia seriata, the anamorph of “Botryosphaeria” obtusa. Fungal Diversity 25 (1892), 141-55.
Phillips, A.J.L., J. Lopes, J. Abdollahzadeh, S. Bobev, A. Alves, 2012: Resolving the Diplodia complex on apple and other Rosaceae hosts. Persoonia 29, 29-38, DOI: 10.3767/003158512X658899.
Phillips, A.J.L., A. Alves, J. Abdollahzadeh, B. Slippers, M.J. Wingfield, J.Z. Groenewald, P.W. Crous, 2013: The Botryosphaeriaceae: genera and species known from culture. Studies in Mycology 76, 51-167, DOI: 10.3114/sim0021.
Santos, L., A.J.L. Phillips, P.W. Crous, A. Alves, 2017: Diaporthe species on Rosaceae with descriptions of D. pyracanthae sp. nov. and D. malorum sp. nov. Mycosphere 8 (5), 485-511, DOI: 10.5943/mycosphere/8/5/1.
Senula, A., W. Ficke, 1983: Ein Biotest zur Diagnose pilzlicher Rindenbranderreger des Kernobstes. Archives of Phytopathology and Plant Protection 19 (5), 299-308.
Senula, A., 1985: Untersuchungen zur Morphologie und Physiologie von Cryptosporiopsis malicorticis (Cordl). Nannf. und Phlyctaena vagabunda Desm. Archives of Phytopathology & Plant Protection 21 (4), 273-286.
Senula, A., W. Ficke, 1985: Untersuchungen zur Pathogenese des Gloeosporium-Rindenbrandes. Archives of Phytopathology & Plant Protection 21 (3), 183-198.
Sessa, L., E. Abreo, L. Bettucci, S. Lupo, 2016: Botryosphaeriaceae species associated with wood diseases of stone and pome fruits trees: symptoms and virulence across different hosts in Uruguay. European Journal of Plant Pathology 146 (3), 519-530, DOI: 10.1007/s10658-016-0936-4.
Sessa, L., E. Abreo, L. Bettucci, S. Lupo, 2017: Diversity and virulence of Diaporthe species associated with wood disease symptoms in deciduous fruit trees in Uruguay. Phytopathologia Mediterranea 56 (3), 431-444, DOI: 10.14601/Phytopathol_Mediterr-20678.
Trapman, M., P. Maxin, R.W.S. Weber, 2008: Diplodia seriata, cause of black fruit rot in organically grown apples in Holland, Belgium and Northern Germany. In: Boos, Markus (Hrsg.) Ecofruit – 13th International Conference on Cultivation Technique and Phytopathological Problems in Organic Fruit-Growing: Proceedings to the Conference from 18thFebruary to 20th February 2008 at Weinsberg/Germany, 177-181. URL: https://orgprints.org/id/eprint/13668/.
van der Walt, L., R.A. Spotts, C.M. Visagie, K. Jacobs, F.J. Smit, A. McLeod: 2010: Penicillium species associated with preharvest wet core rot in South Africa and their pathogenicity on apple. Plant Disease 94 (6), 666-675, DOI: 10.1094/PDIS-94-6-0666.
Vučković, N., I. Vico, B. Duduk, N. Duduk, 2021: Diversity of Botryosphaeriaceae and Diaporthe species associated with postharvest apple fruit decay in Serbia. Phytopathology, ePub, 2021, DOI: 10.1094/PHYTO-07-21-0304-R.
Weber, R.W.S., N. Dralle, 2013: Fungi associated with blossom-end rot of apples in Germany. European Journal of Horticultural Science 78 (3), 97-105.
Weiler, R., W. Kennel, 1986: Zur Pilzflora auf der Schnittholzstreu einer Apfelanlage. Journal of Plant Diseases and Protection 93 (1), 51-61.
Wiseman, M.S., F.M. Dugan, Y.K. Kim, C.L. Xiao, 2015: A postharvest fruit rot of apple caused by Lambertella corni-maris in Washington State. Plant Disease 99 (2), 201-206, DOI: 10.1094/PDIS-03-14-0327-RE.
Zugschwerdt, J., J. Brenner, K. Zegermacher, J. Hinrichs-Berger, 2021: Brandgefährlich: Schwarzer Rindenbrand an Kernobst. 62. Deutsche Pflanzenschutztagung – 21. bis 23. September 2021. Julius-Kühn-Archiv, 467, 255-256, DOI: 10.5073/20210721-093221.