

Journal für Kulturpflanzen, 74 (09-10). S. 205–215, 2022 | DOI: 10.5073/JfK.2022.09-10.02 | Moyses et al.
Untersuchungen zum Vorkommen phytopathogener Pilze und Schadinsekten und zur Unkrautflora in Hanf (Cannabis sativa) in Österreich
Investigations on the occurrence of pathogenic fungi, insects and weeds in hemp (Cannabis sativa) in Austria
 | Der Autor/Die Autorin 2022 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 5. Juli 2022/26. August 2022 |
Im Jahr 2020 wurde ein Monitoring zum Auftreten von pilzlichen Schaderregern, Schadinsekten und Unkräutern im österreichischen Hanfanbau (Cannabis sativa) durchgeführt. Es wurden 37 Hanffelder auf das Vorkommen von Schädlingen und pilzlichen Schaderregern beprobt. Die Bestimmungsarbeiten erfolgten anhand morphologischer Merkmale im Labor mittels Routinemethoden der Lichtmikroskopie. Die Erhebung der Unkrautflora wurde auf insgesamt 42 Standorten durchgeführt. In den untersuchten Hanffeldern wurden insgesamt 20 Pilzarten aus 17 unterschiedlichen Gattungen, 65 Arthropodenarten aus 27 Familien und 71 Unkrautarten aus 23 Pflanzenfamilien festgestellt. Unter den diagnostizierten pilzlichen Schaderregern zählen Botrytis cinerea, Fusarium spp., Pseudoperonospora cannabina und Sclerotinia sclerotiorum zu den bedeutendsten Arten. Die größte Bedeutung der nachgewiesenen Schadinsekten kommt Grapholita delineana, Helicoverpa armigera und Ostrinia nubilalis zu. Chenopodium album, Amaranthus spp., Echinochloa crus-galli und Cirsium arvense wurden als die dominanten Unkrautarten identifiziert.
Krankheiten, Monitoring, Nutzhanf, Schädlinge, Unkräuter, Verbreitung
In 2020, a monitoring of pathogenic fungi, insects and weeds in hemp (Cannabis sativa) has been performed in the main cultivation areas of Austria. Thirty-seven hemp fields were sampled for the presence of pests and fungal pathogens. The identification work was carried out on the basis of morphological characteristics in the laboratory using routine methods of light microscopy. The survey of weed flora was conducted at a total of 42 hemp fields. Overall, 20 pathogenic fungal species belonging to 17 different genera, 65 arthropod species belonging to 27 families and 71 weed species belonging to 23 families were detected. Among these, Botrytis cinerea, Fusarium spp., Pseudoperonospora cannabina and Sclerotinia sclerotiorum represent the most important fungal species. Grapholita delineana, Helicoverpa armigera and Ostrinia nubilalis are the most harmful insect species and Chenopodium album, Amaranthus spp., Echinochloa crus-galli and Cirsium arvense were identified as the major weed species.
Diseases, distribution, industrial hemp, monitoring, pests, weeds
Der Hanf (Cannabis sativa L.) ist eine der ältesten Kulturpflanzen auf der Welt und zeichnet sich durch die unterschiedlichsten Verwendungsmöglichkeiten aus (Bosca & Karus, 1998). Die Kulturart wird als Faserpflanze, in der Pharmazie und Kosmetikindustrie sowie als nachwachsender Rohstoff genutzt (Bosca & Karus, 1998). In den letzten Jahren hat der Hanf auch in der menschlichen Ernährung wieder Bedeutung erlangt, denn die Samen sind ein hochwertiges Nahrungsmittel, und zwar insbesondere das daraus gewonnene Hanfmehl und Hanföl. In Österreich hat sich entsprechend die Anbaufläche des Hanfs innerhalb der letzten 10 Jahre nahezu vervierfacht und lag im Jahr 2021 bei 1884 ha (2010: 537 ha). Die größten Anbauflächen befinden sich in Niederösterreich gefolgt von Oberösterreich, Burgenland und der Steiermark (Statistik Austria, 2021).
Die Kulturführung in Hanf gilt gemeinhin als relativ problemlos, denn die Ansprüche an den Boden und das Klima sind gering und auch dem Pflanzenschutz in Hanf wird grundsätzlich wenig Bedeutung beigemessen (Patschke et al., 1997; Amaducci et al., 2015). Zahlreiche phytopathogene Pilze und Schadinsekten sind jedoch bekannt und wirtschaftliche Schäden sind nicht auszuschließen (McPartland et al., 2000). Studien deuten auch darauf hin, dass eine Verunkrautung in der frühen Wachstumsphase der Hanfpflanze einen Einfluss auf den Ertrag haben kann (z. B. Jankauskienė et al., 2014).
In Österreich sind systematische Untersuchungen zum Vorkommen von phytopathogenen Pilzen und Schadinsekten sowie zur Verunkrautung in Hanf kaum vorhanden. Gerade im Hinblick auf die zunehmende Bedeutung des Hanfs in Österreich sind derartige Daten notwendig, um Beraterinnen und Berater, aber auch die Betriebe selbst, über das Auftreten der Schadorganismen und Unkräuter und deren potenzielle Gefahr für die Hanfproduktion zu informieren. Darauf aufbauend können zielgerichtete Pflanzenschutzmaßnahmen abgeleitet werden.
Die Ziele dieser Arbeit waren es daher, einen (1) ersten Überblick über das Vorkommen phytopathogener Pilze und Schadinsekten zu geben, (2) die Unkrautflora und das Ausmaß der Verunkrautung zu charakterisieren und (3) auf Basis dessen, Folgerungen für den Pflanzenschutz in Hanf in Österreich zu diskutieren.
In Abbildung 1 sind die Standorte der untersuchten Hanffelder aufgeführt und nummeriert. Diese befinden sich in den wichtigsten Anbauregionen in Österreich und verteilten sich wie folgt auf die einzelnen Bundesländer: Niederösterreich (20), Oberösterreich (9), Burgenland (7) und Steiermark (6). Die Bonituren bzw. Beprobungen der Hanffelder wurden von Juli bis Anfang September 2020 durchgeführt. Jeder Standort wurde zweimal beprobt, um das zeitlich unterschiedliche Auftreten der Schadorganismen zu den verschiedenen Entwicklungsstadien des Hanfes (vegetative und generative Phase) zu berücksichtigen.
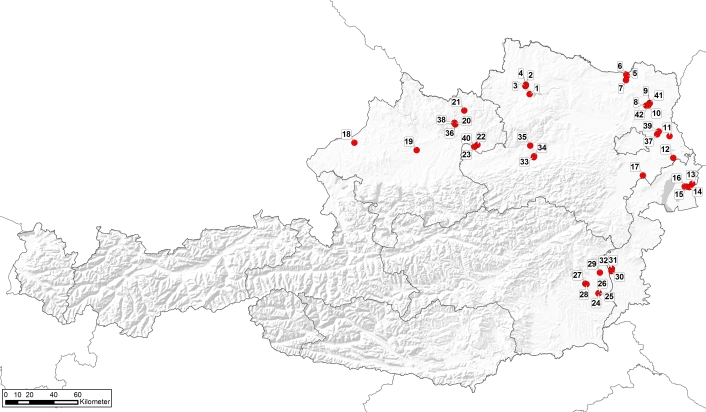
Abb. 1. Überblick über die Standorte der untersuchten Hanffelder (n = 42) in Österreich. Auf den Standorten 38 bis 42 wurde nur die Unkrautflora erhoben.
In Summe wurden 37 Hanffelder auf einen Befall durch tierische und pilzliche Schaderreger bonitiert und beprobt. Dabei wurde ein besonderes Augenmerk auf das Vorkommen bekannter bzw. potentieller Schaderreger und deren Schadsymptome gelegt. Erhoben wurde das Auftreten von Arthropoden und pilzlichen Schaderregern (Ascomycota, Basidiomycota, Oomycota). Pro Feld wurden an 4 Stellen mindestens 10 Pflanzen bonitiert. Einerseits wurden visuelle Kontrollen an der gesamten Pflanze durchgeführt. Andererseits wurden gesichtete Insekten mittels Röhrchen sowie ganze Pflanzen bzw. Pflanzenteile, welche makroskopisch erkennbare Strukturen von pilzlichen Schaderregern bzw. typische Symptome oder sonstige Anomalien aufwiesen, für die Untersuchungen im Labor gesammelt. Zusätzlich wurden weiße Kunststoffschalen für die Durchführung von Klopfproben herangezogen, um in Triebspitzen bzw. auf Seitentrieben befindliche Insekten abzufangen. Hinsichtlich Arthropoden wurde nur das Auftreten an den oberirdischen Pflanzenteilen erfasst. Die Auswertung und Bestimmung der Insektenfänge erfolgte im Labor mittels Stereomikroskop (Olympus SZX10). Für die Bestimmungsarbeiten der pilzlichen Schaderreger wurden die gängigen mykologischen Routinemethoden der Lichtmikroskopie (Olympus BX53) angewandt. Die Pilzstrukturen wurden mit Wittmann’s Blau (Wittmann, 1970) gefärbt und mit dem Programm ‘cellSens’ (Ver.1.18) von Olympus vermessen.
Im Rahmen der Erhebung der Unkrautflora wurden insgesamt 42 Hanffelder nach der Methode von Braun-Blanquet (1964) bonitiert (Flächengröße 25 bis 30 qm, Aufnahmen ca. 5 m vom Feldrand weg). Die Daten wurden in das Programm HITAB5 eingegeben (Wiedermann, 1995), um die Unkrautarten nach Häufigkeit (Stetigkeit) und Dominanz zu ordnen. Für die Bestimmung des mittleren Deckungsgrades wurde die nicht-metrische Braun-Blanquet-Skalierung in eine metrische Skala umgewandelt, wie von Van der Maarel (1979) vorgeschlagen. Die Prozentzahlen wurden aufsummiert und durch die Gesamtzahl der Untersuchungsflächen (42) geteilt. Nomenklatur und Taxonomie folgen Fischer et al. (2008). Einige Arten wurden nur auf Gattungsebene bestimmt. Die Einstufung der Arten nach ihrer Lebensform (annuell, perennierend) beruht auf Klotz et al. (2002).
In den beprobten Hanfbeständen wurden in Summe 20 Arten aus 17 unterschiedlichen Gattungen nachgewiesen. Der überwiegende Teil ist den Ascomycota zuzuordnen (90 %), eine Art zählt zu den Basidiomycota und eine weitere Art zu den Oomycota.
Die 10 Arten, welche im Rahmen der Untersuchungen am häufigsten nachgewiesen wurden, sind in Abbildung 2 zusammengefasst. Der Pilz Botrytis cinerea trat an 57 % der beprobten Flächen über alle Anbauregionen hinweg auf und stellt damit den am häufigsten nachgewiesenen Schadpilz dar. Ein Befall durch Botryris cinerea wurde überwiegend an den Blütenständen der Pflanzen verzeichnet (Abb. 6). Befallene Blüten verbräunten und starben ab, wodurch sich die Blütenstände partiell oder zur Gänze braun verfärbten. Zum Teil wurden auch die Stängel befallen, an welchen zunächst gelbe, später braune Verfärbungen entstanden. In weiterer Folge kam es zu einer Welke der Pflanzen, welche an den Befallsstellen oft auch umknickten. Auf dem verfärbten Gewebe wurde ein für Botrytis cinerea charakteristischer grauer Belag bestehend aus Sporenträgern und Sporen des Pilzes gebildet.
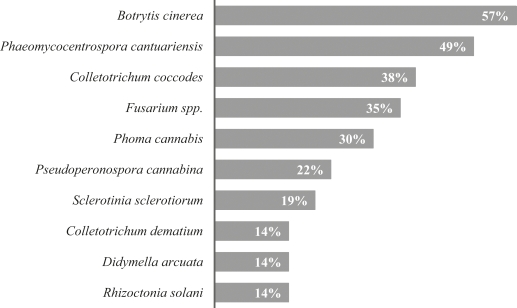
Abb. 2. Die 10 häufigsten phytopathogenen Pilzarten (in % der untersuchten Flächen) in Hanf in 2020.
An knapp der Hälfte aller beprobten Hanffelder (49 %) wurde die Phaeomycocentrospora-Blattfleckenkrankheit, verursacht durch den Pilz Phaeomycocentrospora cantuariensis, diagnostiziert. Die genannte Art ist somit der am zweithäufigsten aufgetretene pilzliche Schaderreger und konnte ebenfalls in allen Anbaugebieten nachgewiesen werden. Als Symptome entstanden an den Blättern über die gesamte Blattspreite verteilt braune bis gräuliche Flecken, die ein helles Zentrum und einen breiten, dunkelbraunen Rand aufwiesen (Abb. 6). Die Flecken waren rundlich bis unregelmäßig geformt und flossen oft zu großflächigeren Nekrosen zusammen. Daneben wurde der Falsche Mehltau, verursacht durch Pseudoperonospora cannabina, häufiger diagnostiziert. Letzterer trat in allen Anbaugebieten an insgesamt 22 % der Standorte auf. Ein Befall äußerte sich durch unregelmäßige bis eckige, braune Blattflecken, welche einen gelben Hof aufwiesen (Abb. 6). Blattunterseits wurde auf dem verfärbten Gewebe ein brauner bis grau-violetter Sporangienrasen gebildet. Befallene Blätter nekrotisierten und fielen ab. Des Weiteren wurde die Braunfleckenkrankheit, verursacht durch Didymella arcuata, in Niederösterreich und Oberösterreich an fünf Standorten (1, 5, 23, 34 und 35) diagnostiziert. Didymella arcuata verursachte an den Blättern rundliche bis unregelmäßige, braune Flecken mit scharf abgegrenztem Rand. Auf dem abgestorbenen Blattgewebe wurden dunkelbraune bis schwarze Pseudothezien gebildet. Daneben konnte auch deren asexuelle Form, Ascochyta arcuata, nachgewiesen werden, welche auf den Blattflecken schwarze Pyknidien ausbildete. Zum Teil ist das abgestorbene Gewebe aus dem Zentrum der Flecken herausgebrochen, wodurch die Blattspreiten durchlöchert wirkten. Ähnliche Symptome an den Blättern wurden auch durch Septoria neocannabina hervorgerufen. Letztere verursachte auch braune Stängelläsionen, welche einen dunkelbraunen bis schwarzen Rand aufwiesen. Mit Fortschreiten der Krankheit wurden auf dem verfärbten Blatt- und Stängelgewebe zahlreiche schwarze Pyknidien gebildet. Septoria neocannabina trat nur in Oberösterreich an drei Standorten (20, 21 und 36) auf, verursachte aber an allen drei Feldern einen starken Befall an den Blättern und Stängeln der Pflanzen. Septoria cannabis, welche neben Septoria neocannabina als Pathogen an Hanf beschrieben wird, wurde in den vorliegenden Untersuchungen nicht nachgewiesen.
Hinsichtlich der Stängelparasiten dominierten Arten der Gattungen Colletotrichum, Fusarium und Phoma. Die Anthraknose, verursacht durch Colletotrichum coccodes und Colletotrichum dematium, wurde an mehr als der Hälfte aller Hanffelder nachgewiesen. Als Symptome entstanden an den Stängeln gräuliche bis weiße Läsionen, auf denen schwarze Acervuli gebildet wurden, wodurch sich die Befallsstellen schwarz verfärbten. In diesen Bereichen löste sich die Rinde leicht ab. Colletotrichum coccodes trat insgesamt häufiger an 38 % der Standorte über alle Anbauregionen hinweg auf. Colletotrichum dematium wurde bis auf einem Standort in Oberösterreich nur im Burgenland diagnostiziert. Nur an einem Schlag im Burgenland (Standort 16) konnte eine Mischinfektion der Pflanzen durch beide Colletorichum-Arten festgestellt werden. Eine Welke und Stängelfäule verursacht durch Fusarium spp. trat an etwa einem Drittel der beprobten Hanffelder auf, ein zusätzlicher Befall der Blütenstände wurde aber nur an drei Standorten diagnostiziert. Phoma cannabis wurde an 30 % der Standorte nachgewiesen und rief längliche, braun bis grau verfärbte Stängelläsionen hervor, worauf zahlreiche schwarze Pyknidien gebildet wurden. Daneben wurde an 19 % der Standorte, insbesondere an jenen in den eher kühl-feuchteren Anbaugebieten (Nördliches Granit- und Gneishochland, Nördliches Alpenvorland), ein Befall der Pflanzen durch Sclerotinia sclerotiorum beobachtet. Als Symptome zeigten sich an den Blütenständen, am Stängelgrund oder entlang des Stängels hellbraune bis weißlich-graue Aufhellungen. Auf dem verfärbten Gewebe sowie im Stängelinneren wurden ein weißes, watteartiges Myzel und schwarze, bis zu 2 cm große und fallweise noch größere Sklerotien gebildet (Abb. 6). Befallene Pflanzen welkten, vertrockneten und starben ab. Oft war Stängelbruch die Folge.
Rhizoctonia solani wurde als einzige Pilzart aus der Abteilung Basidiomycota nachgewiesen. Letztere verursachte braune, zum Teil etwas eingesunkene Verfärbungen am Stängelgrund. Die Blätter befallener Pflanzen verfärbten sich gelb, die Pflanzen blieben im Wachstum zurück und welkten. Die Rhizoctonia-Stängelgrundfäule wurde an 14 % der Standorte diagnostiziert.
In einzelnen Beständen konnte ein starker Befall durch Botrytis cinerea, Fusarium spp., Phaeomycocentrospora cantuariensis, Pseudoperonospora cannabina, Sclerotinia sclerotiorum und Septoria neocannabina verzeichnet werden. Die übrigen Schaderreger traten meist in kleineren Befallsnestern oder an einzelnen Pflanzen auf.
In den beprobten Hanffeldern wurden insgesamt 65 Arthropodenarten aus 27 Familien festgestellt.
Die meisten Arten waren den Wanzen (Heteroptera), Käfern (Coleoptera), Zikaden (Cicadina) und Schmetterlingen (Lepidoptera) zuzuordnen. Ein kleiner Teil zählte zu den Blattläusen (Aphidoidea), Minierfliegen (Diptera) und Milben (Acari) (Abb. 3). Der Anteil der bekannten bzw. potentiellen Schädlinge dominierte mit 72 % und jener der Indifferenten lag bei 25 %. Auch zahlreiche Nützlinge konnten in den Hanffeldern gesichtet werden. Bis auf zwei räuberische Wanzenarten wurden diese in der vorliegenden Studie jedoch nicht explizit erfasst. Die 10 häufigsten Arten und deren Anteile an den beprobten Hanffeldern sind der Abbildung 4 zu entnehmen.
Unter den schädlichen Arten dominierten die beiden hanfspezifischen tierischen Schaderreger die Hanfminierfliege (Liriomyza cannabis) und die Kleine Hanfmotte (Grapholita delineana). Unterschiedlichste Entwicklungsstadien von Liriomyza cannabis bzw. deren Schadsymptome an den Blättern konnten an 92 % der beprobten Hanffelder festgestellt werden. Die Maden der sehr kleinen, schwarz-gelb gefärbten Minierfliege verursachen durch ihre Fraßtätigkeit im Blattinneren anfänglich spiralförmige und später schlangenförmig gewundene, helle Blattminen (Collins et al., 2016). Bei Grapholita delineana handelt es sich um einen unscheinbaren braunen Falter aus der Familie der Wickler, welcher an den weißen Streifen der Vorderflügel zu erkennen ist (Abb. 6). Die gelblich bis rosa gefärbten Larven fressen zu Beginn an den Blättern und bohren sich später in den Stängel ein. Die Larven späterer Generationen ernähren sich auch von den Blüten und Samen (Abb. 6). Dadurch kommt es nicht nur zu Skelettierfraß an Blättern, zu Stängelverdickungen und -verkrümmungen, zum Vergilben und Absterben ganzer Triebe und Blätter, sondern auch zur Wachstumshemmung und zum Vertrocknen der Blütenspitzen (Abb. 6) (McPartland, 2002). Ähnliche Schäden können von Raupen des Maiszünslers (Ostrinia nubilalis) verursacht werden, welche in der vorliegenden Studie jedoch nur an Standort 27 nachgewiesen wurden.
Der Hanf- oder Hopfenerdfloh (Psylliodes attenuata) konnte an der Hälfte aller Hanffelder nachgewiesen werden. Er ist ein ovaler, 2-3 mm langer, schwarz gefärbter Blattkäfer mit einem metallisch grün bis bronzefarbenen Glanz. Auch sein auffälliges Schadbild, welches sich in Form eines Loch- bzw. Fensterfraßes an Blättern äußert, konnte mehr oder weniger stark beobachtet werden. Zudem wurden Einzelfunde von an Hanf bereits beschriebenen Arten verzeichnet, wie der Gefleckte Kohltriebrüssler (Ceutorhynchus pallidactylus) und eine Stachelkäferart der Gattung Mordellistena (McPartland et al., 2000).
Aus Abbildung 3 ist zu entnehmen, dass die meisten festgestellten Insektenarten (35 %) den Wanzen zuzuordnen waren, wobei Wanzen der Gattung Lygus besonders hervortraten. Als dominierende Art wurde die Gemeine Wiesenwanze (Lygus pratensis) ermittelt, aber auch die Behaarte Wiesenwanze (Lygus rugulipennis) wurde sehr häufig festgestellt. Zudem traten auch die Zimtwanze (Corizus hyoscyami) und die Beerenwanze (Dolycoris baccarum) relativ häufig in Erscheinung. Erwähnenswert sind auch die Einzelfunde zweier gebietsfremder Baumwanzenarten, wie jener der Marmorierten Baumwanze (Halyomorpha halys) und der Grünen Reiswanze (Nezara viridula), welche in Österreich in den vergangenen Jahren an zahlreichen landwirtschaftlichen Kulturen schädlich in Erscheinung traten (Moyses et al., 2022).
Insgesamt wurden an 86 % der Hanffelder durch Zikaden verursachte Saugschäden an den Blättern festgestellt. Viele davon waren vermutlich auf Kleinzikaden der Gattung Eupteryx zurückzuführen, welche auf zwei Drittel der Flächen nachgewiesen wurden. Zudem wurden jeweils 3 Funde der Windenglasflügelzikade (Hyalesthes obsoletus) (Standorte 12, 14 und 15) und der Bläulingszikade (Metcalfa pruinosa) (Standorte 11, 14 und 16) verzeichnet.
Ebenso wurden auf 30 % der Flächen Blattläuse der Gattung Phorodon gefunden. An Hanf sind zwei Arten dieser Gattung beschrieben: die Hanfblattlaus (Phorodon cannabis) und die Hopfenblattlaus (Phorodon humuli) (Müller & Karl, 1976). An zwei oberösterreichischen Standorten wurden zudem die Grüne Gurkenblattlaus (Aphis gossypii) und eine Blattlaus der Gattung Uroleucon festgestellt. Beide werden neben Myzus persicae und Aphis fabae auch durch McPartland et al. (2000) erwähnt.
Die Baumwollkapseleule (Helicoverpa armigera) wurde auf 32 % der Standorte festgestellt. Besonders auffällig und zahlreich waren ihre Eier und Raupen an den Marchfelder Standorten 11 und 37 Anfang September vertreten (Abb. 6). Unterschiedlichste Larvenstadien verursachten hauptsächlich Schäden an den Blütenständen und Samen. Zudem wurden Einzelfunde von Raupen der Gemüseeule (Lacanobia oleracea), der Kohleule (Mamestra bassicae), dem Zackenbindigen Rindenspanner (Ectropis crepuscularia) und dem Birkenspanner (Biston betularia) verzeichnet, welche auch als blattfressende Schädlinge an Kulturhopfen (Humulus lupulus) beschrieben werden (Weihrauch, 2000).
Neben den Insekten wurden an 5 Standorten am zweiten Boniturtermin Spinnmilben festgestellt, wobei nur an Standort 7 die Gemeine Spinnmilbe (Tetranychus urticae) eindeutig identifiziert werden konnte.
Es wurden insgesamt 71 Unkrautarten aus 23 Pflanzenfamilien in den untersuchten Hanffeldern bonitiert. Darunter waren überwiegend dikotyle Unkräuter (>85 %). Es wurden nur wenige monokotyle Arten (10) registriert und eine Art gehörte zu den Schachtelhalmgewächsen. Den Ausfallkulturen konnten fünf Arten zugrechnet werden. Das Artenspektrum in den untersuchten Hanffeldern schwankte zwischen 4 und 23. Im Durchschnitt kamen annähernd 10 verschiedene Unkrautarten vor.
Die 10 häufigsten Unkrautarten sind in Abbildung 5 aufgeführt. Die Unkrautart mit der höchsten Stetigkeit war Chenopodium album, welcher auf 88 % der Hanffelder gefunden wurde. Die nächst häufigen dikotylen, einjährigen Unkräuter waren Amaranthus spp. (im Wesentlichen Amaranthus retroflexus und A. powellii) mit 74 % und Persicaria spp. (Persicaria maculosa, Persicaria lapathifolia) sowie Chenopodium hybridum mit jeweils 43 %. Die häufigsten Ungräser waren Hirse-Arten, und zwar Echinochloa crus-galli mit 64 % und Setaria pumila (Abb. 5) mit 48 %. Der Anteil der perennierenden Unkrautarten lag bei fast einem Drittel, wobei nur Cirsium arvense und Convolvulus arvensis mit jeweils 57 % und 45 % besonders häufig in den Hanffeldern auftraten. In den warmen Tieflandlagen (Naturraum Pannonische Flach- und Hügelländer, Standorte 12-14, 16) traten vereinzelt auch sehr wärmeliebende, neopythische Arten auf, wie beispielsweise Portulaca oleracea, Datura stramonium und Sorghum halepense. In den eher kühl-feuchteren Anbaugebieten (Nördliches Granit- und Gneishochland, Nördliches Alpenvorland, Standorte 2-4) traten vermehrt Arten der Getreide- und Hackfrucht-Unkrautgesellschaften auf, z. B. Tripleurospermum inodorum, Cyanus segetum und Galeopsis spp. Die Aufnahmen zeigen auch, dass die mittleren Deckungsgrade der Unkräuter relativ gering waren. Chenopodium album erreichte den höchsten mittleren Deckungsgrad von 4 % gefolgt von den Artengruppen Persicaria spp. und Amaranthus spp. sowie Echinochloa crus-galli mit jeweils 3 %, 3 % und 2 %. Der Hanf wiederum erreichte auf mehr als zwei Drittel der untersuchten Felder einen hohen Deckungsgrad (Deckungsklassen 4 und 5 der Braun-Blanquet Skala), gleichwohl der mittlere Deckungsgrad bei 65 % lag.

Abb. 6. Häufige Unkräuter, phytopathogene Pilze und Schadinsekten in Hanf: A. Chenopodium album; B. Setaria pumila; C. Botrytis cinerea, Schadbild am Blütenstand; D. Sclerotinia sclerotiorum, Schadbild am Stängel; E. Blattflecken verursacht durch Phaeomycocentrospora cantuariensis; F. Blattflecken verursacht durch Pseudoperonospora cannabina; G. Grapholita delineana, Falter; H. Grapholita delineana, Schadbild mit Larve; I. Helicoverpa armigera, Larven; J. Helicoverpa armigera, Schadbild am Blütenstand © Swen Follak, Julia Kauschitz, Anna Moyses.
In diesem Monitoring wurde ein Großteil der in Hanf in Österreich vorkommenden phytopathogenen Pilze, Schadinsekten und Unkrautarten erfasst. Gerade das Auftreten von Schadinsekten und phytopathogene Pilzen ist zeitlichen und örtlichen Schwankungen unterworfen. Es ist daher nicht auszuschließen, dass Arten aufgrund des Erhebungszeitraumes von nur einem Jahr und den festgesetzten Zeitpunkten der einzelnen Aufnahmen innerhalb der Vegetationsperiode nicht registriert wurden. Es wird daher kein Anspruch auf Vollständigkeit erhoben.
Im Rahmen der Untersuchungen konnte mit dem Nachweis von 20 Arten aus 17 unterschiedlichen Gattungen gezeigt werden, dass Cannabis sativa in Österreich von zahlreichen pilzlichen Schaderregern befallen wird. Die Erhebungen von Meixner (2000) in österreichischen Hanfbeständen im Jahr 1998 ergaben, dass das Auftreten der Schadpilze auf einzelne Felder und dabei wiederum meist auf einzelne Pflanzen beschränkt war. Hingegen wurde in der vorliegenden Studie der überwiegende Teil der Pathogene in allen Anbauregionen nachgewiesen, allerdings traten die diagnostizierten pilzlichen Erreger in unterschiedlichen Befallsstärken auf.
Botrytis cinerea und Sclerotinia sclerotiorum stellen weltweit gesehen die häufigsten und bedeutendsten Schaderreger an Cannabis sativa dar (McPartland et al., 2000). Dies wird auch durch die Untersuchungen von Meixner (2000) und Patschke et al. (1997) unterstrichen, welche Botrytis cinerea und Sclerotinia sclerotiorum als häufigste Pilzarten nachweisen konnten. Auch in der vorliegenden Arbeit stellt Botrytis cinerea den am öftesten aufgetretenen Krankheitserreger dar, ein Befall durch Sclerotinia sclerotiorum wurde hingegen nur an 19 % der beprobten Hanffelder diagnostiziert. Beide Pilzarten befallen die Blütenstände und verursachen eine Stängelfäule, welche oft zur Notreife oder zum gänzlichen Absterben der Pflanzen führt. Des Weiteren werden an den befallenen Pflanzenteilen Sklerotien gebildet, die das Erntegut verunreinigen und mehrere Jahre im Boden überleben können. Daneben kann Botrytis cinerea die Samen infizieren sowie Keimpflanzen befallen, welche in weiterer Folge absterben (McPartland et al., 2000). Dadurch entstehen qualitative und quantitative Verluste hinsichtlich Faser-, Blüten- und Samenertrag, wodurch diese Pilzarten als bedeutende Schaderreger an Nutzhanf einzustufen sind.
In der Literatur werden des Weiteren zahlreiche Blattfleckenerreger an Cannabis sativa beschrieben (Bakro et al., 2018, Bergstrom et al., 2019, McPartland et al., 2000). Darunter werden die Septoria-Blattfleckenkrankheit, hervorgerufen durch Septoria cannabis und Septoria neocannabina, die Braunfleckenkrankheit, verursacht durch Didymella spp., Ascochyta spp. und Phoma spp., sowie der Flasche Mehltau Pseudoperonospora cannabina zu den Bedeutendsten gezählt, wobei insbesondere der Falsche Mehltau ein enormes Schädigungspotential besitzt (McPartland et al., 2000). Die genannten Krankheiten wurden in den vorliegenden Untersuchungen nur an wenigen Standorten beobachtet, ausgenommen Pseudoperonospora cannabina und Phoma cannabis. Letztere wurde aber nicht an den Blättern, sondern nur an den Stängeln der Pflanzen nachgewiesen. Mit Ausnahme des Falschen Mehltaus und der Septoria-Blattfleckenkrankheit war auch deren quantitatives Auftreten innerhalb der Bestände gering. Der am häufigsten aufgetretene Blattfleckenerreger, nicht nur hinsichtlich der Anzahl der Standorte, sondern auch hinsichtlich der Quantität innerhalb der betroffenen Bestände, ist Phaeomycocentrospora cantuariensis. Die Phaeomycocentrospora-Blattfleckenkrankheit stellt an Hanf eine relativ neue Krankheit dar. Letztere wurde an Cannabis sativa erstmals im Jahr 2019 beschrieben und konnte bislang nur in den U.S.A. und in Österreich nachgewiesen werden (Bergstrom et al., 2019, Kauschitz & Plenk, 2022). Ein Befall durch Blattfleckenerreger führt zu einem Verlust der grünen Blattmasse und einer Reduktion der Photosyntheseleistung, wodurch die Erträge von Fasern, Blüten und Samen gemindert werden können (McPartland et al., 2000). Im Gegensatz zu den Ergebnissen der vorliegenden Studie, wurden in vorangegangenen Untersuchungen in Österreich und Deutschland nur ein vereinzeltes Auftreten von Blattkrankheiten mit geringer Befallsstärke beobachtet (Meixner, 2000, Patschke et al., 1997).
Den dritthäufigsten pilzlichen Schaderreger stellt Colletotrichum coccodes dar. Letzterer kann sowohl die Blätter als auch die Stängel der Pflanzen befallen. Im Zuge des Monitorings trat dieser nur als Stängelparasit an einzelnen Pflanzen in Erscheinung. Hoffmann (1958; 1959) stufte Colletotrichum coccodes als wirtschaftlich bedeutenden Schaderreger an Cannabis sativa ein. Die genannte Pilzart weist einen großen Wirtspflanzenkreis auf und wird durch den Klimawandel begünstigt, wodurch Colletotrichum coccodes zukünftig nicht nur an Hanf, sondern auch an anderen Kulturarten, wie z. B. Kartoffel, verstärkt auftreten und Probleme verursachen könnte (Huss, 2012). Daneben trat ein Stängelbefall verursacht durch Fusarium spp. an fast gleichvielen Standorten auf. Arten der Gattung Fusarium werden als bedeutende Schaderreger an Hanf beschrieben (Bakro et al., 2018, Bergstrom et al., 2019, McPartland et al., 2000). Dies konnte anhand der vorliegenden Untersuchung bestätigt werden. Einerseits wurden Welken und Stängelfäulen verursacht, andererseits wurden auch die Blütenstände befallen. Eine mögliche Mykotoxinbelastung des Erntegutes verursacht durch Fusarium spp. wurde im vorliegenden Monitoring nicht untersucht. Patschke et al. (1997) konnten Fusarium-Mykotoxine im Erntegut (Samen) nachweisen.
An Hanf werden auch Arten der Gattung Pythium beschrieben, welche insbesondere Keimpflanzen aber auch ältere Pflanzen schädigen (McPartland et al., 2000). Im Verlauf des Monitorings konnte keine Pythium-Art diagnostiziert werden. Daneben konnte auch keine Phytophthora-Art nachgewiesen werden, wodurch die Annahme unterstützt wird, dass Cannabis sativa für Phytophothora spp. keine geeignete Wirtspflanze darstellt (McPartland et al., 2000). Israel (2021) beschreibt, dass der Anbau von Hanf einem Befall durch Phytophthora infestans entgegenwirkt. Zu beachten ist hierbei, dass Keimpflanzen aufgrund der später in der Vegetationsperiode festgesetzten Beprobungszeitpunkte in dem vorliegenden Monitoring nicht untersucht wurden.
Die vorliegenden Untersuchungen haben die Angaben von Gottwald (2002) bestätigt, dass der Hanf für eine Vielzahl von Insekten ein attraktives Biotop darstellt und dass der Anteil der Schädlinge dominiert. Zwar wurde das Schadensausmaß der aufgetretenen tierischen Schaderreger nicht erhoben, jedoch ist von einigen Arten bei Massenauftreten ein ertragsrelevanter Befall zu erwarten.
Durch die Hanfminierfliege kann je nach Befallsstärke die Photosyntheseleistung der Pflanze stark eingeschränkt werden, was die Pflanzenentwicklung und somit den Ertrag negativ beeinträchtigt. Während sie im geschützten Hanfanbau starke Schäden verursachen kann (McPartland et al., 2000), wurden an den Monitoringsstandorten keine nennenswerten Schäden beobachtet.
Anders verhält es sich bei der Kleinen Hanfmotte, deren Larven durch ihre Fraßtätigkeit im Stängel und Blütenstand nicht nur beträchtliche Schäden an Faserhanf, sondern auch an Körnerhanf verursachen können. Die Einbohrstellen der Larven bieten nämlich auch Schaderregern ideale Eintrittspforten, was nicht nur die Quantität, sondern auch die Qualität des Erntegutes negativ beeinflusst (McPartland, 2002).
Der Hanferdfloh kann besonders bei Jungpflanzen zum Problem werden, wenn nicht nur die Blätter bis zum Kahlfraß, sondern auch die Triebe geschädigt werden. Zudem können auch unreife Samen angefressen werden (Heikertinger, 1913).
Die häufig nachgewiesenen Lygus-Arten können sich laut Gottwald (2002) bei entsprechender Populationsdichte als schädlich erweisen. Cranshaw et al. (2019) vermuten eine schädigende Wirkung durch die Saugtätigkeit an den unreifen Samen. Über das Auftreten der invasiven Grünen Reiswanze an Hanf wurde bereits mehrmals berichtet (McPartland et al., 2000). Auch die Marmorierte Baumwanze kann sich laut Britt et al. (2019) an Cannabis sativa vollständig entwickeln, jedoch stellt sie derzeit keine Gefahr für den Ertrag und die Qualität von Industriehanf dar.
Die Untersuchungen von Gottwald (2002) zeigten, dass die Bunte Kartoffelblattzikade (Eupteryx atropunctata) in Hanfbeständen eine hohe Abundanz aufweisen kann, wodurch es zu einer starken Beeinträchtigung der Assimilationsfläche der Pflanze kommen kann.
Bei Massenvermehrung im Spätsommer kann auch die hanfspezifische Blattlaus Phorodon cannabis Saugschäden verursachen, zusätzlich fungiert sie als Virus-Vektor (Mielke & Schöber-Butin, 2002).
Auch die Baumwollkapseleule hat das Potential an Hanf ertragsmindernd in Erscheinung zu treten, da ihre Raupen direkte Schäden in den Blütenständen und an den Samen verursachen (McPartland et al., 2000, Abb. 6). Cranshaw et al. (2019) berichtete von einem Ertragsverlust von 30 % an Körnerhanf verursacht durch die verwandte Art Helicoverpa zea in North Carolina/USA.
Die Zahl von >70 Unkrautarten (inklusive Ausfallkulturen) in Hanf erscheint im Vergleich zu anderen Sommerkulturen eher niedrig. So beschrieben beispielsweise Pinke et al. (2016) und Mehrtens et al. (2005) 154 Unkrautarten in Sojabohne und 204 Unkrautarten in Mais – bei jedoch deutlich mehr untersuchten Feldern (262 vs. 2602). Vergleichbare Untersuchungen zur Unkrautflora in Hanf in Österreich und Europa sind rar. Jankauskienė et al. (2014) registrierten 31 Unkrautarten in Hanffeldern, und zwar 26 einjährige dikotyle und monokotyle sowie fünf perennierende Arten. In dieser Studie umfasste die Unkrautflora in den meisten untersuchten Hanffeldern wärmebedürftige, zumeist einjährige dikotyle Arten (z. B. Chenopodium album, Amaranthus spp.) und C4-Gräser (Echinochloa crus-galli, Setaria pumila). Dieses Artenspektrum ist typisch für Sommerkulturen und entwickelt sich vor allem auch auf Mais-, Sojabohne- oder Ölkürbisfeldern (Mucina et al., 1993).
Chenopodium album, Amaranthus spp. und Echinochloa crus-galli konnten als die dominanten Unkrautarten in Hanf in dieser Studie identifiziert werden. Alle drei haben eine sehr große Anpassungsfähigkeit, die es ihnen erlaubt, sich auf diverse Umwelt- und Standortbedingungen einzustellen und sie in die Lage versetzt, unter günstigen Bedingungen konkurrenzstarke Individuen auszubilden (Holzner & Glauninger, 2005). Die Untersuchungen von Patschke et al. (1997) und Jankauskienė et al. (2014) zeigten gleichsam, dass Chenopodium album in den Hanffeldern die dominierende Unkrautart war. Generell zählen auch Persicaria lapathifolia und Persicaria maculosa zu den häufigsten Unkräutern in Feldkulturen in Österreich (Holzner & Glauninger, 2005), die sich entsprechend auch in Hanf entwickeln können. Datura stramonium und Sorghum halepense sind bisher nur sporadisch aufgetreten, ihre zunehmende Ausbreitung in den Ackerflächen ist jedoch gut dokumentiert (Follak et al., 2017). Aufgrund ihrer Biologie und ihres Wuchsverhaltens sind beide Arten als sehr konkurrenzstark einzustufen (Holzner & Glauninger, 2005) – auch gegenüber dem Hanf (Follak, pers. Beob.). Datura stramonium wiederum bedarf besonderer Aufmerksamkeit, da diese Pflanze giftige Tropanalkaloide enthält, die das Erntegut kontaminieren können (Söchting & Zwerger, 2020).
In der Mehrheit der untersuchten Felder erreichte der Hanf hohe Deckungsgrade zum Zeitpunkt der jeweiligen Bonitur. Dies und die entsprechend geringen absoluten Unkrautzahlen zusammen mit niedrigen Deckungswerten unterstreichen die hohe Konkurrenzkraft des Hanfes, was immer wieder auch in Literatur hervorgehoben wird (Jankauskienė et al., 2014, Serafin & Ammon, 1996). Einzelne Hanffelder beziehungsweise Teilflächen, die stark verunkrautet waren, konnten jedoch in dieser Studie beobachtet werden. Ursachen für das schlechte Wachstum des Hanfs und einer entsprechend schwachen Unkrautunterdrückung waren nach Auskunft der Betriebe und eigenen Beobachtungen im Wesentlichen ungünstige Standortbedingungen (vernässter Boden, verlangsamte Jugendentwicklung durch Trockenheit im Frühjahr) oder ein später Aussaatzeitpunkt.
Die Ergebnisse zeigen, dass der Hanf vor allem von Stängel- und Blattfleckenkrankheiten befallen wird, wobei Botrytis cinerea, Fusarium spp. und Sclerotinia sclerotiorum auch Schäden an den Blütenständen verursachen. Ein Großteil der Erreger wurde in allen österreichischen Anbauregionen nachgewiesen. Mit weiterhin steigender Anbaufläche ist davon auszugehen, dass der Befallsdruck zunimmt und sich jene Schaderreger, welche bislang nur in einzelnen Gebieten auftreten, weiter ausbreiten. Ein Teil der nachgewiesenen Pilzarten, z. B. Botrytis cinerea, kann mit dem Saatgut übertragen werden, allerdings ist die Frage der Saatgutübertragbarkeit noch nicht für alle nachgewiesenen pilzlichen Schaderreger geklärt. Patschke et al. (1997) schlussfolgerten, dass fungizide Saatgutbehandlungen bei Hanf empfehlenswert sind. Mit aktuellem Stand (Juli 2022) sind im österreichischen Hanfanbau allerdings keine Fungizide zugelassen (Bundesamt für Ernährungssicherheit, 2022). Wichtige vorbeugende Maßnahmen stellen daher die Einhaltung einer mindestens vierjährigen Fruchtfolge, die Verwendung von gesundem Saatgut, gegebenenfalls die Entfernung von befallenen Pflanzenteilen bzw. Pflanzen sowie die Beseitigung bzw. das Unterpflügen von befallenen Pflanzenrückständen nach der Ernte dar (McPartland et al., 2000). Betreffend Sclerotinia sclerotiorum ist im Rahmen der Fruchtfolgeplanung der große Wirtspflanzenkreis dieses Schaderregers zu berücksichtigen. Wenig anfällig sind z. B. Getreidearten, Rüben und Kartoffeln.
Nach dem bisherigen Kenntnisstand wird in Nutzhanf kein gezielter Einsatz von Pflanzenschutzmitteln gegen tierische Schaderreger vorgenommen. Pflanzenschutzmittel zu deren Bekämpfung stehen bisher nur sehr eingeschränkt zu Verfügung (Bundesamt für Ernährungssicherheit, 2022). Die aktuellen Untersuchungen zeigen jedoch auf, dass bei einigen Insektenarten bei hohen Populationsdichten ertragsmindernde Auswirkungen zu erwarten sind. Der Befall durch die Hauptschädlinge (z. B. Grapholita delineana und Helicoverpa armigera) sollte keineswegs verharmlost werden, weil durch sie starke direkte und indirekte Schäden am Erntegut verursacht werden können (McPartland et al., 2000). Eine Möglichkeit der Hanfmotte entgegenzuwirken, stellt das gründliche Einarbeiten der Ernterückstände dar, da die Larven in den Hanfstängeln überwintern. Gegen die Junglarven der Baumwollkapseleule kann ein biologisches Präparat, ein Nucleopolyhedrovirus, zum Einsatz kommen. In Österreich ist der Einsatz von Trichogramma-Erzwespen gegen den Maiszünsler aktuell nur unter Glas zugelassen (Bundesamt für Ernährungssicherheit, 2022).
Unkräuter haben besonders bei hohen Bestandesdichten und normaler Entwicklung in Hanf nahezu keine Aufwuchsmöglichkeit. Eine Unkrautbekämpfung bei Hanf erscheint daher in der Regel nicht notwendig, wie dies auch in der Literatur vielfach postuliert wird (z. B. Amaducci et al., 2015, Campiglia et al., 2017). Befragte Betriebe in der gegenständlichen Studie verzichten auch auf eine Unkrautbekämpfung. Die Hauptunkräuter in Hanf (z. B. Amaranthus spp., Chenopodium album) sind konkurrenzstark (Holzner & Glauninger, 2005). Sie sollten daher prinzipiell nicht unterschätzt werden, denn gerade der Ölhanf ist eine hochwertige Kultur und bereits geringe Verluste im Samenertrag können sich auf den Erlös auswirken. Studien deuten auch darauf hin, dass eine Unkrautbekämpfung – gerade in der frühen Wachstumsphase der Hanfpflanze – für hohe Ernteerträge sinnvoll ist, wenn Hanf für die Samennutzung oder in geringen Pflanzendichten angebaut wird (Jankauskienė et al., 2014). Wichtige vorbeugende acker- und pflanzenbauliche Strategien zur Unkrautunterdrückung sind ein Anbau auf Flächen mit niedrigen Unkrautdichten und einem geringen Anteil an perennierenden Unkräutern, ein ebenes, feines Saatbett, die Anwendung der „falschen Saatbettbereitung“ vor der Aussaat und eine entsprechende Saatstärke, Saatzeit und Sortenwahl, um einen dichten und schnellschließenden Bestand zu gewährleisten.
Daten zum tatsächlichen Ausmaß eines Ertrags- und Qualitätsverlusts bei einer Verunkrautung bzw. Schädlings- oder Krankheitsdrucks sind kaum vorhanden. Anhand von nachfolgenden Untersuchungen sollte, vor allem im Hinblick auf die steigende Anbaufläche und daraus möglicherweise resultierenden engeren Fruchtfolgen, die Ertragsrelevanz und Bekämpfungswürdigkeit der nachgewiesenen Schaderreger erhoben werden.
Ein großer Dank gilt allen Landwirtinnen und Landwirten sowie Betrieben für die Bereitstellung ihrer Hanffelder zur Durchführung der Bonituren, Beprobungen und für den fachlichen Austausch. Des Weiteren danken wir Michael Schwarz (AGES) für die Kartenerstellung.
Die Autorinnen und Autoren erklären, dass keine Interessenskonflikte vorliegen.
Amaducci, S., D. Scordiab, F.H. Liuc, Q. Zhangd, H. Guod, G. Testab, S.L. Cosentino, 2015: Key cultivation techniques for hemp in Europe and China. Industrial Crops and Products 68, 2-16, DOI: 10.1016/j.indcrop.2014.06.041.
Bakro, F., K. Wielgusz, M. Bunalski, M. Jedryczka, 2018: An overview of pathogen and insect threats to fibre and oilseed hemp (Cannabis sativa L.) and methods for their biocontrol. IOBC-WPRS Bulletin 136, 9-20.
Bergstrom, G., J. Starr, K. Myers, J. Cummings, 2019: Diseases Affecting Hemp in New York. URL: https://hemp.cals.cornell.edu/resource/diseases-affecting-hemp-new-york-2019/. Zugriff: 16.03.2022.
Bosca, I., M. Karus, 1998: The cultivation of hemp: botany, varieties, cultivation and harvesting. Sebastopol, California (US), Hemptech. ISBN: 1886874034.
Braun-Blanquet, J., 1964: Pflanzensoziologie, Grundzüge der Vegetationskunde. 3. Auflage. Berlin, Deutschland, Springer-Verlag, DOI: 10.1007/978-3-7091-8110-2.
Britt, K.E., M.K. Pagani, T.P. Kuhar, 2019: First report of brown marmorated stink bug (Hemiptera: Pentatomidae) associated with Cannabis sativa (Rosales: Cannabaceae) in the United States. Journal of Integrated Pest Management 10 (1), 17, 1-3, DOI: 10.1093/jipm/pmz014.
Bundesamt für Ernährungssicherheit, 2022: Verzeichnis der in Österreich zugelassenen/genehmigten Pflanzenschutzmittel. URL: https://psmregister.baes.gv.at/psmregister/. Zugriff: 26.04.2022.
Campiglia, E., E. Radicetti, R. Mancinelli, 2017: Plant density and nitrogen fertilization affect agronomic performance of industrial hemp (Cannabis sativa L.) in Mediterranean environment. Industrial Crops and Products 100, 246-254, DOI: 10.1016/j.indcrop.2017.02.022.
Collins, D.W., A. Gaunt, M. von Tschirnhaus, D. Pye, 2016: The first occurrence of Liriomyza cannabis Hendel (Diptera, Agromyzidae) in Great Britain. Dipterists Digest 23, 163-167.
Cranshaw, W., M. Schreiner, K. Britt, T.P. Kuhar, J. McPartland, J. Grant, 2019: Developing insect pest management systems for hemp in the United States: A work in progress. Journal of Integrated Pest Management 10 (1), 26, 1-10, DOI: 10.1093/jipm/pmz023.
Fischer, M., W. Adler, K. Oswald, 2008: Exkursionsflora von Österreich, Liechtenstein und Südtirol. 3. Auflage. Linz, Österreich, Biologiezentrum der Oberösterreichischen Landesmuseen, ISBN 978-3-85474-187-9.
Follak, S., C. Schleicher, M. Schwarz, F. Essl, 2017: Major emerging alien plants in Austrian crop fields. Weed Research 57 (6), 406-416, DOI: 10.1111/wre.12272.
Gottwald, R., 2002: Entomologische Untersuchungen an Hanf (Cannabis sativa L.). Gesunde Pflanzen 54 (5), 146-152, DOI: 10.1046/j.1439-0345.2002.02002.x.
Heikertinger, F., 1913: Psylliodes attenuata Koch, der Hopfen- oder Hanf-Erdfloh. II. Teil. Morphologie und Bionomie der Imago. Verhandlungen der Zoologisch-Botanischen Gesellschaft in Wien 63, 98-136.
Hoffmann, G.M., 1958: Das Auftreten einer Anthraknose des Hanfes in Mecklenburg und Brandenburg. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 12, 96-99.
Hoffmann, G.M., 1959: Untersuchungen über die Anthraknose des Hanfes (Cannabis sativa L.). Phytopathologische Zeitschrift 35, 31-57.
Holzner, W., J. Glauninger, 2005: Ackerunkräuter, Bestimmung, Biologie, Landwirtschaftliche Bedeutung. Graz-Stuttgart, Deutschland, Leopold Stocker Verlag, ISBN 978-3-7020-0988-5.
Huss, H., 2012: Pilzkrankheiten im Ackerbau – Historischer Rückblick und aktuelle Entwicklungen. Stapfia 96, 195-209.
Israel, S., 2021: An in-depth companion planting guide. URL: https://www.motherearthnews.com/organic-gardening/companion-planting-guide-zmaz81mjzraw/. Zugriff: 11.04.2022.
Jankauskienė, Z., E. Gruzdevienė, S. Lazauskas, 2014: Potential of industrial hemp (Cannabis sativa L.) genotypes to suppress weeds. Zemdirbyste-Agriculture 101 (3), 265-270, DOI: 10.13080/z-a.2014.101.034.
Kauschitz, J., A. Plenk, 2022: Erstnachweis von Phaeomycocentrospora cantuariensis an Cannabis sativa in Österreich und Europa. Stapfia 113, 107-110, DOI: 10.2478/stapfia-2022-0006.
Klotz, S., I. Kühn, W. Durka, 2002: BIOLFLOR – Eine Datenbank zu biologisch-ökologischen Merkmalen der Gefäßpflanzen in Deutschland. Schriftenreihe für Vegetationskunde 38. Bonn, Deutschland, Bundesamt für Naturschutz, ISBN: 378433508X.
McPartland, J., R.C. Clarke, D.P. Watson, 2000: Hemp diseases and pests. Management and biological control. CABI Publishing, Oxfordshire, United Kingdom, ISBN: 0851994547.
McPartland, J., 2002: Epidemiology of the hemp borer, Grapholita delineana Walker (Lepidoptera: Oleuthreutidae), a pest of Cannabis sativa L. Journal of Industrial Hemp 7 (1), 25-41, DOI: 10.1300/J237v07n01_04.
Mehrtens, J., Schulte, M., Hurle, K., 2005: Unkrautflora in Mais. Gesunde Pflanzen 57, 206-218, DOI: 10.1007/s10343-005-0097-4.
Meixner, C., 2000: Pflanzenschutzprobleme bei Hanf (Cannabis sativa L.) in der Vegetationsperiode 1998. Diplomarbeit, Universität für Bodenkultur Wien.
Mielke, H., B. Schöber-Butin, 2002: Pflanzenschutz bei Nachwachsenden Rohstoffen – Zuckerrübe, Öl- und Faserpflanzen. Mitteilungen aus der biologischen Bundesanstalt für Land- und Forstwirtschaft Berlin-Dahlem 391, 71-83.
Moyses, A., S. Mottinger, S. Manhalter, R.A. Gottsberger, 2022: Erstnachweis des Eiparasitoiden Trissolcus basalis (Wollaston, 1858) in Österreich (Hymenoptera: Scelionidae). Journal für Kulturpflanzen, 74 (03-04), 94-96, DOI: 10.5073/JfK.2022.03-04.07.
Mucina, L., G. Grabherr, T. Ellmauer (Hrsg.), 1993: Die Pflanzengesellschaften Österreichs. Teil I: Anthropogene Vegetation. Gustav Fischer Verlag, Jena, Deutschland, ISBN: 3334604527.
Müller, F.P., E. Karl, 1976: Beitrag zur Kenntnis der Bionomie und Morphologie der Hanfblattlaus Phorodon cannabis Passerini, 1860 (Homoptera: Aphididae). Beiträge zur Entomologie 26 (2), 455-463, DOI: 10.21248/contrib.entomol.26.2.455-463.
Patschke, K., R. Gottwald, R. Müller, 1997: Erste Ergebnisse phytopathologischer Beobachtungen im Hanfanbau im Land Brandenburg. Nachrichtenblatt des Deutschen Pflanzenschutzdienstes 49 (11), 286-290.
Pinke, P., Blazsek, K., Magyar, L., Nagy, K., Karácsony, P., Czúcz, B., Botta-Dukát, Z., 2016: Weed species composition of conventional soyabean crops in Hungary is determined by environmental, cultural, weed management and site variables. Weed Research 56 (6), 470-481, DOI: 10.1111/wre.12225.
Serafin, F., H.U. Ammon, 1996: Notwendigkeit und Möglichkeiten der Unkrautbekämpfung in Kenaf, Chinaschilf und Hanf. Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz, Sonderheft XV, 255-264.
Söchting, H.-P., P. Zwerger, 2020: Untersuchungen zur Bedeutung des Auftretens von Datura stramonium in Mais und Rispenhirse. Julius-Kühn-Archiv 464, 57-63, DOI: 10.5073/jka.2020.464.007.
Statistik Austria, 2021: Anbau auf dem Ackerland, Kalenderjahr 2021 – Endgültige Ergebnisse. URL: https://www.statistik.at/fileadmin/publications/SB_1-16_Anbau_Ackerland-2021.pdf Zugriff: 10.08.2022.
Van der Maarel, E., 1979: Multivariate methods in phytosociology, with reference to the Netherlands. In: The Study of Vegetation. Werger, M. J. A. (Ed.), Dordrecht, Niederlande, Springer-Verlag, 161-225.
Weihrauch, F., 2000: Die Großschmetterlingsfauna an Kulturhopfen (Humulus lupulus L.) in der Hallertau (Lepidoptera: Hepialidae, Lasiocampidae, Sphingidae, Lycaenidae, Nymphalidae, Geometridae, Noctuidae, Lymantriidae, Arctiidae). Nachrichtenblatt der Bayerischen Entomologen 49 (1/2), 11-20.
Wiedermann, R., 1995: Pflanzensoziologisches Datenmanagement mittels PC-Programm HITAB5. Carinthia II 53, 133-134.
Wittmann, W., 1970: Ein neues Rezept zur Herstellung mykologischer Präparate. Pflanzenschutzberichte 41, 91-94.