

Journal für Kulturpflanzen, 75 (03-04). S. 104–113, 2023 | DOI: 10.5073/JfK.2023.03-04.03 | Becker et al.
Einfluss von Zwischenfruchtanbau bei Mais auf die Arthropoden Biomasse und Diversität
Effect of intercrop cultivation in maize stands on arthropods biomasses and diversity
 | Der Autor/Die Autorin 2023 Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Namensnennung 4.0 International Lizenz (CC BY 4.0) zur Verfügung gestellt wird (https://creativecommons.org/licenses/by/4.0/deed.de). |
Zur Veröffentlichung eingereicht/angenommen: 14. Dezember 2022/16. Februar 2023 |
In einem Feldversuch wurden acker- und pflanzenbauliche Effekte von sechs Zwischenfruchtmischungen sowie der Kontrolle ohne Zwischenfrucht im Maisanbau untersucht. Ebenfalls wurde die Arthropodenfauna mit Bodenfallen an drei Terminen im Jahr 2020 erfasst (10.-17.7.; 17.8. – 24.8.; 14.9. – 17.9.). Versuchsziel war es zu überprüfen, ob die auf dem Feld verbleibende pflanzliche Biomasse (dt TM/ha) und ihr Energiegehalt (GJ/ha) einen Einfluss auf die Diversität (Shannon-Weaner-Index) der Arthropodengemeinschaft und ihre Biomasse hat. Es wurde festgestellt, dass sich die Diversität der Arthropodengesellschaft zwischen einigen Varianten signifikant unterschied. Die Differenzen konnten jedoch nicht mit der eingebrachten pflanzlichen Biomasse und Energie oder anderen Faktoren (Anzahl Pflanzenarten in der Saatgutmischung, Winterfestigkeit der Zwischenfrüchte) erklärt werden. Jedoch nahm die Arthropodenbiomasse mit dem Anstieg der pflanzlichen Biomasse und des Energieeintrages zu. Das Ergebnis steht im Einklang mit Literaturbefunden zum Energietransfer im Nahrungsnetz und der unterschiedlichen Ressourcennutzung durch Arthropodenarten. Ebenso wird das Ergebnis im Rahmen mit politischen Ansätzen zur Förderung des Insektenschutzes diskutiert.
Zwischenfruchtanbau, Biodiversität, Arthropoden, Nahrungsnetz, Energiefluss, Intensität der Landwirtschaft
In a field trial, agronomic and crop effects of six intercrop mixtures and control (without catch crop) were investigated in maize cultivation. Additionally, the arthropod fauna was recorded with ground traps on in three dates in 2020 (10.-17.7.; 17.8. – 24.8.; 14.9. – 17.9.). The experimental objective was to verify whether the plant biomass remaining on the field (dt DM/ha) and its energy content (GJ/ha) have an impact on the diversity (Shannon-Weaner index) of the arthropod community and its biomass. It was found that the diversity of arthropod community differed significantly between some variants. However, the differences could not be explained by the introduced plant biomass and energy or other factors (number of plant species in the seed mixture, winter hardiness of the catch crops etc.). However, arthropod biomass increased as plant biomass and energy input increased. The result is consistent with literature findings on food web energy transfer and differential resource use by arthropod species. Similarly, the result is discussed in the context of policy approaches to promote insect conservation.
catch crop-growing, biodiversity, arthropods, food web, energy flow, agricultural intensity
In den letzten Jahren nahmen öffentliche und politische Diskussionen um die biologische Vielfalt einen erheblichen Raum ein. Sie wurden intensiviert durch Studien zur Insektenfauna, welche nachweisliche Einbußen in der Biomasse bei Fluginsekten erlitt (Sorg et al., 2013; Hallmann et al., 2017). Auch für speziellere Artengruppen, wie Schmetterlinge (Haslberger & Segerer, 2016; Habel et al., 2016; Thomas, 2016) oder Zikaden (Schuch et al., 2012) wurden Verluste im Artenbestand beschrieben.
Als Treiber von Biodiversitätsverlusten wird die Landwirtschaft mitverantwortlich gemacht (Emmerson et al., 2016; Hallmann et al., 2017) und Einflüsse einer sich wandelnden Landnutzung auf verschiedene Insektengruppen wurden statistisch belegt (Benton et al., 2002). Effekte resultierten aus Veränderungen der Agrarlandschaft z. B. des Grünlandanteils (Seibold et al., 2019), des Anteils natur- und naturnaher Flächen sowie der Fruchtartenvielfalt (Benton et al., 2002). Damit einhergehend wurden zugleich funktionale Ökosystemleistungen beeinflusst (Garibaldi et al., 2011; Holzschuh et al., 2012; Haenke et al., 2014; Rusch et al., 2016).
On-site Effekte auf Organismen wurden überwiegend dem Pflanzenschutzmitteleinsatz (Basedow et al., 1976; Benton et al., 2002; Geiger et al., 2010) und der Düngung (Vollhardt et al., 2019) zugeschrieben. Die Art der Bodenbearbeitung beeinflusste ebenfalls das Auftreten von Käfern und Regenwürmern (Kreuter & Schmidt, 2007).
Aufgeführte Off- und On-site Effekte auf Biodiversität werden häufig unter dem Begriff „Intensive Landwirtschaft“ undifferenziert betrachtet (Emmerson et al., 2016). Diese Sichtweise spiegelt sich auch in der Gesetzgebung und in Dokumenten der Politikberatung (Leopoldina, 2018; BMU, 2019; BGBl, 2021) wider.
Aus fachlicher Perspektive beeinflussen die aufgeführten Faktoren populationsdynamische Prozesse auf unterschiedlichen Ebenen, so z. B. über die Habitatfunktion (Fruchtartenvielfalt), Eingriffe in Stoffströme und in den Energietransfer des Nahrungsnetzes (Nährstoffgaben, Pflanzenschutz), weshalb auch Gonthier et al. (2014) betonen, dass auf die Ackerfläche ausgerichtete Maßnahmen den landschafts- und strukturbildenden Förderansätzen zum Erhalt von Biodiversität gleichzusetzen sind.
Dieser Rahmen gab Anlass in einem Feldversuch der Frage nachzugehen, inwieweit eine erweiterte Zufuhr pflanzlicher Biomasse das Auftreten von Arthropoden auf Ackerflächen beeinflusst und sich ein Zwischenfruchtanbau auf den Energietransfer im Nahrungsnetz auswirkt.
Der Versuch wurde innerhalb einer bestehenden acker- und pflanzenbaulichen Versuchsanlage zur Prüfung von Umwelteffekten des Zwischenfruchtanbaus in Mais durchgeführt. Im Abschlussbericht des Projektes (DBU, 2021) ist dieser Versuch in seiner Zielsetzung, Anlage und Methodik genauer beschrieben. Die Zwischenfrüchte wurden nach Winterweizen und Bodenbearbeitung (Pflug, Packer und Kreiselegge) am 9.8.2019 gesät. Im Frühjahr 2020 wurde der Aufwuchs gemulcht, gefräst und Silomais (Sorte „Mallory“ Reifezahl S220) nach Saatbettbereitung mit der Kreiselegge am 22.4.2020 gelegt.
Aus diesem Versuch wurden acker- und pflanzenbauliche Daten übernommen, so die verwendeten Pflanzenarten, ihre Saatgutanteile (Tab. 1) sowie mit den Anbauvarianten zugeführte ober- und unterirdische pflanzliche Biomasse.
Tab. 1. Charakterisierung der Zwischenfruchtvarianten
Versuchsvariante | Zwischenfruchtmischung* | Aussaatzeit und Saatmenge | Pflanzenarten und Anteile |
Var. 1 | Kontrolle ohne Zwischenfrucht |
| ohne |
Var. 2 | Sommerzwischenfrucht mit Nichtleguminosen, abfrierend (viterra MAIS) | Ansaat 21.8.2019 | 46 % Avena strigosa |
Var. 3 | Sommerzwischenfrucht mit Leguminosen, abfrierend (viterra BODENGARE) | Ansaat 21.8.2019 | 39 % Pisum sativum L. |
Var. 4 | Sommerzwischenfrucht mit Leguminosen und Nichtleguminosen, abfrierend (viterra TRIO) | Ansaat 21.8.2019 | 38 % Trifolium Alexandrinum L. |
Var. 5 | Winterzwischenfrucht mit Nichtleguminosen, nicht abfrierend (viterra UNIVERSAL WINTER) | Ansaat 22.8.2019 | 48 % Avena strigosa |
Var. 6 | Winterzwischenfrucht mit Leguminosen, nicht abfrierend (Eigenmischung) | Ansaat 22.8.2019 | 50 % Pisum sativum L. |
Var. 7 | Winterzwischenfrucht mit Leguminosen und Nichtleguminosen, nicht abfrierend (viterra LUNDSGAARDER GEMENGE) | Ansaat 22.8.2019 | 31 % Lolium multiflorum Lam. |
*Zusammensetzung der “viterra” Mischungen 2018; 2019
Die Umrechnung der zugeführten Biomasse in Energiewerte erfolgte über das Modell REPRO (Hülsbergen, 2003). Es differenziert die Energiegehalte der Zwischenfrüchte zwischen 14,8 MJ/kg TM (Erbse) und 27,9 MJ/kg TM (Öllein) und wurde für vorliegende Fragestellung mit weiteren Daten ergänzt (LfULG, 2010; LfL, 2011).
Tabelle 1 beschreibt die Zwischenfruchtvarianten, welche in der Anzahl der Mischungspartner, den Leguminosen- und Kruziferenanteilen sowie in der Winterfestigkeit variieren.
Mit Bodenfallen von 10 cm Durchmesser wurden die Arthropoden im Block 1 (B1) und 3 (B3) des gepflügten Bereichs der Versuchsanlage (Parzellengröße 67,5 m2) erfasst. Die Fänge erfolgten im Zeitraum vom 10.-17.7.2020; 17.8. – 24.8.2020 und 14.9. – 17.9.2020.
Die gefangenen Arthropoden wurden in 70 %igem Alkohol konserviert und in tropfnassem Zustand ihre Biomasse bestimmt. Anschließend wurden sie nach Stamm (Arthropoda), Unterstamm (z. B. Myriapoda), Ordnungen (z. B. Webespinnen (Arachnida), Weberknechte (Opiliones), Familien (z. B. Laufkäfer [Carabidae], Kurzflügelkäfer [Staphylinidae], Marienkäfer [Coccinellidae]) und Gattungen (z. B. Großlaufkäfer [Carabus], Sandlaufkäfer [Cincindela]) geordnet. Insgesamt wurden 15 Kategorien erfasst und für leichter kenntliche Individuen erfolgten Artbestimmungen (z. B. Getreidelaufkäfer [Zabrus tenebrioides Goeze], Schwarzer Krumhornkäfer [Loricera pillicornis Fabr.], Kupferfarbener Listkäfer (Poecilus cupreus Lin.], Buntfarbener Putzläufer [Platynus dorsalis Pontoppidan], Schwarzer Moderkäfer [Ocypus olens Müller], Totengräber [Necrophorus vespilloides Herbst].
Die Beschreibung der Arthropodengesellschaften erfolgte nach vorstehender Differenzierung über die Berechnung biologischer Kennzahlen: die Artenidentität nach Jaccard sowie die Dominanzidentität nach Renkonen. Sie beschreiben die relative Ähnlichkeit der Arthropodengesellschaften. Die Kennzahl „Diversität“ (Diversitätswert nach Shannon- Weaver) bündelt beide Informationen in einem dimensionslosen Index. Nach dem von MacArthur (1965) beschriebenen Verfahren (modifizierter t-Test) konnten die Diversitätsdifferenzen zwischen den Varianten auf Signifikanz geprüft werden.
Abhängigkeiten der Arthropodenbiomasse und der Diversität der Arthropodengemeinschaften von der Zufuhr pflanzlicher organischer Biomasse wurden über Korrelations- und Regressionsberechnungen geprüft. Unabhängige Parameter waren die Biomassezufuhr (dt TM/ha) bzw. die damit realisierte Energiezufuhr (GJ/ha).
Zusätzlich wurden Effekte weiterer acker- und pflanzenbaulicher Parameter (Anzahl Mischungspartner, Leguminosen/Nichtleguminosen – Anteile), Winterhärte der Zwischenfrüchte und der Biomasseverteilung (überwiegend ober- bzw. unterirdisch) auf die Diversität der Arthropodengemeinschaften über Mittelwertvergleiche überprüft. Signifikanzprüfungen erfolgten mit jeweils 10 % Irrtumswahrscheinlichkeit.
In der Tab. 2 ist die dem Anbausystem zugeführte pflanzliche Biomasse in dt TM/ha dargestellt, unterschieden nach den Wiederholungen (B1; B2) und dem ermittelten Lageort (oberirdisch, unterirdisch) der Pflanzenreste. In der Kontrollvariante resultiert die Biomasse allein aus Ernte- und Wurzelrückständen der Vorfrucht, in den weiteren Varianten zusätzlich aus verbliebenem Pflanzenmaterial der Zwischenfruchtmischungen. Daraus ergeben sich Unterschiede in der Biomassezufuhr und Verteilung auf die Bodenschichten (Abb. 1). In den Varianten 3 und 6 war der Biomasseanteil im Boden erhöht, in den Varianten 2, 4 und 5 war das Pflanzenmaterial überwiegend auf dem Boden abgelagert. Neben den Unterschieden innerhalb der ZF-Varianten 2 – 7 wird eine erhebliche Differenz zur Biomasseverteilung in der Kontrollvariante (1) sichtbar. Organisches Material war hier hauptsächlich auf dem Boden abgelagert.
Tab. 2. Mit dem Zwischenfruchtanbau zugeführte pflanzliche Biomasse (dt/ha) und Verteilung auf die Bodenschichten
| oberirdisch |
| unterirdisch |
| Gesamt | |||
Variante | B1 | B2 |
| B1 | B2 |
| Summe | Mittelwert |
Var. 1* | 3.33 | 4.58 |
| 31.91 | 4.3 |
| 44.12 | 11.03 |
Var. 2 | 22.38 | 28.43 |
| 39.84 | 68.13 |
| 158.78 | 39.68 |
Var. 3 | 26.71 | 22.25 |
| 19.69 | 9.51 |
| 78.16 | 19.54 |
Var. 4 | 19.56 | 16.44 |
| 29.88 | 19.47 |
| 85.35 | 21.34 |
Var. 5 | 20.61 | 24.59 |
| 35.08 | 31.46 |
| 111.74 | 27.94 |
Var. 6 | 38.60 | 36.18 |
| 31.69 | 11.09 |
| 117.56 | 29.39 |
Var. 7 | 32.58 | 32.74 |
| 30.33 | 24.32 |
| 119.87 | 29.97 |
*Biomassezufuhr über die Vorfrucht
Nach Tab. 1 sind die verwendeten ZF-Ansaaten Gemische mehrerer Pflanzenarten, deren Anteile und Energiegehalte verschieden sind. Auf Grundlage, der in Tab. 1 verzeichneten Saatgutanteile wurde, die in das Anbausystem mit dem Biomasseaufwuchs (Tab. 2) eingebrachte Energie (GJ/ha) ermittelt. Die berechneten Werte sind in der Tab. 3 enthalten, untersetzt nach den Wiederholungen sowie in Summe beider Werte und als Mittelwert. Danach variieren auch die eingebrachten Energiegehalte zwischen den Versuchsvarianten sehr deutlich. Zudem ergeben sich im Abgleich mit der eingebrachten Biomasse (Tab. 2) Verschiebungen in der Rangstellung der Varianten. So hat Var. 2 zwar eine höhere Biomasse als Var. 7, energetisch ergibt sich jedoch ein umgekehrtes Bild. Die Energiewerte unterscheiden auch die Var. 6 und 7 deutlicher voneinander.
Tab. 3. Mit der gesamten pflanzlichen Biomasse zugeführte Energie (GJ/ha)*
| Wiederholung |
| Gesamt | ||
Variante | B1 | B2 |
| Summe | Mittelwert |
Var. 1 | 64.78 | 17.59 |
| 82.37 | 41.18 |
Var. 2 | 117.62 | 184.97 |
| 302.59 | 151.29 |
Var. 3 | 92.98 | 63.65 |
| 156.63 | 78.31 |
Var. 4 | 88.67 | 64.40 |
| 153.07 | 76.53 |
Var. 5 | 102.68 | 103.34 |
| 206.02 | 103.01 |
Var. 6 | 132.83 | 89.33 |
| 222.16 | 111.08 |
Var. 7 | 142.05 | 179.76 |
| 321.81 | 160.90 |
*Berechnet nach Anteilen der Mischungspartner (vergl. Tab. 1) | |||||
Mit der Abb. 2 wird die abgefangene Arthropodenbiomasse in Summe der Wiederholungen und Fangperioden dargestellt, ebenso die Individuenanzahl der gefangenen Arthropoden. Ersichtlich wird eine Differenzierung beider Werte zwischen den Versuchsvarianten und es unterschied sich die Biomasse einzelner Varianten auch nach statistischen Gesichtspunkten. So hebt sich die in den Varianten 2 und 7 gefangene Arthropodenbiomasse gesichert von den Fängen aus der Kontrolle und z. T. von den Varianten 3 – 6 ab. Die Einflüsse des Zwischenfruchtanbaus auf die Arthropodengemeinschaften werden durch die Arten- und Dominanzidentität beschrieben. Die Identität auftretender Arten und Artengruppen lag im Mittel der Versuchsvarianten bei 66,2 % (min. 44,0 %, max. 75,0 %). Die Dominanzidentität variierte zwischen 68,9 % und 89,6 % bei einem Mittelwert von 78,7 %.
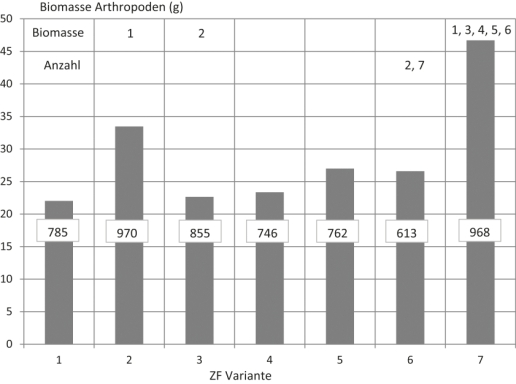
Abb. 2. Arthropodenbiomasse und Anzahl gefangener Arthropoden in den Varianten in Summe aller Untersuchungstermine und Wiederholungen. Obere Zahlen zeigen signifikante Unterschiede in der Biomasse und Individuenanzahl zu den benannten Varianten.
Der Diversitätsindex beurteilt beide Faktoren gemeinschaftlich und Diversitätsunterschiede ließen sich statistisch fassen, was mit der Abb. 3 dargestellt ist. Der Diversitätsindex der Varianten 2 – 4 und 7 war gegenüber der Kontrolle signifikant gemindert und die Varianten 5 und 6 waren ihr ähnlich. Auch die Arthropodengemeinschaften der Varianten 5 – 7 waren nach statistischer Maßgabe identisch.
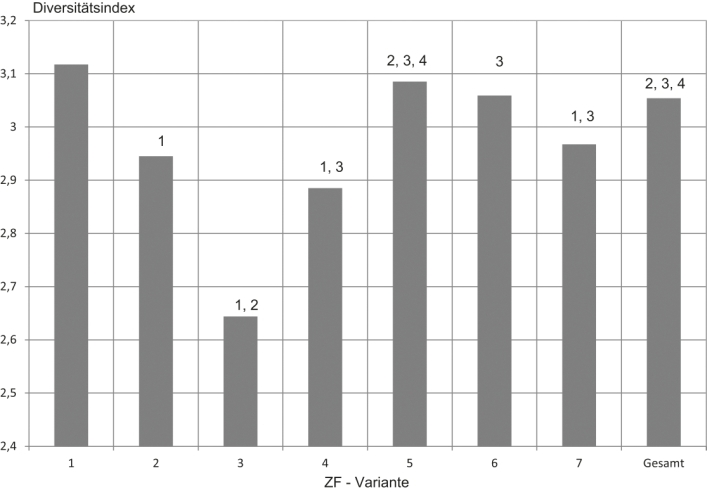
Abb. 3. Diversitätsindex der Versuchsvarianten in Summe der Fangtermine und Wiederholungen. Zahlen zeigen signifikante Unterschiede zu den genannten Varianten.
Die Arbeitshypothese stellt letzthin die Frage, ob Zusammenhänge zwischen der im Ökosystem verbleibenden pflanzlichen Biomasse, der mit ihr zugeführten Energie und der Arthropodenbiomasse bzw. Diversität der Arthropodengemeinschaften bestehen.
Mit den Darstellungen der Abb. 4 und 5 bestätigen sich vermutete Abhängigkeiten. Mit dem Pflanzenmaterial eingebrachte Biomasse bestimmt die Arthropodenbiomasse mit ca. 30 % Anteil. Unter Zugrundelegung der im Pflanzenmaterial enthaltenen Energie ergaben sich noch deutlichere Zusammenhänge (Abb. 5). Demnach war die Biomasse abgefangener Arthropoden zu ca. 60 – 80 % vom Energiegehalt der eingebrachten pflanzlichen Biomasse abhängig. Im Gegensatz zu diesen Befunden zeigte die Diversität der Arthropodengemeinschaften keine statistisch belegbare Abhängigkeit von der zugeführten Biomasse oder Energie. Auch die Anzahl der Mischungspartner der ZF-Varianten und ihre Vegetationsbeständigkeit hatten keinen tendenziellen Einfluss auf die Diversität der Arthropodenfauna. Ebenso hatte die Verteilung der pflanzlichen Biomasse auf die Bodenstraten keinen Einfluss.
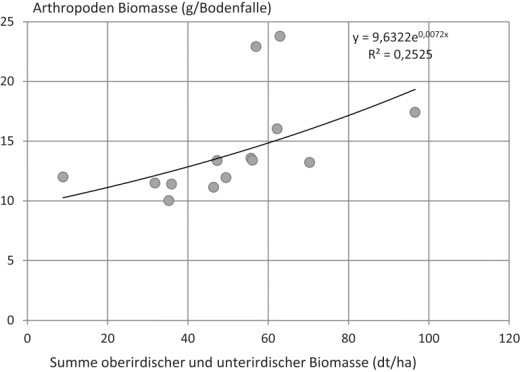
Abb. 4. Zusammenhang zwischen eingebrachter pflanzlicher Biomasse (dt/ha) und der gefangenen Arthropodenbiomasse (g/ Bodenfalle).
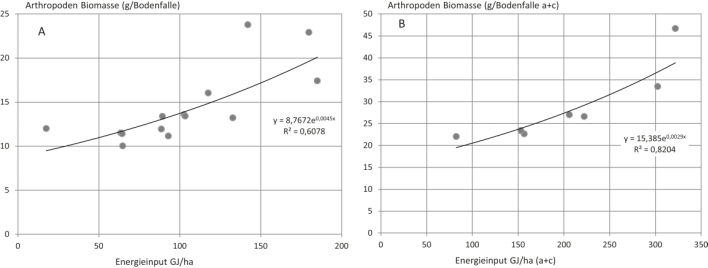
Abb. 5. Zusammenhang zwischen dem mit pflanzlicher Biomasse verbundenen Energieeintrag (GJ/ha) und der gefangenen Arthropodenbiomasse (g/Bodenfalle). A – Wiederholungen getrennt, B – Wiederholungen zusammengefasst.
Zum methodischen Verständnis ist bezüglich der Versuchsanlage und der durchgeführten Untersuchungen auf den Abschlussbericht zum Forschungsprojekt (DBU, 2021) zu verweisen. Er enthält zusätzliche Informationen zu acker- und pflanzenbaulichen Parametern, u. a. zu der Bodenbedeckung, den Maiserträgen, den Treibhausgasemissionen sowie der Energieeffizienz des ZF-Anbaus sowie ausführliche statistische Belege zur Wirkung des Zwischenfruchtanbaus auf diese Parameter.
Zur Methodik des Einflusses des Zwischenfruchtanbaus auf die belebte Umwelt sind mehrere Anmerkungen notwendig, um die Ergebnisse einzuordnen. So erfolgten die Fänge mit Bodenfallen. Bei dieser indirekten Fangmethode ist die Biomasse der erbeuteten Arthropoden von verschiedenen Faktoren abhängig (Heyer et al., 1993) und kann nicht direkt einer Flächeneinheit zugeordnet werden. Dennoch repräsentieren die Fänge die Arthropodenaktivität auf einer Anbauparzelle recht genau, weil sich im Verlauf der Vegetationszeit aggregierte Verteilungen in der Arthropodenfauna einstellen. Entsprechende Nachweise ergeben sich aus Untersuchungen von Heyer & Dammer (2000) zur Dispersionsdynamik von Laufkäfern auf einer Kleinfläche von 2000 m2 mit 8 Fruchtarten. Laufkäfer waren innerhalb dieses Raumes zunächst zufallsverteilt und im Verlauf der Vegetationszeit stellten sich Aggregationen in bestimmten Flächenbereichen ein. Diese Verteilung hatte Bestand, solange die Fruchtart als Lebensraum die Ansprüche der Käfer erfüllte.
Die eingebrachte pflanzliche Biomasse war nicht den Herkunftspflanzen zuzuordnen, weshalb die Berechnung der Energiewerte nach Artanteilen im Saatgut erfolgte. Die Energiewerte wurden dafür mit weiteren Literaturdaten (LfULG, 2010; LfL, 2011) abgeglichen und ergänzt. Diese Notwendigkeit bestand, da vorliegende Energiedaten vordergründig für betriebliche Fragestellungen, so z. B. dem Energieeinsatz [Input], der Energiebindung im abgeführten Ertrag oder dem Energiegewinn [Output], herangezogen wurden (Hülsbergen et al., 2001; Sanders & Heß, 2019) und des Weiteren der Erstellung von Futterrationen dienen. Der Energieertrag auf den Feldern verbleibender Pflanzenreste stand bisher weniger im wissenschaftlichen Fokus und Energiewerte beschränken sich auf landwirtschaftliche Hauptfruchtarten, Futterpflanzen und deren verwertbare Pflanzenteile in der Tierfütterung.
Daher wurden die Energieberechnungen nach möglichen Ertragsanteilen z. Z. des ZF- Umbruchs durchgeführt und für einzelne Pflanzenarten eine Mittelwertbildung über Pflanzenteile (z. B. Ölfrüchte) vorgenommen. Für die Ableitung genauerer Energiewerte bestehen weiterhin offene Fragen und Forschungsbedarf, insbesondere für weitere Pflanzenarten, sowohl für Saatmischungen im Zwischenfruchtanbau als auch für Blüh- und ökologische Ausgleichsflächen.
Trotz genannter Einschränkungen war die Versuchsfrage positiv zu beantworten. Die über Zwischenfrüchte zusätzlich in das Anbausystem eingebrachte Biomasse erhöhte die Biomasse der abgefangenen Arthropoden und dieser Zusammenhang war ebenfalls über die Energiezufuhr zu beschreiben, d. h. der Energietransfer über das Nahrungsnetz wird positiv beeinflusst. Ein Effekt, der auch von von Berg et al. (2010) auf Grundlage von Kohlenstoffisotop Analysen bei Maismulch beobachtet wurde und sich auch für andere Organismengruppen (Regenwurm) in Zusammenhang mit der zugeführten Strohmenge zeigte (Köpke, 2012).
Dahingegen war die Arten- und Dominanzstruktur der Lebensgemeinschaften nicht über die Biomasse- oder Energiezufuhr zu beschreiben und sie war weiterhin von der Biomasseverteilung über die Bodenstraten sowie von der quantitativen Saatgutzusammensetzung und deren Winterbeständigkeit unabhängig. Dieser Befund ordnet sich in Ergebnisse anderer Untersuchungen ein, welche andeuten, dass die Biodiversitätsausstattung der Flächen von den jeweiligen funktionalen Anforderungen des Ökosystems abhängt (Heyer & Christen, 2005; Leibold et al., 2017; Bannar-Martin et al., 2018). Funktionale Leistungen werden über Energieflüsse erbracht, jedoch über die Artenausstattung des Systems realisiert. Daher ist die Vielfalt der Lebensgemeinschaft eher von der energetischen Verwertbarkeit der Stoffe, der Ressourcenqualität und den mutualistischen Beziehungen innerhalb der Lebensgemeinschaften geprägt (von Berg et al., 2010; Brock et al., 2017; Heyer et al., 2018). Dies ist verständlich, denn Arten entstanden evolutionär aus der Anpassung an die Verwertung spezifischer Ressourcen und den interaktiven Beziehungen im Nahrungsnetz (Marklet al., 2019).
Zusätzlich modifiziert die Flächenbewirtschaftung die über die Trophiestufen ablaufenden Prozesse durch Fruchtartenwahl (Dammer & Heyer, 1997), Standort und Art der Bodenbearbeitung (Kreuter & Schmidt, 2007; Pätzold et al., 2019), den Nährstoffersatz, Einsatz von PSM etc. Letzthin belegen die Beispiele die Vielfalt wechselnder Anforderungen an die Leistung von Diversität in Agrar-Ökosystemen, weshalb in der Literatur auch der Begriff der ungeplanten „Assoziierten Biodiversität“ oder auch „Assoziierte Ökosystemdienstleistungen“ Verwendung findet (Tscharnke, 2012; Casagrande et al., 2017). Unter diesem Gesichtspunkt erscheint es zutreffend, dass die Ausprägung der Diversität der Lebensgemeinschaften nicht allein über energetische Abhängigkeiten beschrieben werden konnten und dieses Ergebnis nicht den Grenzen des Versuchsaufbaus geschuldet ist.
Dennoch erweitern die Untersuchungsbefunde die Möglichkeiten einer energetischen Beschreibung von Agrar-Ökosysteme (Steinborn, 2000) und die energetischen Betrachtungen erlauben zudem übergreifende Beurteilungen des Systemstatus und berühren somit auch verschiedene Umweltschutzgüter. Für die belebte Umwelt lassen sich Nahrungsnetze (Bossel, 1990) beschreiben und das „Biodiversitätspotenzial“ von Agrar-Ökosysteme aktuell und tendenziell auf indirektem Weg beurteilen (Siebrecht & Hülsbergen, 2008; Heyer & Christen, 2005).
Neben acker- und pflanzenbaulichen Parametern kann die Stärke des anthropogenen Eingriffs in den Naturkreislauf über den Energieeinsatz bei der Bodenbearbeitung, im Pflanzenschutz und der mineralischen Düngung erfasst werden. Andererseits beschreibt die im Anbausystem verbleibende pflanzliche Biomasse die Energiemenge, die potenziell für die Stärkung des Nahrungsnetzes und den Erhalt von „Gratisfunktionen“ der Biodiversität zur Verfügung steht.
Wenn Einflüsse auf Biodiversität zu beurteilen sind, kann letzthin das Verhältnis zwischen der Stärke des anthropogenen Energieeinsatzes und der im System verbleibenden Energie als „Intensität der Landnutzung“ im On-Site Kontext herangezogen werden.
Aus diesem Zusammenhang hat die vorliegende Untersuchung auch politische Dimensionen, denn Düngung und Pflanzenschutz sind in Stellungnahmen der Leopoldina zum Artenrückgang in der Agrarlandschaft (Leopoldina, 2018) angesprochen und als Handlungsbereiche 4 und 5 im Aktionsprogramm Insektenschutz explizit aufgeführt (BMU, 2019). Sie werden als Maßnahmen einer intensiven Landwirtschaft angesehen. Vorstehende Untersuchungsbefunde führen zu der Erkenntnis, dass die Betrachtung der Energieflüsse agrarischer Ökosysteme die Intensität der Landnutzung handlungsübergreifend erfassen kann und Rückschlüsse auf das natürliche Nahrungsnetz und potenzielle Leistung von Biodiversität ermöglicht. Bereits Benton et al. (2003), Gonthier et al. (2014) und Manning et al. (2019) verwiesen als politische Forderung auf die Notwendigkeit, multifaktorielle Ansätze zum Schutz und Erhalt von Biodiversität stärker zu beachten.
Alle Autoren und Autorinnen erklären, dass für die Veröffentlichung vorliegender Untersuchungsergebnisse keine Interessenskonflikte vorliegen.
Bannar-Martin, K.H., C.T. Kremer, S.K.M. Ernest, M.A. Leibold, H. Auge, J. Chase, S.A.J. Declerck, N. Eisenhauer, S. Harpole, H. Hillebrand, F. Isbell, T. Koffel, S. Larsen, A. Narwani, J.S. Petermann, Ch. Roscher, J.S. Cabral, S.R. Supp, 2018: Integrating community assembly and biodiversity to better understand ecosystem function: the Community Assembly and the Functioning of Ecosystems (CAFE) approach. Ecology Letters 21, 167–180, DOI: 10.1111/ele.12895.
Basedow, Th., Å. Borg, F. Scherney, 1976: Auswirkungen von Insektizidbehandlungen auf die epigäischen Raubarthropoden in Getreidefeldern, insbesondere die Laufkäfer [Col., Carabidae]. Entomologie Experimentalis et Applicata 19, 37 – 51, DOI: 10.1111/j.1570-7458.1976.tb02579.x.
Benton, T.G., D.M. Bryant, L. Cole, H.Q.P. Crick, 2002: Linking agricultural practice to insect and bird populations: a historical study over three decades. Journal of Applied Ecology 39, 673–687, DOI: 10.1046/j.1365-2664.2002.00745.x.
Benton, T.G., J.A. Vickery, J.D. Wilson, 2003: Farmland biodiversity: Is habitat heterogeneity the key? Trends in Ecology and Evolution 18 (4), 182–188, DOI: 10.1016/S0169-5347(03)00011-9.
BGBl, 2021: Gesetz zum Schutz der Insektenvielfalt in Deutschland und zur Änderung weiterer Vorschriften vom 18. August 2021. Bundesgesetzblatt Jahrgang 2021 Teil I Nr. 59, ausgegeben zu Bonn am 30. August 2021.
BMU, 2019: Aktionsprogramm Insektenschutz – Gemeinsam wirksam gegen das Insektensterben. Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit, 67 S.
Bossel, H., 1990: Ökosysteme und Ihre Entwicklung. In: Umweltwissen- Daten, Fakten, Zusammenhänge. Springer, Berlin, Heidelberg, 169 S., DOI: 10.1007/978-3-662-10701-0_6.
Brock, A., M. Kaestner, S. Trapp, 2017: Microbial growth yield estimates from thermodynamics and its importance for degradation of pesticides and formation of biogenic non-extractable residues. Environmental Research 28, 1-22, DOI: 10.1080/1062936X.2017.1365762.
Casagrande, M., L. Alletto, C. Naudin, A. Lenoir, A. Siah, F. Celette, 2017: Enhancing planned and associated biodiversity in French farming systems. Agronomy for Sustainable Development 37, 57, DOI: 10.1007/s13593-017-0463-5.
Dammer, K.-H., W. Heyer, 1997: Quantifying the influence of the cultivated plant species on the occurrence of carabid beetles within certain species using contingency table analysis. Environmental and Ecological Statistics 4, 321 – 336, DOI: 10.1023/A:1018543000013.
DBU, 2021: Abschlussbericht zum Projekt: Einfluss des Zwischenfruchtanbaus auf Lachgasemissionen, Stickstoffeffizienz und Energiebilanzen. DBU- Aktenzeichen: 33896/01 – 34, 49 S.
Emmerson, M., M.B. Morales, J.J. Oñate, P. Batáry, F. Berendse, J. Liira, T. Aavik, I. Guerrero, R. Bommarco, S. Eggers, T. Pärt, T. Tscharntke, W. Weisser, L. Clement, J. Bengtsson, 2016: Chapter Two – How agricultural intensification affects biodiversity and ecosystem services. Advances in Ecological Research 55, 43-97, DOI: 10.1016/bs.aecr.2016.08.005.
Geiger, F., J. Bengtsson, F. Berendse, W.W. Weisser, M. Emmerson, M.B. Morales, P. Ceryngier, J. Liira, T. Tscharntke, C. Winqvist, S. Eggers, R. Bommarco, T. Pärt, V. Bretagnolle, M. Plantegenest, L. W. Clement, Ch. Dennis, C. Palmer, J.J. Oñate, I. Guerrero et al., 2010: Persistent negative effects of pesticides on biodiversity and biological control potential on European farmland. Basic and Applied Ecology 11 (2), 97–105, DOI: 10.1016/j.baae.2009.12.001.
Gonthier, D.J., K.K. Ennis, S. Farinas, H.-Y. Hsieh, A.L. Iverson, P. Batáry, J. Rudolphi, T. Tscharntke, B.J. Cardinale, I. Perfecto, 2014: Biodiversity conservation in agriculture requires a multi-scale approach. Proceedings of the Royal Society B, Biological Sciences 281 (1791), 20141358, DOI: 10.1098/rspb.2014.1358.
Habel, J.C., A. Segerer, W. Ulrich, O. Torchyk, W.W. Weisser, T. Schmitt, 2016: Butterfly community shifts over two centuries. Conservation Biology, 30 (4), 754–762, DOI: 10.1111/cobi.12656.
Haenke S., A. Kovács-Hostyánszki, J. Fründ, P. Batáry, B. Jauker, T. Tscharntke, A. Holzschuh, 2014: Landscape configuration of crops and hedgerows drives local syrphid fly abundance. Journal of Applied Ecology 51 (2), 505-513, DOI: 10.1111/1365-2664.12221.
Hallmann, C.A., M. Sorg, E. Jongejans, H. Siepel, N. Hofland, H. Schwan, W. Stenmans, A. Müller, H. Sumser, T. Hörren, D. Goulson, H. de Kroon, 2017: More than 75 percent decline over 27 years in total flying insect biomass in protected areas. PLoS ONE 12 (10): e0185809, DOI: 10.1371/journal.pone.0185809.
Haslberger, A., A.H. Segerer, 2016: Checkliste der Schmetterlinge Bayerns. Supplement der Mitteilungen der Münchner Entomologischen Gesellschaft, Bd. 106, URL: http://barcoding-zsm.de/bayernfauna/lepidoptera.
Heyer, W., J. Döring, K.H. Dammer, 1993: Beurteilung des Fanges epigäischer Nützlinge mit Bodenfallen in Kulturpflanzenbeständen. Kühn Archiv, Landwirtschaftliche Fakultät der MLU Halle, 87, Heft 1, S. 53– 61.
Heyer, W., K.-H. Dammer, 2000: Der Einfluss landwirtschaftlicher Kulturpflanzen auf die Dispersionsdynamik von Carabiden – Ergebnisse eines Modellversuches. Archives of Phytopathology and Plant Protection 33 (1), 31–48, DOI: 10.1080/03235400009383326.
Heyer, W., O. Christen, 2005: Landwirtschaft und Biodiversität – Zusammenhänge und Wirkungen in Agrarökosystemen. Schriftenreihe des Institutes für Landwirtschaft und Umwelt, Heft 5/2000. 140 S.
Heyer, W., A. Deter, S.Vitzthum von Eckstädt, F. Reinicke, 2018: Einfluss perennierender und annueller Fruchtarten auf Arthropodengesellschaften – Dynamik und Triebkräfte in Agrar-Ökosystemen. Journal für Kulturpflanzen, 70 (9), 273–290, DOI: 10.5073/JfK.2018.09.01.
Holzschuh A., J.-H. Dudenhöffer, T. Tscharntke, 2012: Landscapes with wild bee habitats enhance pollination, fruit set and yield of sweet cherry. Biological Conservation 153, 101–107, DOI: 10.1016/j.biocon.2012.04.032.
Hülsbergen, K.-J., B. Feil, S. Biermann, G.-W. Rathke, W.-D. Kalk, W. Diepenbrock, 2001: A method of energy balancing in crop production and its application in a long-term fertilizer trial. Agriculture, Eco-systems and Environment 86, 303–321, DOI: 10.1016/S0167-8809(00)00286-3.
Hülsbergen K.-J., 2003: Entwicklung und Anwendung eines Bilanzierungsmodells zur Bewertung der Nachhaltigkeit landwirtschaftlicher Systeme, Berichte aus der Agrarwirtschaft. Aachen, Shaker Verlag.
Köpke, U., 2012: Körnerleguminosen im Ökologischen Landbau: Neue Ansätze. Vortrag 45. Fortbildungskurs „Ökologischer Landbau“, SIGÖL, Bad Düben, 8. März 2012.
Kreuter, T., W. Schmidt, 2007: Selbstregulation im pfluglosen Ackerbau. Abschlussbericht zum Projekt „Wirkung bodenschonender Bewirtschaftungsverfahren auf das Bodenleben und die Selbstregulation von Ackerflächen“. Schriftenreihe der Sächsischen Landesanstalt für Landwirtschaft, Heft 10.
Leibold, M.A., J. M. Chase, S.K.M. Ernest, 2017: Community assembly and the functioning of ecosystems: how metacommunity processes alter ecosystem attributes. Ecology 98 (4), 909–919, DOI: 10.1002/ecy.1697.
Leopoldina, 2018: Nationale Akademie der Wissenschaften Leopoldina, acatech – Deutsche Akademie der Technikwissenschaften, Union der deutschen Akademien der Wissenschaften – Artenrückgang in der Agrarlandschaft: Was wissen wir und was können wir tun? Halle (Saale).
LfL (Bayerische Landesanstalt für Landwirtschaft), 2011: Zwischenfruchtbau – LfL Informationen. 5 S.
LfULG (Sächsisches Landesamt für Umwelt, Landwirtschaft und Geologie), 2010: Ölfrüchte im Ökologischen Landbau – Informationen für die Praxis. 103 S.
MacArthur, R.H., 1965: Patterns of species diversity. Biological Reviews 40 (4), 510-533, DOI: 10.1111/j.1469-185X.1965.tb00815.x.
Manning, P., J. Loos, A. Barnes, P. Batary, F. Bianchi, N. Buchmann, G.B. Deyn, A. Ebeling, N. Eisenhauer, M. Fischer, J. Fründ, I. Grass, J. Isselstein, M. Jochum, A. Klein, E. Klingenberg, D. Landis, J. Leps, R. Lindborg, T. Tscharntke, 2019: Chapter Ten – Transferring biodiversity-ecosystem function research to the management of ‘real-world’ ecosystems. Advances in Ecological Research 61, DOI: 10.1016/bs.aecr. 2019.06.009.
Markl, J., D.E. Sadava, D.M. Hillis, H.C. Heller, S.D. Hacker, 2019: Artbildung. In: Markl, J. (Hrsg.) Purves Biologie. 10. Auflage, Springer Spektrum, Berlin, Heidelberg, S. 671-696, DOI: 10.1007/978-3-662-58172-8_22.
Garibaldi, L.A., I. Steffan-Dewenter, C. Kremen, J.M. Morales, R. Bommarco, S.A. Cunningham, L.G. Carvalheiro, N. P. Chacoff, J.H. Dudenhöffer, S.S. Greenleaf, A. Holzschuh, R. Isaacs, K. Krewenka, Y. Mandelik, M.M. Mayfield, L.A. Morandin, S.G. Potts, T.H. Ricketts, H. Szentgyörgyi, B.F. Viana, C. Westphal, R. Winfree, A.M. Klein, 2011: Stability of pollination services decreases with isolation from natural areas despite honey bee visits. Ecology Letters 14 (10), 1062-1072, DOI: 10.1111/j.1461-0248.2011.01669.x.
Pätzold, S., Ch. Hbirkou, D. Dicke, R. Gerhards, G. Welp, 2019: Linking weed patterns with soil properties: a long‑term case Study. Precision Agriculture 21, 569–588, DOI: 10.1007/s11119-019-09682-6.
Rusch A., R. Chaplin-Kramer, M.M. Gardiner, V. Hawro, J. Holland, D. Landis, C. Thies, T. Tscharntke, W.W. Weisser, C. Winqvist, M. Woltz, R. Bommarco, 2016: Agricultural landscape simplification reduces natural pest control: A quantitative synthesis. Agriculture, Ecosystems & Environment 221, 198-204, DOI: 10.1016/j.agee.2016.01.039.
Sanders J, J. Heß (Hrsg.), 2019: Leistungen des ökologischen Landbaus für Umwelt und Gesellschaft. 2. überarbeitete und ergänzte Auflage. Braunschweig: Johann Heinrich von Thünen-Institut, 398 S., Thünen Rep 65, DOI: 10.3220/REP1576488624000.
Schuch, S., K. Wesche, M. Schaefer, 2012: Long-term decline in the abundance of leafhoppers and planthoppers (Auchenorrhyncha) in Central European protected dry grasslands. Biological Conservation 149, 75–83, DOI: 10.1016/j.biocon. 2012.02.006.
Seibold S., M.M. Gossner, N.K. Simons, N. Blüthgen, J. Müller, D. Ambarli, Ch. Ammer, J. Bauhus, M. Fischer, J.C. Habel, K.-E. Linsenmair, T. Nauss, C. Penone, D. Prati, P. Schall, E.-D. Schulze, J. Vogt, S. Wöllauer, W.W. Weisser, 2019: Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574, 671–674, DOI: 10.1038/s41586-019-1684-3.
Siebrecht, N., K.-J. Hülsbergen, 2008: Das Biodiversitätspotential – ein Ansatz zur Analyse potenzieller biotischer Effekte Landwirtschaftlicher Betriebe. In: Mayer, J., T. Alföldi, F. Leiber, D. Dubois, P. Fried, F. Heckendorn, E. Hillmann, P. Klocke, A. Lüscher, S. Riedel, M. Stolze, F. Strasser, M. van der Heijden, H. Willer (Hrsg.) Werte – Wege – Wirkungen: Biolandbau im Spannungsfeld zwischen Ernährungssicherung, Markt und Klimawandel, Beiträge zur 10. Wissenschaftstagung Ökologischer Landbau, ETH Zürich, 11.-13. Februar 2009, Band 1, S. 410-413.
Sorg, M., H. Schwan, W. Stenmans, A. Müller, 2013: Ermittlung der Biomassen flugaktiver Insekten im Naturschutzgebiet Orbroicher Bruch mit Malaise-Fallen in den Jahren 1989 und 2013. Mitteilungen aus dem Entomologischen Verein Krefeld 1, 1-5.
Steinborn, W., 2000: Quantifizierung von Ökosystem-Eigenschaften als Grundlage für die Umweltbewertung. Dissertation, Christian-Albrechts-Universität zu Kiel, 119 S.
Thomas, J. A., 2016: Butterfly communities under threat. Science 353, 216-218, DOI: 10.1126/science.aaf8838.
Tscharnke, T., 2012: Pflanzenbauliches Handeln bestimmt Biodiversität und assoziierte Ökosystemdienstleistungen in Agrarökosystemen. Mitteilungen der Gesellschaft für Pflanzenbauwissenschaften 24, 17–20.
Vollhardt, I.M.G., Z. Ye, N. Parth, O. Rubbmark, J. Fründ, M. Traugott, 2019: Influence of plant fertilisation on cereal aphid-primary parasitoid-secondary parasitoid networks in simple and complex landscapes. Agriculture, Ecosystems & Environment 281, 47–55, DOI: 10.1016/j.agee.2019.04.030.
von Berg K., C. Thies, T. Tscharntke, S. Scheu, 2010: Changes in herbivore control in arable fields by detrital subsidies depend on predator species and vary in space. Oecologia 163, 1033-1042, DOI: 10.1007/s00442-010-1604-6.